修回日期: 2008-09-05
接受日期: 2008-09-08
在线出版日期: 2008-09-28
目的: 分析B7-H1和PD-1分子在原发性肝癌组织中的表达, 并探讨其在肝癌发生过程中的临床意义.
方法: 采用免疫组织化学染色和半定量逆转录聚合酶链反应(RT-PCR)检测42例原发性肝癌组织及对应的癌旁正常肝组织中B7-H1蛋白和mRNA表达, 分析B7-H1分子与肝癌分化程度、有无侵袭转移的关系. 分离肝组织内淋巴细胞, 流式细胞仪分析PD-1分子在T细胞表面表达, 以及B7-H1信号对肝癌组织内T细胞功能的影响.
结果: 原发性肝癌组织中B7-H1蛋白及mRNA表达水平均比癌旁组织和正常组织显著升高(85.71% vs 28.57%, 7.14%; 0.73±0.21 vs 0.35±0.12, 0.23±0.07, 均P<0.05), B7-H1阳性细胞与癌组织分化程度、有无侵袭转移相关(χ2 = 7.876, 8.492, 均P<0.05), 但与患者性别、年龄、肿瘤大小、肿块类型及AFP水平无相关关系. 肝癌组织中T细胞表达PD-1水平比癌旁对照显著上高(20.15%±3.47% vs 2.67%±0.53%, P<0.001).
结论: 肝癌中B7-H1分子表达可能抑制肝癌组织内T细胞功能, 促进肝癌细胞逃避免疫监控, 阻断肝癌细胞表面B7-H1/PD-1信号传导, 可能成为肝癌免疫治疗的新途径.
引文著录: 申民强, 孙趁意, 刘占举. B7-H1及其受体PD-1分子在原发性肝癌组织中的表达及临床意义. 世界华人消化杂志 2008; 16(27): 3110-3113
Revised: September 5, 2008
Accepted: September 8, 2008
Published online: September 28, 2008
AIM: To analyze expression of B7-H1 and PD-1 in primary hepatocelluar carcinoma (HCC) tissues and to investigate its role in HCC carcinogenesis.
METHODS: B7-H1 protein expression in HCC and normal liver tissues was determined using immunohistochemistry assay and real-time PCR (RT-PCR) in 42 patients. PD-1 expression in intrahepatic lymphocytes was detected using flow cytometry. The relationship between B7-H1 and the Edmondson grading and tumor metastasis of HCC were analyzed subsequently.
RESULTS: The B7-H1 protein and mRNA levels were significantly increased in HCC tissues compared with normal liver tissues (85.71% vs 28.57%, 7.14%; 0.73 ± 0.21 vs 0.35 ± 0.12, 0.23 ± 0.07, all P < 0.05). The expression of B7-H1 protein mRNA in HCC was not correlated to the gender of patients, age, tumor size, tissue type groups and α-fetoprotein expression, but significantly correlated to the Edmondson grading and tumor metastasis (χ2 = 7.876, 8.492, both P < 0.05). PD-1 was also highly expressed in T cells from HCC tissues than that in controls (20.15% ± 3.47% vs 2.67% ± 0.53%, P < 0.001).
CONCLUSION: B7-H1 is highly expressed in HCC tissues, and the expression of B7-H1 can reflect the HCC infiltration. Therefore, blockade of B7-H1 signaling pathway may have a therapeutic role in HCC treatment.
- Citation: Shen MQ, Sun CY, Liu ZJ. Expression and clinical significance of B7-H1 and PD-1 in primary hepatocellular carcinoma tissues. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3110-3113
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3110.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3110
抗原特异性T细胞的活化需要两个信号, 即TCR介导的抗原特异性信号和共刺激分子介导的共刺激信号. B7-H1是B7家族中另一个T细胞共刺激分子, 能促进T细胞的增殖和IL-10的产生, 与表达在T细胞表面的受体PD-1分子结合, 传递抑制性信号, 对外周组织中T细胞耐受具有重要调节作用[1-3]. 研究发现, B7-H1在一些非淋巴组织、少数造血组织, 以及一些肿瘤组织(如肺癌、卵巢癌、大肠癌、黑色素瘤)中有表达, 并参与局部免疫调节应答. B7-H1与PD-1结合后, 能抑制T细胞、B细胞功能, 从而介导肿瘤免疫逃逸, 促进肿瘤生长[1-3]. 本研究分析B7-H1和PD-1分子在原发性肝癌(hepatocellular carcinoma, HCC)组织和癌旁肝组织中表达, 旨在探讨他们在HCC发生过程中的免疫病理作用和肝癌预后的影响.
收集2005-08/2008-05在郑州大学二附院普外科住院HCC患者42例, 均接受手术切除治疗, 采集新鲜肝癌组织和癌旁肝组织标本, 各42例, 其中男28例, 女14例, 年龄31-74(平均42.5±13.2)岁, 高、中分化患者30例, 低度分化患者12例, 所有病例均未行化疗及生物免疫治疗, 亦未合并自身免疫性疾病及其他器官的肿瘤(如肺癌、胃癌、结肠癌等). 同时, 收集在消化内科住院接受肝组织活检的12例正常肝组织(男7例, 女5例, 年龄25-54岁)和14例慢性乙肝患者(男9例, 女5例, 年龄22-49岁)肝脏活检组织标本作为对照研究. 所有标本均有详细临床资料, 并经病理证实. 手术标本取材时, HCC组织均取自癌变原发灶, 避开坏死、炎症区域, 癌旁组织取自相应肿块旁3-5 cm肝组织. 将手术标本和活检组织标本立即置于液氮罐中速冻, 后转移至-80 ℃超低温冰箱保存备用. 所有实验研究均得到研究对象的同意, 并得到医院医学伦理部门的批准. 淋巴细胞分离液购于上海试剂二厂; 细胞培养用RPMI 1640培养基、胎牛血清购于美国Hyclone公司; 谷氨酰胺、肝组织淋巴细胞分离液Percoll购于美国Sigma公司; 鼠抗人B7-H1 mAb(5H1)由中国科学院生物物理研究所感染与免疫中心王盛典教授馈赠; PE-标记的小鼠抗人PD-1单抗、FITC-标记的抗人CD3单抗购于美国BD Biosciences公司; 免疫组化SP试剂盒购于福州迈新生物技术公司; 其他试剂均为国产分析纯. 根据GenBank检索的Canstatin的基因序列利用Premier 5软件辅助分析设计B7-H1及β-actin的引物, B7-H1引物序列如下: 上游引物为5'-GACCTATATGTGGTAGAGTATGGTAGC-3', 下游序列为5'-TTCAGCTGTATGGTTTTCCTCAGGATC-3', 扩增产物594 bp; β-actin引物上游序列为5'-ACCAACTGGGACGACATGGAGAAAATC-3', 下游为5'-GTAGCCGCGCTCGGTGAGGATCTTCAT-3', 产物409 bp. 以上引物均由北京奥科公司合成.
1.2.1 免疫组化染色: 免疫组织化学染色方法见我们既往报道[4-6], 简述如下: 新鲜冰冻标本, 切片厚度5 mm, 用30 mL/L的H2O2作用5 min阻断内源性抗原. 加入小鼠抗人B7-H1 mAb(5H1克隆, 1:100稀释), 4 ℃过夜, 次晨依次加二抗, DAB显色, 苏木素复染细胞核. 用正常PBS或小鼠血清代替一抗作阴性对照, 以已知的胃癌组织染色呈强阳性反应的表本作阳性对照. B7-H1表达分析通过计数在胞膜上或/和胞质内有阳性染色的细胞个数, 在×200倍镜下随机选择的5个肿瘤区域进行细胞计数. B7-H1的染色强度根据阳性细胞的百分比进行半定量分级, 0: <10%; +: 10%-40%; ++: 40%-80%; +++: >80%. 结果判断: <10%为阴性; 10%-100%为阳性.
1.2.2 RT-PCR: 将标本(50-80 mg)放在装有液氮的研钵中充分研磨, 按照TRIzol试剂说明书逐步加入氯仿、异丙醇、乙醇等提取RNA, 并测定RNA浓度、纯度和完整性. 以提取的总RNA为模板, 按RevertAidTM First Strand cDNA Sythesis kit反转录试剂盒说明书进行操作. 反转录步骤如下: 总RNA 5 μL, Oligo-(dT)Primer 1 μL, 无RNase水6 μL, 混匀, 离心. 70 ℃, 5 min; 立即置于冰浴, 2 min. 加入5×Buffer 4 μL, RNase抑制剂1 μL, dNTP 2 μL, 混匀, 37 ℃ 5 min; 加入反转录酶1 μL, 42 ℃ 60 min; 70 ℃ 10 min; 立即置于冰浴, 合成cDNA第1链. 以cDNA为模板进行PCR扩增, PCR扩增反应步骤如下: 反应体积为25 μL, 94 ℃预变性5 min; 94 ℃变性30 s, 61 ℃褪火30 s, 72 ℃延伸60 s, 共35循环. PCR产物经15 g/L琼脂糖凝胶电泳(溴化乙锭染色)后, 紫外透射反射仪下观察结果, 并在凝胶成像仪上照相, 扫描所得灰度值进行统计学分析[4-6].
1.2.3 肝脏组织内淋巴细胞分离: 肝组织内淋巴细胞分离方法见参照我们既往报道[7]. 简述为, 组织标本放于含有抗生素的PBS液冲洗, 去除表面的红细胞, 然后将标本转至37 ℃含有胶原酶A(1 g/L)和DNA酶(5 μg/L)的消化液中消化3-4 h, 然后通过Percoll淋巴细胞分离液离心(600 g 20 min), 取得肝组织内单个核淋巴细胞, 用于流式细胞仪分析.
1.2.4 流式细胞仪检测: 将上述分离得到的肝组织内淋巴细胞配制成1×109/L浓度, 取样本100 μL, 用含有2 g/L胎牛血清白蛋白和1 g/L NaN3的PBS洗2次. 然后用含有合适浓度的荧光素抗体(如PE-PD-1、FITC-CD3、同型Ig对照抗体), 于4 ℃染色, 30 min后, 用PBS洗2次去除未结合的抗体, 用30 g/L多聚甲醛溶液固定, 最后用流式细胞仪(FACSort, 美国BD公司)分析, CellQuest软件分析, 计算PD-1阳性T细胞数[5].
统计学处理 B7-H1表达水平以mean±SD表示, 采用SPSS13.0统计分析软包分析, 根据资料类型采用ANOVA、t检验、χ2检验, 取P<0.05为差异有统计学意义.
B7-H1染色在肝癌组织中均表达增强(++以上), 主要在癌细胞膜和胞质内, 呈棕黄至棕褐色颗粒或团块, 多区域分布, B7-H1表达阳性率为85.71%(36/42); 而癌旁组织阳性表达率为28.57%(12/42), 肝炎组织或正常组织仅微弱表达, 阳性率为7.14%(3/42)仅有少量表达. 统计学分析发现, HCC组织中B7-H1阳性表达率明显高于癌旁组织和正常组织(P<0.05). 进一步分析发现(表1), B7-H1染色强弱与细胞分化程度相关, 癌细胞分化程度相对较高, 侵袭能力较低, B7-H1染色较弱; 癌细胞异型性明显, 分化程度较低, B7-H1染色强, 并与肿瘤的侵袭性生长相一致.
| 分组 | n | B7-H1阳性n(%) | χ2 | P |
| 癌灶转移 | ||||
| 有 | 27 | 20(74.07) | 7.876 | <0.05 |
| 无 | 15 | 15(100.00) | ||
| 病理分级 | ||||
| Ⅰ-Ⅱ | 19 | 14(73.68) | 8.492 | <0.05 |
| III-Ⅳ | 23 | 21(91.30) |
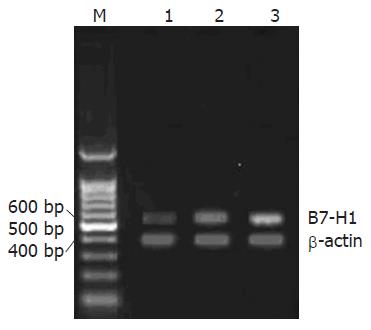
HCC组织中B7-H1 mRNA条带明显增亮, 应用灰度扫描半定量分析, B7-H1 mRNA在HCC组织、癌旁组织和正常组织中阳性表达灰度值分别为0.73±0.21、0.35±0.12和0.23±0.07, 统计学分析发现, B7-H1 mRNA在HCC组织的表达水平明显高于癌旁组织(P = 0.041)和正常组织(P = 0.015); 而癌旁组织和正常组织间B7-H1 mRNA表达, 差异无显著性(P = 0.9231, 图1).
B7-H1阳性表达与HCC的病理分级和有无侵袭转移相关(χ2 = 7.876, 8.492, 均P<0.05, 表1); 但与患者性别、年龄、肿瘤大小、肿块类型、AFP水平无关.
使用肝组织标本, 分离肝组织内淋巴细胞, 通过流式细胞仪分析发现, PD-1+CD3+ T细胞数在HCC组织内明显高于癌旁组织(20.15%±3.47% vs 2.67%±0.53%, P<0.001), 提示在癌变组织内T细胞表达B7-H1的配体明显升高, 可能参与癌变组织的免疫调节作用.
目前研究认为[1-3], B7-H1通过与PD-1结合后抑制T、B细胞的功能, 抑制机体的特异性细胞免疫和体液免疫能力, 诱导特异性细胞毒性T淋巴细胞(CTL)凋亡, 而使肿瘤细胞发生免疫逃逸, 促进肿瘤生长. 既往报道发现[2-3], 造血系统和非造血系统肿瘤细胞表面均有B7-Hl表达, 在乳腺癌、肺癌、胃癌、结肠腺癌等组织也检测到B7-H1表达. 将B7-H1转染小鼠肥大细胞瘤P815细胞株, 注射入免疫缺陷型小鼠内, 建立腹腔肿瘤模型[8], 研究发现相应小鼠的肿瘤呈进行性生长, 病理分析发现在肿瘤早期便出现腹腔广泛播散和血运转移, 若将荷瘤小鼠PD-1基因敲除, 肿瘤生长即受到了明显的抑制. 此研究证实了B7-H1在肿瘤细胞上表达削弱其免疫原性, 影响CTL效应应答, 抑制肿瘤免疫应答产生[9]. 此外, 研究报道发现[10], 肿瘤细胞表达B7-H1还使其对CTL的细胞毒杀伤效应敏感性下降, 提示B7-H1信号能通过诱导特异性CTL调亡, 促使肿瘤细胞发生免疫逃逸.
本研究发现, 肝癌细胞B7-H1表达明显高于癌旁组织及正常组织, HCC恶性程度越高, B7-H1表达越强, B7-H1表达水平在伴有侵袭转移的肝癌中明显高于无侵袭转移的肝癌. HCC组织内PD-1阳性的T细胞浸润也明显增强, 提示在HCC癌变过程中, B7-H1分子可能直接与其受体PD-1相互作用, 参与了肝脏内T细胞免疫耐受, 并抑制HCC组织内CTL效应功能, 促使HCC的侵袭转移, 并诱导肝癌细胞免疫逃避出现.
目前有研究发现, 抗B7-H1单抗能明显抑制B7-H1转染的P815荷瘤小鼠局部肿瘤的生长, 并出现良好的完全缓解率[11]. 通过建立B7-H1-SCCV的荷瘤小鼠模型的基础上, 使用B7-H1单抗和特异性T细胞过继免疫治疗, 有效率为60%, 明显提高荷瘤小鼠远期存活率[12]. 另有报道[13], 小鼠体内使用可溶性的PD-1蛋白治疗, 抑制B7-H1信号作用, 可以显著阻断接种有肝癌细胞株H22的皮下生长. 在健康状态下, 肝组织内血窦内皮细胞表达低水平的B7-H1分子, 进而维持肝组织内T细胞免疫耐受状态[14]. 肝癌的发生可能是多因素诱发, 乙、丙型肝炎病毒感染, 黄曲霉毒素污染, 饮酒和电离辐射等共同参与了疾病发展过程[15]. 本研究结果表明, B7-H1分子有可能成为判断HCC侵袭转移能力及肝癌患者预后的一个新指标, 通过阻断B7-H1/PD-1信号通路, 可能用于治疗HCC, 为靶向生物治疗HCC奠定了重要理论基础.
B7-H1是B7家族中的共刺激信号分子之一, 与表达在T细胞表面的受体PD-1分子结合, 传递抑制性信号, 抑制T、B细胞功能, 介导肿瘤免疫逃逸, 促进肿瘤生长, 对外周组织中T细胞耐受具有重要调节作用. 本文是课题组研究B7-H1和PD-1分子在原发性肝癌组织表达, 分析B7-H1分子在肝癌发生过程中免疫病理作用.
李旭, 副教授, 广东省广州市南方医院急诊科; 刘正稳, 教授, 西安交通大学医学院第一附属医院
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
国内外有学者曾经发现B7-H1分子在胃癌、结肠癌、肾癌等组织内表达升高, 并诱导肿瘤组织内T细胞免疫耐受, 促使肿瘤生长, 但缺乏在肝癌中的研究.
本文运用免疫组织化学、RT-PCR和流式细胞仪方法探讨B7-H1在肝癌组织中表达, 结果表明B7-H1在肝癌组织中表达升高, 与癌细胞分化程度、病理分级和有无侵袭转移有密切关系.
通过检测B7-H1, 可早期诊断肝癌, 判断肝癌的侵袭转移能力和预后.
本文探讨了B7-H1及其受体PD-1分子在原发性肝癌组织中的表达及临床意义, 有一定的创新性, 分析讨论逻辑性尚可, 具有一定的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Greenwald RJ, Freeman GJ, Sharpe AH. The B7 family revisited. Annu Rev Immunol. 2005;23:515-548. [PubMed] [DOI] |
| 2. | Keir ME, Butte MJ, Freeman GJ, Sharpe AH. PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol. 2008;26:677-704. [PubMed] [DOI] |
| 3. | Okazaki T, Honjo T. The PD-1-PD-L pathway in immunological tolerance. Trends Immunol. 2006;27:195-201. [PubMed] [DOI] |
| 4. | 孙 趁意, 唐 芙爱, 刘 占举. B7-H1在慢性乙型肝炎肝组织中的表达及临床意义. 河南科技大学学报(医学版). 2008;26:94-96. |
| 7. | Liu Z, Jiu J, Liu S, Fa X, Li F, Du Y. Blockage of tumor necrosis factor prevents intestinal mucosal inflammation through down-regulation of interleukin-23 secretion. J Autoimmun. 2007;29:187-194. [PubMed] [DOI] |
| 8. | Curiel TJ, Wei S, Dong H, Alvarez X, Cheng P, Mottram P, Krzysiek R, Knutson KL, Daniel B, Zimmermann MC. Blockade of B7-H1 improves myeloid dendritic cell-mediated antitumor immunity. Nat Med. 2003;9:562-567. [PubMed] [DOI] |
| 9. | Mazanet MM, Hughes CC. B7-H1 is expressed by human endothelial cells and suppresses T cell cytokine synthesis. J Immunol. 2002;169:3581-3588. [PubMed] |
| 10. | Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, Roche PC, Lu J, Zhu G, Tamada K. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med. 2002;8:793-800. [PubMed] |
| 11. | Iwai Y, Ishida M, Tanaka Y, Okazaki T, Honjo T, Minato N. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci USA. 2002;99:12293-12297. [PubMed] [DOI] |
| 12. | Strome SE, Dong H, Tamura H, Voss SG, Flies DB, Tamada K, Salomao D, Cheville J, Hirano F, Lin W. B7-H1 blockade augments adoptive T-cell immunotherapy for squamous cell carcinoma. Cancer Res. 2003;63:6501-6505. [PubMed] |
| 13. | He L, Zhang G, He Y, Zhu H, Zhang H, Feng Z. Blockade of B7-H1 with sPD-1 improves immunity against murine hepatocarcinoma. Anticancer Res. 2005;25:3309-3313. [PubMed] |
| 14. | Diehl L, Schurich A, Grochtmann R, Hegenbarth S, Chen L, Knolle PA. Tolerogenic maturation of liver sinusoidal endothelial cells promotes B7-homolog 1-dependent CD8+ T cell tolerance. Hepatology. 2008;47:296-305. [PubMed] [DOI] |