修回日期: 2008-08-23
接受日期: 2008-08-26
在线出版日期: 2008-09-28
目的: 观察γ-氨基丁酸(GABA)对人肝细胞株Huh-7基因表达的影响.
方法: 将10 μmol/L GABA与Huh-7细胞共同孵育24 h, 以PBS处理的Huh-7细胞为对照, 提取mRNA, 并逆转录成cDNA. 与芯片杂交, 根据杂交信号强弱筛选相关基因.
结果: 共筛选出27条差异表达的基因, 其中11条基因表达下调, 16条基因表达上调, 这些基因主要是与细胞增殖、凋亡及免疫功能相关, 另外还有部分基因功能不详.
结论: GABA对肝细胞基因表达谱有一定作用, GABA可能参与肝细胞功能的调控.
引文著录: 邱爽, 张会英, 李国力. γ-氨基丁酸对人肝细胞株基因表达的影响. 世界华人消化杂志 2008; 16(27): 3095-3098
Revised: August 23, 2008
Accepted: August 26, 2008
Published online: September 28, 2008
AIM: To investigate role of gamma aminobutyric acid (GABA) in Huh-7 cell expression.
METHODS: Huh-7 cell lines were co-cultured with 10 μmol/L GABA for 24 h, and then mRNA was extracted from the cells to reversely transcribe into cDNA. The cDNA profile was analyzed using microarray assay.
RESULTS: Forty one differentially expressed genes were screened, of which 16 were up-regulated while 11 were down-regulated significantly. The above genes were mainly involved in cell proliferation, apoptosis and immunologic function, and functions of other genes remained unknown.
CONCLUSION: Differentially expressed profiles under the action of GABA are successfully screened using microarray technique, indicating that GABA may participate in regulation of liver cell function.
- Citation: Qiu S, Zhang HY, Li GL. Effect of gamma-aminobutyric acid on the gene expression of Huh-7 cell lines. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3095-3098
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3095.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3095
γ-氨基丁酸(GABA)是一种哺乳动物中枢神经系统中重要的抑制性神经递质, 具有重要的生理功能. 近年临床研究表明, 在急慢性肝病患者中, 血清GABA水平升高, 肝再生活性下降, GABA受体拮抗剂促进肝再生, 提示GABA可能抑制肝再生[1]. 在体外实验中我们发现在促纤维化因子-血管紧张素作用下大鼠肝星状细胞GABA受体表达下调, 而在HBV病毒大蛋白的刺激下HepG2肝癌细胞株GABA受体表达上调, 这些都提示GABA不仅在神经系统中发挥作用, 而且在肝脏的生理、病理过程中发挥一定作用. 本研究拟以基因芯片技术对GABA作用下的肝细胞的基因表达谱进行展示, 并初步探讨GABA对肝细胞的影响.
高分化人肝癌细胞株Huh-7为本实验室保存. GABA为Sigma公司. 细胞培养相关试剂及总RNA提取试剂TRIzol均购自Invitrogen公司. 人类基因组芯片包括原癌基因和抑癌基因、离子通道和运输蛋白、细胞周期蛋白类、细胞受体、免疫调节相关基因、细胞凋亡和应激反应蛋白相关基因、细胞信号转导相关基因等4096个cDNA, 由上海联合基因有限公司提供. mRNA纯化试剂等购自Qiagen公司.
Huh-7细胞生长至对数期时加入10 μmol/L GABA, 24 h后收获细胞, 每5×106个细胞加入1 mol/L TRIzol, 提取GABA及PBS处理的Huh-7细胞总RNA, 样品经分光光度计检测吸光度A值, 并行热稳定实验, 于-20 ℃和70 ℃保温1h后, 经琼脂糖凝胶电泳检测28、18S条带变化. 总RNA逆转录标记cDNA 探针并纯化. Cy3-dUTP标记对照组细胞mRNA(5 μg), Cy5-dUTP标记实验组细胞mRNA(5 μg). 乙醇沉淀后溶解在20 μL 5×SSC+2 g/L SDS杂交液中.
靶基因以0.5 mg/L溶解于3×SSC溶液中, 用Cartesian公司的Cartesian7500点样仪及TeleChem公司的硅烷化玻片进行点样. 玻片经水合2 h、室温干燥0.5 h, UV交联, 再分别用2 g/L SDS、水及2 g/L的硼氢化钠溶液处理10 min, 晾干备用. 将基因芯片和杂交探针在95 ℃水浴变性5 min, 将混合探针加在基因芯片上, 置于60 ℃杂交15-17 h. 依次以2×SSC+2 g/L SDS、1 g/L×SSC+2 g/L SDS、1 g/L SSC洗涤10 min, 室温晾干. 用General Scanning公司的ScanArray3000扫描芯片. 为了监控芯片杂交技术体系的整个过程, 用预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正. 用ImaGene3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值. 阳性结果判断: Cy5/Cy3>2.0, 红色荧光, 显示表达增强; Cy5/Cy3<0.5, 为绿色荧光, 显示表达减弱; 黄色代表表达水平无差异.
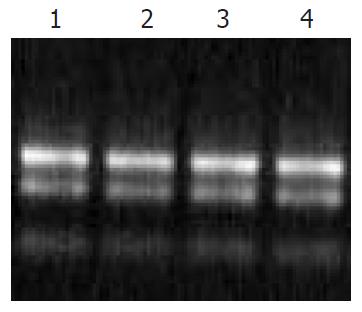
总RNA的吸光度A260/A280>1.80, 热稳定实验70 ℃保温1 h与-20 ℃ 1 h电泳条带比较, 显示28S条带无明显降解, 电泳结果证实已抽提高纯度的总RNA(图1). mRNA主要集中于0.9-4.0 kb的连续条带.
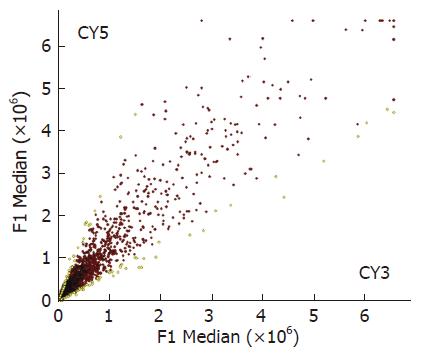
实验组探针标记Cy5(红色), 对照组探针标记Cy3(绿色), 红绿颜色的差异就显示该基因在实验组和对照组中基因表达水平上的差异, 黄色代表表达水平无差异. Cy5/Cy3>2.0, 红色荧光, 显示表达增强; Cy5/Cy3<0.5, 为绿色荧光, 显示表达减弱; 黄色代表表达水平无差异(图2-3).
10 μmol/L γ-氨基丁酸的对Huh-7细胞基因表达的影响: 基因芯片扫描过程中将上调信号定义为两种荧光叠加信号比值(Cy5/Cy3)大于2.0; 下调信号比值定义为0.5. 本研究共筛选出27条差异表达的基因, 其中11条基因表达下调, 16条基因表达上调(表1).
| Gene_ID | Cy5/Cy3 | DEFINITION |
| 55779 | 0.066 | 色氨酸-天冬氨酸重复序列52(WDR52) |
| 6656 | 0.284 | Y染色体上的性别决定区(SOX1) |
| 94241 | 0.286 | P53诱导核因子1(TP53INP1) |
| 3131 | 0.294 | 肝白血病因子(HLF) |
| 107 | 0.316 | 腺苷环化酶1(ADCY1) |
| 26266 | 0.327 | 溶质转运蛋白13A4(SLC13A4) |
| 10286 | 0.335 | 乳腺癌放大序列2(BCAS2) |
| 91 | 0.341 | 激活素受体1B(ACVR1B) |
| 6604 | 0.344 | SWI/SNF-基质相关, 肌动蛋白依赖染色质调节因子3(SMARCD3) |
| 11345 | 0.345 | GABA受体A相关样蛋白2(GABARAPL2) |
| 4179 | 0.385 | 补体调节蛋白(CD46) |
| 203228 | 3.008 | 9号染色体开放读码框72(C9orf72) |
| 3586 | 3.012 | 白介素-10(IL-10) |
| 7984 | 3.083 | Rho鸟苷酸交换因子5(ARHGEF5) |
| 9903 | 3.144 | Kelch样蛋白21(KLHL21) |
| 9204 | 3.171 | MYM锌指蛋白6(ZMYM6) |
| 65981 | 3.249 | 癸酸甘油酯21(CAPRIN2) |
| 166968 | 3.345 | 中胚叶诱导早期蛋白3(MIER3) |
| 728743 | 3.506 | 假想蛋白tcag7.1196 |
| 11315 | 3.51 | 帕金森病因子7(PARK7) |
| 9846 | 3.633 | GRB2相关结合蛋白2(GAB2) |
| 6423 | 3.938 | 分泌型卷曲相关蛋白(SFRP2) |
| 3035 | 4.137 | 组氨酰-tRNA合成酶(HARS) |
| 11273 | 4.485 | ataxin 2样蛋白(ATXN2L) |
| 83871 | 4.659 | RAS癌基因家族RAB34蛋白(RAB34) |
| 3913 | 4.838 | 层黏连蛋白B2(LAMB2) |
| 54662 | 5.22 | 甲状腺素结合凝固素C1D13(cc) |
GABA是一种重要的抑制性神经递质, 其受体广泛表达于神经系统外的组织. 其能够通过活化GABA门控氯离子通道使细胞外氯离子进入细胞内, 或通过G蛋白偶联的cAMP第二信使的作用, 使细胞膜超极化达到去兴奋状态, 产生抑制作用[2]. 本研究组以往研究发现GABA受体在人肝脏细胞中也有表达, 提示GABA对于肝脏的功能有重要的意义. 在本研究中发现在肝细胞中GABA信号传导通路确实存在, GABA本身也能影响通路中关键分子: 腺苷环化酶1、GABA受体A相关样蛋白2的表达[3-4].
以往研究显示GABA能使胆管细胞、胰腺细胞、鳞状上皮细胞产生类似的去极化作用, 并使细胞增殖、凋亡等活动抑制, 具有促进细胞分化的潜在作用[1]. 本研究GABA下调的基因中: SOX1是一种主要在外胚层干细胞表达的早期转录因子[5], 在神经系统的分化逐渐降低, 提示此种因子在肝脏细胞分化的过程中也有类似的现象[6]; TP53INP1是一种转录因子, 在P53介导的细胞凋亡过程中有重要的作用, 在细胞应激极化时表达上调[7]; 有研究报道SMARCD3参与P53凋亡信号的调节[8], 并调控肌细胞的成熟[9]; HLA基因编码的转录因子能抑制细胞凋亡, 并和一些白血病的发生相关[10]; ACVR1B是Activin的受体, Activin属于TGF-β超家族, 能调节多种细胞的分化与增殖[11]. GABA上调的基因中: ARHGEF5参与G蛋白信号传导, 对于细胞的分化成熟, 细胞骨架形成有重要意义[12]; GAB2参与多种生长因子的信号的传导, 参与细胞分化增殖的调节[13]; SFRP2存在于Wnt信号通路中, 能够增强细胞对凋亡的抵抗[14]; PARK7对氧化应激敏感, 在应激状态下能保护细胞免于死亡[15]; CAPRIN2能够使幼红细胞停止增殖, 并向成熟红细胞的方向分化[16]. 上述进一步证实肝细胞中肝细胞分化、增殖及死亡相关的基因大多能够受到GABA的影响.
我们还发现GABA能够调节多种肝细胞中表达的免疫分子, 而GABA对免疫功能的影响很少由学者报道. CD46是一种膜分子, 能够参与补体系统的调节, 能够辅助血浆因子-1对补体C3b和C4b的灭活, 从而避免细胞被补体损伤[17]; IL-10是主要由单核细胞和部分Treg细胞分泌的细胞因子, 能抑制Th1类细胞因子的表达, 抑制炎症反应, 抑制细胞免疫[18]. 在重症肝炎时血液和肝局部组织的GABA水平升高, 本研究发现GABA上调IL-10, 并下调CD46的表达, 提示我们这可能和重症肝炎时机体免疫紊乱有关.
肝炎过程中, 血清GABA水平升高, 肝再生活性下降, GABA受体拮抗剂促进肝再生, 提示GABA可能抑制肝再生. 本课题组发现在血管紧张素作用下肝星状细胞GABA受体表达下调, 提示GABA在肝脏的生理过程中发挥一定作用.
高润平, 教授, 吉林大学第一医院肝病科
本研究以GABA刺激肝细胞株, 来模拟肝炎过程中GABA升高的状态, 以基因芯片检测肝细胞基因表达谱的改变, 以此推断GABA对肝细胞的生理、病理作用.
研究GABA对肝细胞株基因表达谱的影响有助于初步了解GABA在肝脏中的生理意义, 并对研究GABA在肝脏疾病过程中的作用有一定的帮助.
1 γ-氨基丁酸(GABA): 是一种重要的抑制性神经递质, 通过活化门控氯离子通道使胞外氯离子进入胞内,使细胞膜超极化达到去兴奋状态, 产生抑制作用.
2 基因芯片: 在微小的基片表面集成大量的已知基因探针, 与互补的靶核苷酸序列杂交, 进行定性与定量分析, 能高通量的对基因表达进行分析.
本文设计合理, 实验方法新颖, 结果可靠, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Erlitzki R, Gong Y, Zhang M, Minuk G. Identification of gamma-aminobutyric acid receptor subunit types in human and rat liver. Am J Physiol Gastrointest Liver Physiol. 2000;279:G733-G739. [PubMed] |
| 2. | Galarreta M, Hestrin S. Electrical synapses between GABA-releasing interneurons. Nat Rev Neurosci. 2001;2:425-433. [PubMed] [DOI] |
| 3. | Yang ZF, Sun Y, Li CZ, Wang HW, Wang XJ, Zheng YQ, Liu K, Liu YM. Reduced sinoatrial cAMP content plays a role in postnatal heart rate slowing in the rabbit. Clin Exp Pharmacol Physiol. 2006;33:757-762. [PubMed] [DOI] |
| 4. | Sou YS, Tanida I, Komatsu M, Ueno T, Kominami E. Phosphatidylserine in addition to phosphatidylethanolamine is an in vitro target of the mammalian Atg8 modifiers, LC3, GABARAP, and GATE-16. J Biol Chem. 2006;281:3017-3024. [PubMed] [DOI] |
| 5. | Pevny LH, Sockanathan S, Placzek M, Lovell-Badge R. A role for SOX1 in neural determination. Development. 1998;125:1967-1978. [PubMed] |
| 6. | Yan Y, Yang D, Zarnowska ED, Du Z, Werbel B, Valliere C, Pearce RA, Thomson JA, Zhang SC. Directed differentiation of dopaminergic neuronal subtypes from human embryonic stem cells. Stem Cells. 2005;23:781-790. [PubMed] [DOI] |
| 7. | Tomasini R, Samir AA, Carrier A, Isnardon D, Cecchinelli B, Soddu S, Malissen B, Dagorn JC, Iovanna JL, Dusetti NJ. TP53INP1s and homeodomain-interacting protein kinase-2 (HIPK2) are partners in regulating p53 activity. J Biol Chem. 2003;278:37722-37729. [PubMed] [DOI] |
| 8. | Osada M, Park HL, Nagakawa Y, Yamashita K, Fomenkov A, Kim MS, Wu G, Nomoto S, Trink B, Sidransky D. Differential recognition of response elements determines target gene specificity for p53 and p63. Mol Cell Biol. 2005;25:6077-6089. [PubMed] [DOI] |
| 9. | Ochi H, Hans S, Westerfield M. Smarcd3 regulates the timing of zebrafish myogenesis onset. J Biol Chem. 2008;283:3529-3536. [PubMed] [DOI] |
| 10. | Inukai T, Inaba T, Dang J, Kuribara R, Ozawa K, Miyajima A, Wu W, Look AT, Arinobu Y, Iwasaki H. TEF, an antiapoptotic bZIP transcription factor related to the oncogenic E2A-HLF chimera, inhibits cell growth by down-regulating expression of the common beta chain of cytokine receptors. Blood. 2005;105:4437-4444. [PubMed] [DOI] |
| 11. | Ageta H, Murayama A, Migishima R, Kida S, Tsuchida K, Yokoyama M, Inokuchi K. Activin in the brain modulates anxiety-related behavior and adult neurogenesis. PLoS ONE. 2008;3:e1869. [PubMed] |
| 12. | Umetsu DT, Dekruyff RH. Regulation of tolerance in the respiratory tract: TIM-1, hygiene, and the environment. Ann N Y Acad Sci. 2004;1029:88-93. [PubMed] [DOI] |
| 13. | Bennett HL, Brummer T, Jeanes A, Yap AS, Daly RJ. Gab2 and Src co-operate in human mammary epithelial cells to promote growth factor independence and disruption of acinar morphogenesis. Oncogene. 2008;27:2693-2704. [PubMed] [DOI] |
| 14. | Lee JL, Lin CT, Chueh LL, Chang CJ. Autocrine/paracrine secreted Frizzled-related protein 2 induces cellular resistance to apoptosis: a possible mechanism of mammary tumorigenesis. J Biol Chem. 2004;279:14602-14609. [PubMed] [DOI] |
| 15. | Yanagisawa D, Kitamura Y, Inden M, Takata K, Taniguchi T, Morikawa S, Morita M, Inubushi T, Tooyama I, Taira T. DJ-1 protects against neurodegeneration caused by focal cerebral ischemia and reperfusion in rats. J Cereb Blood Flow Metab. 2008;28:563-578. [PubMed] [DOI] |
| 16. | Aerbajinai W, Lee YT, Wojda U, Barr VA, Miller JL. Cloning and characterization of a gene expressed during terminal differentiation that encodes a novel inhibitor of growth. J Biol Chem. 2004;279:1916-1921. [PubMed] [DOI] |
| 17. | Xu D, Huang SJ, Wang JQ, Wu CK. Protective effect of membrane cofactor protein against complement-dependent injury. Acta Pharmacol Sin. 2005;26:987-991. [PubMed] [DOI] |