修回日期: 2008-08-22
接受日期: 2008-08-26
在线出版日期: 2008-09-28
目的: 探讨蛙皮素对内毒素致肠黏膜损伤的影响.
方法: 大鼠96只随机分成3组: A生理盐水组(ip生理盐水1 mL/kg), B内毒素组(ip LPS 5 mg/kg), C蛙皮素组(实验前1 wk每天sc蛙皮素10 μg/kg, 每天3次, 至第7天ip LPS 5 mg/kg). 在注射LPS 2, 6, 24 h后, 各组处死大鼠8只, 留取肠组织. 光镜下观察肠组织病理形态学改变, 生化法检测肠组织匀浆丙二醛(MDA)和谷胱苷肽过氧化物酶(GSH-PX)的含量, 采腹腔静脉血, 双抗夹心法(ELISA)检测血清IL-6和IL-10.
结果: 肉眼和光镜可见C组肠黏膜损伤较B组明显减轻. C组MDA含量在2、6、24 h时间点均较B组降低(3.4092±0.7765 vs 8.4359±0.5589; 4.6588±0.3311 vs 10.9375±1.00094; 4.6324±0.2278 vs 10.5074±1.0142, 均P<0.01), 但仍较A组高; C组GSH-PX活力单位较B组显著升高(2 h: 1231.83±74.68 vs 766.67±57.94; 6 h: 2113.34±81.42 vs 749.09±56.72; 24 h: 1950.48±72.74 vs 785.62±62.43, 均P<0.01); C组IL-6水平于2、6 h较B组降低(2 h: 553.70±23.03 vs 652.81±27.09; 6 h: 494.52±40.68 vs 606.68±43.60; 24 h: 571.56±52.54 vs 602.73±25.19, 均P<0.01), 但仍高于A组; C组IL-10水平于各时间点均较B组升高(2 h: 601.58±30.65 vs 478.76±23.49; 6 h: 653.77±35.75 vs 469.35±11.27; 24 h: 714.04±29.55 vs 635.17±29.15, P<0.01).
结论: 蛙皮素具有抗氧化损伤及抗炎症反应的作用.
引文著录: 龚俊, 朱尤庆. 蛙皮素对内毒素致肠黏膜损伤的保护作用. 世界华人消化杂志 2008; 16(27): 3050-3054
Revised: August 22, 2008
Accepted: August 26, 2008
Published online: September 28, 2008
AIM: To investigate the protective effects of bombesin on endotoxin-induced intestinal injury in SD rats.
METHODS: A total of 96 SD rats were divided randomly into 3 groups. Group A was served as control group and administrated normal saline (1 mL/kg). Group B was the model group and treated with LPS (intraperitoneally, 5 mg/kg). Rats in Group C were firstly treated with bombesin (subcutaneously, 10 μg/kg, three times a day) for 7 d, and then injected with LPS intraperitoneally. Following LPS administration, intestinal tissues were collected at 2, 6, 24 h separately for Malondialdehyde (MDA) and GSH-PX study, and blood samples were collected for IL-6 and IL-10 study.
RESULTS: According to the macroscopic and microscopic findings, group C showed significantly lower damage and inflammation compared with group B. At 2, 6, 24 h, the intestinal MDA levels were significantly lower in group C than in group B (3.4092 ± 0.7765 vs 8.4359 ± 0.5589; 4.6588 ± 0.3311 vs 10.9375 ± 1.00094; 4.6324 ± 0.2278 vs 10.5074 ± 1.0142, all P < 0.01), but still higher than that in group A. The intestinal GSH-PX levels were significantly higher in group C than in group B (2 h: 1231.83 ± 74.68 vs 766.67±57.94; 6 h: 2113.34 ± 81.42 vs 749.09 ± 56.72; 24 h: 1950.48 ± 72.74 vs 785.62 ± 62.43, all P < 0.01). At 2, 24 h, the IL-6 levels were lower in group C than in group B (2 h: 553.70 ± 23.03 vs 652.81 ± 27.09; 6 h: 494.52 ± 40.68 vs 606.68 ± 43.60; 24 h: 571.56 ± 52.54 vs 602.73 ± 25.19, all P < 0.01), but still higher than in group A. At every time, the IL-10 levels were higher in group C than in group B (2 h: 601.58 ± 30.65, vs 478.76 ± 23.49; 6 h: 653.77 ± 35.75 vs 469.35 ± 11.27; 24 h: 714.04 ± 29.55 vs 635.17 ± 29.15, all P < 0.01).
CONCLUSION: Bombesin has the function of anti-oxidation and anti-inflammation by increasing the levels of GSH-PX and IL-10 and decreasing the levels of MDA and IL-6.
- Citation: Gong J, Zhu YQ. Protective effects of bombesin on endotoxin-induced intestinal injury in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3050-3054
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3050.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3050
正常情况下, 肠道里各种菌群保持平衡状态. 但是当机体处于应激和危重疾病状态下时, 肠黏膜缺血缺氧损伤, 导致肠道细菌移位, 发生全身炎症性反应综合征(SIRS), 进而可能发生多器官功能衰竭综合征(MODS). 这往往是许多重症患者死亡的重要原因之一. 而阻断这一进程对于降低死亡率是有重要意义的. 而蛙皮素做为一种脑肠肽, 发挥着广泛的生理功能, 之前的研究已经证实其对肠黏膜损伤的修复及免疫修复作用, 而本文从抗炎症反应和抗氧化损伤方面探讨蛙皮素对肠黏膜的保护作用.
♂SD大鼠72只, 清洁级, 体质量180-210 g, 由武汉大学动物实验中心提供. 蛙皮素([Lys3]-Bombesin, 型号B1647)及牛血清白蛋白均购自美国Sigma公司. 大肠杆菌内毒素(E.coli055: B5)购自美国Sigma公司. 考马斯亮兰总蛋白测试盒, 丙二醛(MDA)试剂盒及谷胱苷肽过氧化物酶(GSH-PX)试剂盒均购自南京建成生物有限公司. IL-6 ELISA试剂盒及IL-10 ELISA试剂盒购自武汉众一生物技术有限公司(DU530紫外-可见分光光度计, 酶标仪, MR23i高速多功能冷冻离心机, HH-60三用数显恒温循环水浴箱, MD-9405B型水平摇床(沃德生物医学仪器公司), 显微镜). 蛙皮素(BBS): 先用1 g/L牛血清白蛋白1 mL溶解1 mg BBS, 然后用含2.5 g/L牛血清白蛋白的生理盐水稀释成200 mL, 最终为0.5 mL液体中包含10 μg BBS. 为避免反复冻融, EP管分装后于-20 ℃冰箱中保存. 大肠杆菌内毒素(LPS): 用2 mL生理盐水溶解10 mg LPS, 使其终浓度为5 g/L.
1.2.1 分组: 分别于ip LPS或生理盐水后2、6、24 h三个时间点处死大鼠并留取标本, 各时间点各组分别处死8只. 对照组(NS组): ip生理盐水1 mL/kg; 模型组(LPS组): ip LPS 5 mg/kg, 配比浓度5 g/L, 用生理盐水溶解; 蛙皮素组(BBS组): 实验前1 wk每天sc BBS 10 μg/kg, 3 次/d, 至第7天ip LPS 5 mg/kg.
1.2.2 动物标本的存取: ip 10 mL/L水合氯醛400 mg/kg麻醉, 逐层解剖打开腹腔, 取腹腔静脉血2 mL于EP管中, 3500 r/min离心10 min收集血清于-20 ℃冰箱中保存待检测血清中IL-6和IL-10的含量. 取回肠末端肠组织1 cm于100 g/L甲醛中固定, 梯度酒精脱水, 浸蜡, 石蜡包埋, 切片, 苏木素-伊红染色, 光镜下观察组织学改变. 取远段回肠组织5 cm, 用冰盐水灌洗干净后, 置于冻存管中-70 ℃冰箱内保存待测.
1.2.3 肠组织匀浆MDA及GSH-PX含量的检测: 取出肠组织块, 吸水纸吸干, 每小组8例, 每个样本准确称质量0.1-0.3 g, 按质量体积比1:9加入生理盐水在冰浴中用匀浆器制成100 g/L肠组织匀浆, 3500-4000 r/min离心10 min, 弃下面沉淀留上清, 再按重量体积比1:9加入生理盐水制成10 g/L的组织匀浆液. MDA及GSH-PX的检测严格按照试剂盒操作说明书进行.
1.2.4 血清IL-6和IL-10的检测: 按ELISA试剂盒进行操作.
统计学处理 实验数据以mean±SD表示, 差异比较用SPSS14.0统计软件进行单因素方差分析(ANOVA), 组间比较采用LSD法检验, P<0.05为差异有统计学意义.
LPS组大鼠于腹腔注射LPS后1.5-2 h渐出现活动减少, 迟钝, 进食饮水减少, 开始腹泻, 至6 h上述症状明显, 24 h成活鼠上述症状减轻. BBS组上述症状出现较晚, 且症状均较LPS组轻. NS组大鼠无异常表现.
2.2.1 肉眼形态学改变: 各时间点处死实验动物, 打开腹腔观察: LPS组动物在ip LPS后2 h 可见部分肠管扩张, 轻度胃潴留, 肠系膜血管网清晰. 6 h胃潴留明显, 肠壁充血肿胀明显, 肠系膜血管网充血明显, 肠腔内可见黏液样黄色稀便. 24 h仍有胃潴留, 充血肿胀. BBS组上述症状均较LPS组轻微, NS组无明显改变.
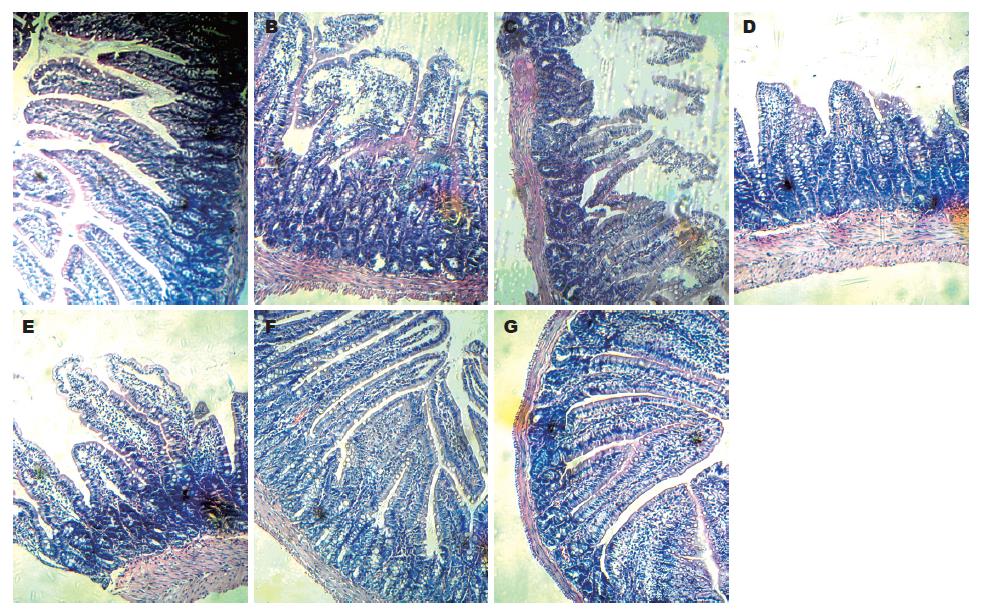
2.2.2 光镜下观察肠组织病理学改变: LPS组: 2 h即可见肠绒毛间质水肿明显, 肠绒毛顶端上皮下可见囊状间隙; 6 h可见炎性细胞浸润, 坏死, 黏膜厚度及绒毛高度降低, 绒毛间质充血水肿; 24 h绒毛间质充血肿胀明显改善. BBS组: 于2 h和6 h有轻度充血肿胀, 肠绒毛顶端上皮下可见囊状间隙, 黏膜厚度及绒毛高度较NS组降低, 但较LPS组明显增高, 炎性细胞减少, 至24 h明显改善. NS组无明显改变(图1).
各对应时间点LPS组MDA含量均较NS组明显增高, 差异有显著统计学意义(P<0.01), LPS组MDA含量于2 h增高, 6 h达高峰, 24 h维持高值. BBS组各对应时间点MDA含量均较LPS组降低, 差异有显著统计学意义(P<0.01). BBS组与NS组比较, 2 h和24 h差异无统计学意义(P>0.05), 6 h差异有统计学意义(P<0.05, 表1).
LPS组各时间点GSH-PX活力单位较NS组下降, 差异有显著统计学意义(P<0.01). BBS组各时间点GSH-PX活力单位较LPS组显著升高, 差异有显著统计学意义(P<0.01, 表1).
各对应时间点内, LPS组IL-6的含量均较NS组增高, 差异有显著统计学意义(P<0.01); BBS组IL-6的含量分别于2 h, 6 h较LPS组有所下降(P<0.01), 但仍高于NS组(P<0.01), 24 h差异无统计学意义(P>0.05, 表2).
LPS组IL-10的含量于2 h, 6 h较NS组显著下降(P<0.01), 至24 h明显升高, 与NS组比较差异无统计学意义(P>0.05); BBS组IL-10的含量于各对应时间点均较LPS组升高, 且较NS组亦增高, 差异有显著统计学意义(P<0.01, 表2).
消化道是各种有害因素(细菌及其产物, 病毒等)入侵机体的"窗口", 又是危重疾病应激状态下受损的靶器官和MODS发生的始动器[1]. 当机体处于严重创伤, 烧伤, 休克, 急性胰腺炎, 肝硬化等状态下时, 会出现复杂的神经-内分泌系统介导的适应性变化, 结果出现选择性内脏血管痉挛以保证心脑肾等重要脏器的血液供应, 从而导致肠黏膜缺血、缺氧, 通透性增加, 细菌移位, 发生全身炎症性反应综合征(SIRS), 进而可能发生多器官功能衰竭综合征(MODS)[2-3]. 在这一发展过程中, LPS与肠黏膜损害、细菌移位关系复杂. LPS是革兰氏阴性(G-)菌细胞壁的脂多糖(LPS)成分, 类脂A是LPS的"毒力中心", 属外源性介质. LPS对肠黏膜的作用包括: (1)激活膜上腺昔酸环化酶, 损伤溶酶体膜和线粒体膜, 加重黏膜上皮细胞损害; (2)激活血管活性物质, 影响血管舒缩功能, 引起肠道血液灌流不足, 加重肠黏膜屏障功能损害和氧化损伤. (3)诱生TNF引起肠黏膜细胞损害: TNF通过促进ICAM-1、LEA-3表达并与肠黏膜细胞特异性受体结合, 通过中性粒细胞或者巨噬细胞损伤肠黏膜; 还可影响肠细胞产生细胞因子如肿瘤坏死因子(TNF-a), IL-1、6、8, 血小板活化因子(PAF)等和增殖. 最终导致肠黏膜屏障损伤, 通透性增加, 而引起肠道细菌移位和LPS血症[4].
BBS是一种从欧洲羚蟾皮肤提出的14肽, 与人体内的胃泌素释放肽(gasrtnieer leasnigp petide, GRP)结构和功能都十分相似, 分子质量为1619 Da. 他是由Anastasi et al于1971年首先从两种欧洲蛙的皮肤提取物中提取的, 此后发现在其他哺乳类和非哺乳类动物的神经系统、内脏系统(如消化系统呼吸系统)中也含有大量的BBS样物质[5]. BBS的生理作用广泛, 包括中枢神经系统作用、体温调节、摄食行为调节、循环系统调节、胃肠道的作用. 特别是胃肠道的生理作用引起全球学者的注意, 也是研究的热点之一. BBS的胃肠道作用主要包括促进胃肠激素的分泌、促进黏膜的生长与修复, 促进胃肠道损伤后的免疫修复、促进胃肠道平滑肌的蠕动等功能[6]. 以往的实验已经证明BBS能促进肠外营养, 小肠移植手术, 免疫抑制剂, 严重烧伤, 缺血再灌注损伤, 胆道梗阻大鼠模型等动物模型中肠黏膜损伤的修复及肠免疫功能损伤的修复[7-12], 最近国内陆培华 et al发现BBS对梗阻性黄疸大鼠的肝脏有保护作用, 有减轻肝脏的氧化应激损伤作用[13].
国外Akcan et al通过构建溃疡性结肠炎的动物模型发现BBS可以降低血中促炎因子IL-6和TNF-α的水平, 并可降低结肠组织中髓过氧化物酶(MPO)及MDA的水平[14]. MDA是过氧化脂质降解的主要终产物, 可间接反映组织氧自由基损害的程度. GSH-PX是机体内广泛存在的一种重要的抗氧化酶, 他特异地催化还原型谷胱苷肽对过氧化氢的还原反应, 可以起到保护细胞膜结构和功能的作用[15]. 本实验中, BBS干预可显著降低MDA含量同时增加GSH-PX的活力, 从而发挥抗肠组织氧化损伤的作用. 这对维持肠黏膜细胞结构完整起着重要的作用. BBS发挥抗氧化效应机制可能与直接的受体作用有关, 有研究报道BBS可通过蛋白激酶C信号通路, 促使线粒体异位和抗氧化酶系统的形成而发挥抗组织氧化作用[16].
机体在LPS作用下释放大量的促炎介质(IL-1, IL-8, IL-6, TNF-α)引起发热, 白细胞变化等表现; 同时, 机体为了抵抗外来的入侵者而释放大量的内源性抗炎介质(IL-4, IL-10, IL-11)等[4]. 本实验中, LPS组IL-6水平在2 h升高最明显, IL-10水平在2 h和6 h下降明显, 而24 h NS组无明显差异. 这可能与LPS作用下机体在早期以炎症反应为主, 而在后期以抗炎反应为主有关[4]. BBS组在早期可明显降低血清IL-6水平. BBS通过降低促炎介质增加抗炎介质从而发挥抗炎反应的作用. BBS在人和动物体内广泛分布, 生理作用广泛, 尤其是其对肠黏膜的保护性作用为临床应用提供了一定的实验依据, 但真正用于临床还需进一步更确切的研究.
近年来, 对蛙皮素的作用进行了大量的实验研究, 主要是关于其与肿瘤发生发展的关系. 但是蛙皮素作为一种脑肠肽, 具有广泛的生理功能, 尤其是其对胃肠道的调节作用不容忽视.
高泽立, 副教授, 上海交通大学医学院附属第三人民医院感染科; 王炳元, 教授, 中国医科大学附属第一医院消化内科
目前关于蛙皮素与肿瘤的关系研究的较多, 但是其对于胃肠道的保护作用也是近年的研究热点.
2008年国外Akcan et al通过构建溃疡性结肠炎的动物模型发现BBS可以降低血中促炎因子IL-6和TNF-α的水平, 并可降低结肠组织中髓过氧化物酶(MPO)及丙二醛(MDA)的水平.
既往的实验已经证实蛙皮素具有促进胃肠黏膜损伤的修复及免疫修复, 促进胃肠激素的释放等方面的作用, 而本文从炎症反应和氧化损伤方面探讨其保护作用, 这在前人研究基础上更进一步.
研究蛙皮素对肠黏膜的保护作用, 对于危重疾病状态下肠黏膜损伤的临床用药, 以预防全身炎症反应和多器官功能衰竭的发生, 提供了一定的实验依据.
本文立题新颖, 紧密结合临床, 对肠黏膜损伤的保护治疗有一定的指导意义.
编辑: 李军亮 电编: 何基才
| 1. | Gennari R, Alexander JW. Effects of hyperoxia on bacterial translocation and mortality during gut-derived sepsis. Arch Surg. 1996;131:57-62. [PubMed] |
| 2. | Ueno C, Fukatsu K, Maeshima Y, Moriya T, Shinto E, Hara E, Nagayoshi H, Hiraide H, Mochizuki H. Dietary restriction compromises resistance to gut ischemia-reperfusion, despite reduction in circulating leukocyte activation. JPEN J Parenter Enteral Nutr. 2005;29:345-351; discussion 351-352. [PubMed] [DOI] |
| 3. | Kong SE, Hall JC, Cooper D, McCauley RD. Starvation alters the activity and mRNA level of glutaminase and glutamine synthetase in the rat intestine. J Nutr Biochem. 2000;11:393-400. [PubMed] [DOI] |
| 4. | 蒋 建新. 细菌内毒素基础与临床. 第1版. 北京: 人民军医出版社 2004; 168-174. |
| 7. | Alican I, Unlüer EE, Yeğen C, Yeğen BC. Bombesin improves burn-induced intestinal injury in the rat. Peptides. 2000;21:1265-1269. [PubMed] [DOI] |
| 8. | Zarzaur BL, Wu Y, Fukatsu K, Johnson CD, Kudsk KA. The neuropeptide bombesin improves IgA-mediated mucosal immunity with preservation of gut interleukin-4 in total parenteral nutrition-fed mice. Surgery. 2002;131:59-65. [PubMed] [DOI] |
| 9. | Furukawa T, Kimura O, Go S, Iwai N. Small bowel allografts maintained by administration of bombesin while under immunosuppression. J Pediatr Surg. 2003;38:83-87; discussion 83-87. [PubMed] [DOI] |
| 11. | DeWitt RC, Wu Y, Renegar KB, King BK, Li J, Kudsk KA. Bombesin recovers gut-associated lymphoid tissue and preserves immunity to bacterial pneumonia in mice receiving total parenteral nutrition. Ann Surg. 2000;231:1-8. [PubMed] [DOI] |
| 12. | Assimakopoulos SF, Vagianos CE, Charonis AS, Alexandris IH, Spiliopoulou I, Thomopoulos KC, Nikolopoulou VN, Scopa CD. Experimental obstructive jaundice alters claudin-4 expression in intestinal mucosa: effect of bombesin and neurotensin. World J Gastroenterol. 2006;12:3410-3415. [PubMed] |
| 14. | Akcan A, Muhtaroglu S, Akgun H, Akyildiz H, Kucuk C, Sozuer E, Yurci A, Yilmaz N. Ameliorative effects of bombesin and neurotensin on trinitrobenzene sulphonic acid-induced colitis, oxidative damage and apoptosis in rats. World J Gastroenterol. 2008;14:1222-1230. [PubMed] [DOI] |
| 16. | Dal-Pizzol F, Di Leone LP, Ritter C, Martins MR, Reinke A, Pens Gelain D, Zanotto-Filho A, de Souza LF, Andrades M, Barbeiro DF. Gastrin-releasing peptide receptor antagonist effects on an animal model of sepsis. Am J Respir Crit Care Med. 2006;173:84-90. [PubMed] [DOI] |