修回日期: 2008-08-22
接受日期: 2008-09-01
在线出版日期: 2008-09-28
目的: 探讨尿激酶型纤溶酶原激活物(uPA)基因修饰骨髓源性肝干细胞(BDLSC)移植对CCl4诱导的大鼠肝星状细胞(HSC)激活的影响.
方法: 大鼠sc 400 mL/L CCl4造模. 36只大鼠随机分为4组: (1)正常组: sc等量橄榄油; (2)模型组; (3)BDLSC组; (4)BDLSC-uPA组, 每组9只. 各组大鼠于第8周处死, 留取血清及肝组织. 观察大鼠肝功能的变化; 采用免疫组织化学法和Western blot法检测大鼠肝组织α-平滑肌肌动蛋白(α-SMA)蛋白表达变化.
结果: 与模型组和BDLSC组相比, BDLSC-uPA组大鼠血清丙氨酸转氨酶(ALT)和总胆红素(TBIL)水平均有不同程度的降低(86.5±9.7 vs 187.1±14.8, 113.5±15.7; 11.5±2.1 vs 26.3±3.7, 17.9±2.8, 均P<0.01), 血清透明质酸(HA)和Ⅲ型前胶原(PCⅢ)水平明显降低(47.4±10.1 vs 148.5±22.4, 97.6±14.4; 18.9±4.4 vs 39.0±6.1, 28.2±4.1, 均P<0.01); 肝组织α-SMA表达显著下调(0.0174±0.0048 vs 0.3404±0.0662, 0.1080±0.0408, 均P<0.01).
结论: uPA基因修饰BDLSC移植能有效抑制CCl4诱导的大鼠肝纤维化, 改善纤维化大鼠的肝功能, 且抑制HSC的活化可能是其抑制肝纤维化的主要机制之一.
引文著录: 孙超, 汪保灿, 陈源文, 陈颖伟, 李定国. uPA基因转染骨髓源性肝干细胞移植对肝纤维化大鼠HSC活化的影响. 世界华人消化杂志 2008; 16(27): 3031-3035
Revised: August 22, 2008
Accepted: September 1, 2008
Published online: September 28, 2008
AIM: To investigate the effects of urokinase type plasminogen activator (uPA) gene-modified bone marrow-derived stem cell (BDLSC) transplantation on activation of hepatic stellate cells (HSCs) in rats with CCl4-induced liver fibrosis.
METHODS: Rat liver fibrosis model was induced by subcutaneous injection of 400 mL/L CCl4. Thirty-six rats were randomly divided into four groups of 9 rats, including control group which was injected subcutaneously with the same dose of olive oil, model group, BDLSC group and BDLSC-uPA group. All rats were sacrificed to harvest serum and liver tissues at the end of the eighth week. Liver function changes were observed; the expression changes of α-smooth muscle actin (α-SMA) proteins were determined using immunohistochemistry and Western blotting.
RESULTS: In the BDLSC-uPA group, the serum levels of alanine aminotransferase (ALT) and total bilirubin (TBIL) in varying degrees decreased (86.5 ± 9.7 vs 187.1 ± 14.8, 113.5 ± 15.7; 11.5 ± 2.1 vs 26.3 ± 3.7, 17.9 ± 2.8, all P < 0.01), serum levels of hyaluronic acid (HA) and procollagen Ⅲ (PCⅢ) were much lower (47.4 ± 10.1 vs 148.5 ± 22.4, 97.6 ± 14.4; 18.9 ± 4.4 vs 39.0 ± 6.1, 28.2 ± 4.1, all P < 0.01). The expression of α-SMA protein in liver was down-regulated, compared with those in the model group and BDLSC group (0.0174 ± 0.0048 vs 0.3404 ± 0.0662, 0.1080 ± 0.0408, all P < 0.01).
CONCLUSION: uPA gene-modified BDLSC transplantation suppresses CCl4-induced hepatic fibrosis and ameliorates liver functions in rats effectively. Inhibiting the activation of HSC may be one of the main mechanisms for inhabitation of rat liver fibrosis.
- Citation: Sun C, Wang BC, Chen YW, Chen YW, Li DG. Effect of uPA gene-transfected bone marrow-derived liver stem cell transplantation on activation of hepatic stellate cells in rat liver fibrosis. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3031-3035
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3031.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3031
肝纤维化是肝脏对慢性损伤的一种修复反应, 以细胞外基质(extracellular matrix, ECM)在肝内过多沉积为主要特征. 尿激酶型纤溶酶原激活物(urokinase type plasminogen activator, uPA)在降解纤维、逆转肝纤维化中具有重要作用[1-2]. 骨髓源性肝干细胞(bone marrow-derived liver stem cell, BDLSC)来源充足, 增殖能力强, 具有很强的向肝系细胞分化的能力, 成为基因治疗肝脏疾病理想的靶细胞[3-4]. 我们设想肝干细胞与uPA基因治疗联合应用时, uPA参与清除坏死组织及降解纤维间隔, 促进BDLSC种植、增殖和分化、重建正常的肝组织结构, 将有利于肝组织形态和功能恢复.
肝星状细胞(hepatic stellate cell, HSC)的激活和增殖是肝纤维化的关键环节. α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达是HSC激活的标志. 本研究将携带人uPA基因的腺病毒(AduPA)体外转染BDLSC, 移植入肝纤维化大鼠体内, 评价转基因BDLSC对HSC活化和肝纤维化大鼠疗效的影响, 从而为其临床应用奠定实验基础.
纯系Fisher 344♂大鼠10只, ♀大鼠36只, 体质量150-180 g, 购自中科院上海斯莱克实验动物有限责任公司. TRIzol购自美国Invitrogen公司, M-MLV逆转录酶购自Promega公司. Taq DNA聚合酶购自TaKaRa公司. α-SMA小鼠mAb购自Dako公司.
1.2.1 重组复制缺陷型腺病毒AduPA的包装及扩增: 人pAduPA重组腺病毒质粒由中国人民解放军第二军医大学附属长征医院林勇博士惠赠. 利用脂质体转染法在293细胞中包装和扩增, 用氯化铯梯度离心纯化, AduPA最终病毒滴度可达3×1015 PFU/L. 采用密度梯度离心法分离胆总管结扎后10 d大鼠骨髓单个核细胞, 使用含5%的大鼠淤胆血清的病理条件培养液筛选培养BDLSC. 应用RT-PCR方法检测肝干细胞标志表达[5].
1.2.2 分组: 将♀大鼠随机分为4组, 每组9只. (1)正常组: sc等量橄榄油. (2)模型组: 予400 mL/L CCl4(CCl4:橄榄油 = 2:3, 3 mL/kg)sc, 3 d注射1次, 首剂加倍, 共注射18次, 并经尾iv等量生理盐水. (3)BDLSC组: 造模方法与模型组相同, 于实验第4周末经尾静脉输入2×106 BDLSC; (4)BDLSC-uPA组: 造模方法与模型组相同. AduPA以感染复数(multiplicity of infection, MOI)500转染BDLSC, 72 h后收集BDLSC溶于生理盐水, 于实验第4周末经尾静脉导入2×106转基因BDLSC. 细胞移植后应用免疫抑制剂他克莫司ig, 0.1 mg/(kg·d). 各组大鼠于第8周末处死, 留取血清及肝组织.
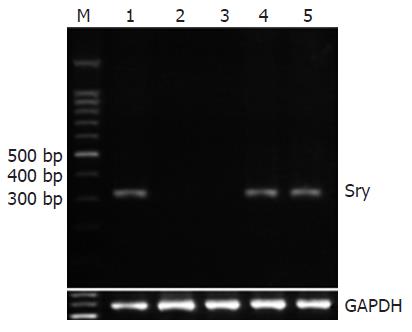
1.2.3 PCR法检测♂大鼠BDLSC的导入: 按Qiagene试剂盒说明书提取各组大鼠肝组织DNA, 以7 g/L琼脂糖凝胶电泳及紫外分光光度仪检测所提取的DNA纯度和浓度. 取2 μL所提取的DNA为模板进行Sry PCR扩增, 扩增片段长度为329 bp, 5'-GCTGATATCACTGGTGACCGA-3', 5'-AATGCCATAAGAATGCGAGTAG-3'. PCR反应条件: 94 ℃ 5 min; 94 ℃ 30 s; 50 ℃ 30 s; 72 ℃ 1 min; 32个循环, 最后72 ℃中延伸7 min. 同时以GAPDH作为内参照. 各组PCR产物于15 g/L琼脂糖凝胶电泳鉴定.
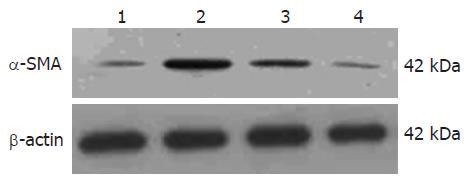
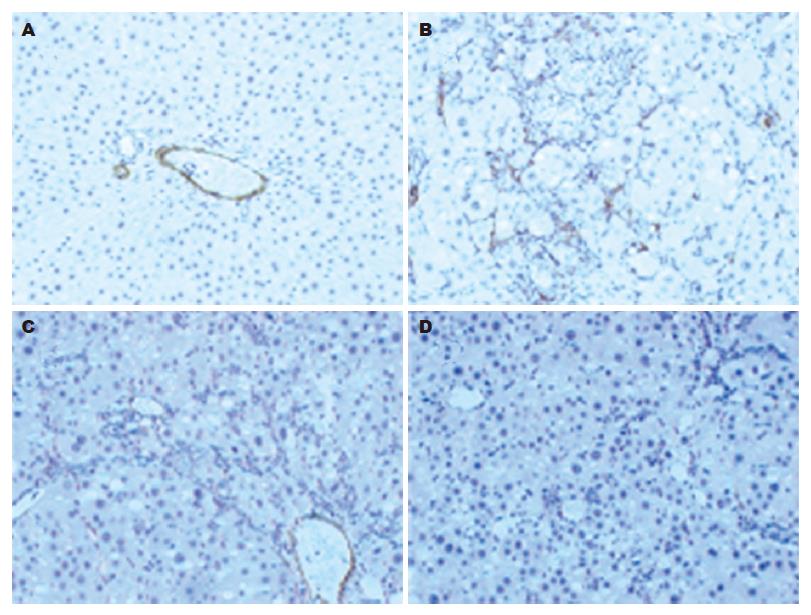
1.2.4 检测: 取各组大鼠血清1.5 mL, 使用自动生化分析仪检测肝功能指标丙氨酸转氨酶(alanine aminotransferase, ALT)和总胆红素(total bilirubin, TBIL). 采用放射免疫法检测透明质酸(hyaluronic acid, HA)和Ⅲ型前胶原(procollagen Ⅲ, PCⅢ)水平. 采用Western blot法检测α-SMA蛋白的表达. 提取各组肝组织总蛋白标准定量后, 取20 μg于100 g/L SDS-PAGE电泳分离蛋白, 转蛋白至PVDF膜; 封闭后加入一抗(α-SMA: 1:200, b-actin: 1:1000)于4 ℃中过夜. 次日加辣根过氧化物酶标记的二抗(1:5000)室温下孵育2 h. 用SuperSignal® west Pic化学发光试剂检测, 胶片曝光, 显影定影后结果扫描入计算机. 采用免疫组织化学分析肝组织α-SMA蛋白的表达. 将石蜡切片脱蜡至水,微波抗原修复10 min, 加30 mL/L H2O2室温下孵育20 min; 加正常封闭羊血清, 室温下孵育20 min; 弃去羊血清, 加一抗(α-SMA: 1:100), 于4 ℃中过夜; 次日加对应二抗, 37 ℃中孵育45 min; DAB显色, 显微镜下观察适时终止反应, 苏木素复染, 脱水封片. 每个动物随机选取3张石蜡切片重复实验, 每张切片随机选取10个视野, 应用Image-Pro plus 5.1图像分析软件计算每个视野的阳性染色百分比.
统计学处理 计量资料以mean±SD表示, 采用SPSS12.0统计软件包进行单因素ANOVA或Kruskal-Wallis检验分析; P<0.05为差异具有统计学意义.
以正常♂大鼠作为阳性对照, BDLSC组和BDLSC-uPA组肝组织性别决定基因Sry基因均呈阳性表达, 而正常组和模型组则未见其阳性表达无(图1).
与正常组相比, 肝纤维化模型组血清ALT和TBIL水平均显著升高, 血清ECM主要成分HA和PCⅢ水平呈相似改变(P<0.01); 与模型组相比, BDLSC-uPA组大鼠血清ALT和TBIL水平均有不同程度的降低, 血清HA和PCⅢ水平同样呈显著下降(P<0.01, 表1).
α-SMA表达增强是HSC活化的重要标志. Western blot结果经计算机灰度扫描并与内参照(b-actin)比较分析显示(图2): BDLSC-uPA组的α-SMA蛋白表达量(0.0174±0.0048)较模型组(0.3404±0.0662)和BDLSC组(0.1080±0.0408)明显减低(P<0.01), 正常组为0.0107±0.0016. 免疫组织化学染色显示: BDLSC-uPA组的α-SMA染色阳性细胞数量(10%±3%)较模型组(48%±11%)和BDLSC组(23%±4%)明显减少(P<0.01), 正常组为5%±2%(图3). 结果表明转染uPA基因的BDLSC可显著抑制CCl4诱导的大鼠HSC激活及向肌成纤维细胞转化, 明显减少大鼠肝组织活化HSC数量.
本研究中, 我们选用经尾iv转基因BDLSC. 一方面, 尾iv是常用的细胞导入肝脏的有效方法, 基本上不影响其他脏器的功能[6-7]; 另一方面, 这种注射方法操作简便, 更接近于临床应用. 我们采用CCl4建立大鼠肝纤维化模型, 一方面由于CCl4诱导的肝纤维化在病理上与人相似[8]; 另一方面, CCl4造成一定程度的肝损伤, 有利于BDLSC在肝脏的种植. Terai et al[7]将绿色荧光蛋白(green fluorescent protein, GFP)转基因小鼠的骨髓细胞经尾静脉导入CCl4肝纤维化小鼠模型中, 4 wk后发现受体肝脏中有26%供体来源细胞, 种植率远高于其他肝损伤动物模型. 我们采用国内外常用的交叉性别移植验证供体细胞的导入, 研究发现BDLSC组和BDLSC-uPA组肝组织均呈Sry基因阳性, 提示转基因BDLSC能在CCl4诱导的纤维化肝脏中有效种植.
肝功能检测能有效反映肝纤维化的程度. 血清ECM水平对肝纤维化的诊断和判定疗效具有重要价值, HA是ECM中蛋白多糖的主要成份, 是评估肝纤维化发展趋势的较灵敏指标之一[9]. PCⅢ是Ⅲ型前胶原分泌到细胞外后被蛋白酶切下的N端肽, 反映肝纤维化发生发展的动态过程[9]. 我们研究发现, 与模型组相比, BDLSC-uPA组大鼠的血清ALT和TBIL水平均有不同程度的降低, 血清ECM水平也显著下降, 提示转基因BDLSC移植可在一定程度上改善纤维化大鼠肝功能, 明显减轻大鼠肝纤维化的程度.
HSC位于肝窦周Disse腔内, 是一种具有多潜能的幼稚间质细胞. 正常情况下, HSC呈静止状态, 不表达α-SMA. 肝脏损伤时, HSC脂滴消失, 增殖活跃, 胞质内α-SMA产生增多, 表型转换为肌成纤维样母细胞, 合成分泌大量转化生长因子-b1(transforming growth factor-b1, TGF-b1), 维持HSC在活化状态, 分泌大量ECM, 并引起基质金属蛋白酶/金属蛋白酶组织抑制物(matrix metalloproteinases/tissue inhibitor of metalloproteinase, MMP/TIMP)平衡失调, HSC凋亡受抑. 因此, HSC的激活、增殖是肝纤维化的关键环节[10]. α-SMA的表达是HSC激活的标志. 正常肝组织中只有血管和胆管平滑肌细胞表达α-SMA. 慢性肝病时HSC活化、增殖并转化为表达α-SMA的肌成纤维样母细胞, 且主要分布在纤维化发生的部位[11]. 我们采用免疫组织化学染色和Western blot法检测各组大鼠肝组织α-SMA表达发现, 模型对照组的大鼠肝组织α-SMA表达显著上调, 与文献[12]报道一致. BDLSC-uPA组的α-SMA蛋白表达显著下降, 提示转基因BDLSC可在整体水平抑制HSC的激活和转化, 这可能是其发挥抗肝纤维化效应的一个重要机制.
总之, 我们的研究证实uPA基因修饰BDLSC移植能有效抑制CCl4诱导的大鼠肝纤维化, 改善纤维化大鼠的肝功能, 其中, 抑制HSC的活化可能是其防治大鼠肝纤维化的机制之一.
骨髓源性肝干细胞(BDLSC)来源充足, 增殖能力强, 在体内外均有极强的向肝系细胞分化的能力, 成为基因治疗肝脏疾病理想的靶细胞. 尿激酶型纤溶酶原激活物(uPA)在降解纤维、逆转肝纤维化中起重要作用.
朴云峰, 教授, 吉林大学第一临床医院消化科
本课题组研究发现, 随着MOI的增高, 携带人uPA基因的腺病毒(AduPA)转染BDLSC转染效率明显增高, 当MOI为500时, 转染效率达92.6%±2.2%, 转染3 d后的人uPA在BDLSC稳定表达, 且转染AduPA对BDLSC的增殖和分化无明显影响.
本研究将AduPA体外转染BDLSC, 移植入肝纤维化大鼠体内, 评价转基因BDLSC对HSC活化和肝纤维化大鼠疗效的影响, 从而为其临床应用治疗肝纤维化提供理论依据和实践基础.
本研究选题新颖, 有特色, 技术路线合理, 研究结果可靠, 结论明确, 有一定的新意, 对同行有参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Bezerra JA, Currier AR, Melin-Aldana H, Sabla G, Bugge TH, Kombrinck KW, Degen JL. Plasminogen activators direct reorganization of the liver lobule after acute injury. Am J Pathol. 2001;158:921-929. [PubMed] |
| 2. | Shimizu M, Hara A, Okuno M, Matsuno H, Okada K, Ueshima S, Matsuo O, Niwa M, Akita K, Yamada Y. Mechanism of retarded liver regeneration in plasminogen activator-deficient mice: impaired activation of hepatocyte growth factor after Fas-mediated massive hepatic apoptosis. Hepatology. 2001;33:569-576. [PubMed] [DOI] |
| 3. | Avital I, Inderbitzin D, Aoki T, Tyan DB, Cohen AH, Ferraresso C, Rozga J, Arnaout WS, Demetriou AA. Isolation, characterization, and transplantation of bone marrow-derived hepatocyte stem cells. Biochem Biophys Res Commun. 2001;288:156-164. [PubMed] [DOI] |
| 4. | Hong H, Chen JZ, Zhou F, Xue L, Zhao GQ. Influence of serum from liver-damaged rats on differentiation tendency of bone marrow-derived stem cells. World J Gastroenterol. 2004;10:2250-2253. [PubMed] |
| 5. | 孙 超, 李 定国, 陈 源文, 陈 颖伟, 孙 巧玲, 汪 保灿. 腺病毒介导的人uPA体外转染大鼠骨髓源性肝干细胞的研究. 胃肠病学和肝病学杂志. 2006;15:46-49. |
| 6. | Fang B, Shi M, Liao L, Yang S, Liu Y, Zhao RC. Systemic infusion of FLK1(+) mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice. Transplantation. 2004;78:83-88. [PubMed] [DOI] |
| 7. | Terai S, Sakaida I, Yamamoto N, Omori K, Watanabe T, Ohata S, Katada T, Miyamoto K, Shinoda K, Nishina H. An in vivo model for monitoring trans-differentiation of bone marrow cells into functional hepatocytes. J Biochem. 2003;134:551-558. [PubMed] [DOI] |
| 8. | Jiang Y, Liu J, Waalkes M, Kang YJ. Changes in the gene expression associated with carbon tetrachloride-induced liver fibrosis persist after cessation of dosing in mice. Toxicol Sci. 2004;79:404-410. [PubMed] [DOI] |
| 9. | Kuroiwa Y, Suzuki N, Yamamoto M, Hatakeyama N, Hori T, Mizue N. [Prognostic value of serum markers for liver fibrosis in transient abnormal myelopoiesis (TAM)]. Rinsho Ketsueki. 2005;46:1179-1186. [PubMed] |
| 10. | Gressner AM, Weiskirchen R. The tightrope of therapeutic suppression of active transforming growth factor-beta: high enough to fall deeply? J Hepatol. 2003;39:856-859. [PubMed] [DOI] |
| 11. | George J, Tsutsumi M, Takase S. Expression of hyaluronic acid in N-nitrosodimethylamine induced hepatic fibrosis in rats. Int J Biochem Cell Biol. 2004;36:307-319. [PubMed] [DOI] |
| 12. | Guo MZ, Li XS, Xu HR, Mei ZC, Shen W, Ye XF. Rhein inhibits liver fibrosis induced by carbon tetrachloride in rats. Acta Pharmacol Sin. 2002;23:739-744. [PubMed] |