修回日期: 2008-08-14
接受日期: 2008-08-19
在线出版日期: 2008-09-18
目的: 探讨Apaf-1和Caspase 9在大肠癌中的表达和意义.
方法: 选用武汉市第三医院消化内科结肠镜切除的大肠腺癌组织60例,实时定量PCR方法检测大肠癌患者标本中Apaf-1和Caspase 9 mRNA的表达.
结果: Apaf-1和Caspase 9基因在癌组织中表达明显低于正常组织, 而在癌旁组织及正常组织中表达相近. 癌组织与癌旁组织相比, Apaf-1与Caspase 9基因表达明显下调(0.561±0.049 vs 0.947±0.077, 0.412±0.014 vs 0.922±0.062, 均P<0.01).
结论: Apaf-1和Caspase 9可能在大肠癌的发生和发展过程中起着重要作用.
引文著录: 韩峥, 邓长生. Apaf-1和Caspase 9在大肠癌中的表达及意义. 世界华人消化杂志 2008; 16(26): 3012-3015
Revised: August 14, 2008
Accepted: August 19, 2008
Published online: September 18, 2008
AIM: To investigate the significance of Apaf-1 and Caspase 9 expression in the carcinoma of large intestine.
METHODS: Real-time quantitative reverse transcription polymerase chain reaction (RQ-RT-PCR) technique was established for detecting Apaf-1 and Caspase 9 mRNA expression in tissues incised from 60 colorectal cancer patients examined by colonoscopy in the third hospital of Wuhan City.
RESULTS: Apaf-1 and Caspase 9 mRNA expression were significantly lower in colorectal cancer tissues than those in the normal tissues (0.561 ± 0.049 vs 0.947 ± 0.077, P < 0.01; 0.412 ± 0.014 vs 0.922 ± 0.062, P < 0.01). The expression levels of Apaf-1 and Caspase 9 mRNA had no marked differences between the normal tissues and cancer-adjacent tissues.
CONCLUSION: Apaf-1 and Caspase 9 gene dysfunction maybe contribute to the development and progression of colorectal cancer.
- Citation: Han Z, Deng CS. Expression of Apaf-1 and Caspase 9 gene in colorectal cancer and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 3012-3015
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/3012.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.3012
胃大肠癌是常见的消化系恶性肿瘤, 占胃肠道肿瘤的第2位. 多发部位60%集中在直肠和直肠与乙状结肠交界处. 发病多在40岁以后, 男女之比为2:1. 目前业已发现很多与大肠癌发生相关的基因, 如RAS基因家族、ERBB基因家族、MYC基因家族、p53等[1-2]. 凋亡和肿瘤的发生发展密切相关, 也是肿瘤耐药和化疗、放疗发生副作用的重要原因[3]. 大肠癌细胞存在多种凋亡基因异常. 人结合凋亡蛋白酶活化因子-1(apoptosis protease activating factor-1, Apaf-1)基因位于染色体12q23, Apaf-1和Caspase 9是c-Myc诱导肿瘤细胞凋亡中p53的下游成分, 参与线粒体介导的凋亡途径[4-5]. 本文旨在探讨Apaf-1和Caspase 9基因在大肠癌中的表达.
选用武汉市第三医院消化内科结肠镜切除的大肠腺癌组织60例, 标本的使用经伦理委员会批准并经患者本人知情同意. 其中结肠癌42例, 直肠癌18例, 男36例, 女24例, 年龄46-74(平均57.2)岁. 癌组织经病理检测确认, 癌旁组织取自距离癌肿5 cm的组织, 正常大肠黏膜取自距离癌组织10 cm以上. TRIzol、M-MLV逆转录酶、RNA酶抑制剂购自美国Promega公司, PCR引物由北京博奥森生物技术有限公司合成. 实时定量试剂master Mix为ToYoBo公司产品, 为subgreen荧光染料. Stepone实时定量PCR仪购自Applied Biosystems公司, PCR扩增仪由BIO-RAD公司生产, 高速低温离心机购自德国Sigma公司.
1.2.1 RNA提取: 按TRIzol试剂盒说明方法提取组织总RNA. 加液氮将组织研碎, 加入TRIzol试剂1 mL, 室温静置5 min; 加氯仿0.2 mL, 振荡15 s, 静置2 min; 4 ℃, 12000 r/min, 离心15 min, 取上清; 加入0.5 mL异丙醇, 将管中液体轻轻混匀, 室温静置10 min; 4 ℃, 12000 r/min, 离心15 min, 弃上清; 加入750 mL/L乙醇0.5 mL, 轻轻洗涤沉淀; 4 ℃, 7500 r/min, 离心5 min, 弃上清; 晾干, 加入适量的DEPC H2O(焦碳酸二乙酯水)溶解; -80 ℃冻存备用.
1.2.2 逆转录合成cDNA: 加入RNA 6 μL, Oligo (dT)2 μL, DEPC H2O 12 μL于PCR管, 70 ℃孵育5 min, 短暂摇匀, 放置冰上. 加入5×Buffer缓冲液10 μL, 10 mmol/L dNTP混合液2 μL, RNA酶抑制剂1 μL, M-MLV逆转录酶2 μL, 加DEPC H2O 15 μL, 混匀后置42 ℃孵育60 min. 升温至95 ℃, 5 min后, 再5 ℃孵育5 min. -20 ℃冻存备用.
1.2.3 荧光定量RT-PCR: (1)按Apaf-1和Caspase 9基因序列设计并合成引物: Apaf-1: Forward primer: 5'-ACATTTCTCACGATGCTACC-3', reverse primer: 5'-CAATTCATGAAGTGGCAA-3'; Caspase 9: Forward primer: 5'-GGCTGTCTACGGCACAGATGGA-3', reverse primer: 5'-CTGGCTCGGGGTTACTGCCAG-3'. (2)RT-PCR: 采用subgreen荧光染料, 反应体系: Mix 5 μL, cDNA 1 μL, 上/下游引物(10 pmol/L)1 μL, H2O 3 μL, 反应总体积为10 μL. 反应条件为: 95 ℃预变性1 min, 95 ℃变性15 s, 60 ℃退火45 s, 72 ℃延伸30 s, 扩增40个循环, 60 ℃延伸结束时采集荧光信号, 并作溶解曲线检测引物特异性. (3)选择β-actin作为内参照β-actin Forward primer: 5'-CTCACGAAACTGGAATAAGC-3', β-actin reverse primer: 5'-AAGCCACACGTACTAAAGGT-3'. PCR扩增反应体系与Apaf-1和Caspase 9相同.
统计学处理 将各样本Ct值代入公式基因表达量 = 2-ΔΔCt计算, 其中ΔΔCt = [目的基因的平均Ct值(样本组)-管家基因的平均Ct值(样本组)]-[目的基因的平均Ct值(校正组)-管家基因的平均Ct值(校正组)]; 应用SPSS13.0统计软件进行数据处理, 组间比较采用t检验.
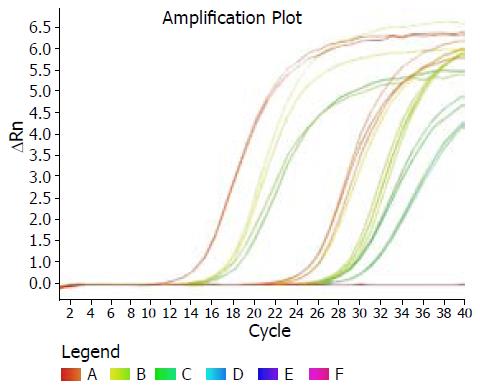
实时定量PCR仪检测荧光信号, 然后进行计算. 当检测到目的基因的荧光信号出现指数增长时, 仪器给出此时的Ct值, 即出现指数增长的最低循环数, 他与此管中cDNA直接相关, 因此用Ct值来反映此管中cDNA的数量. inner, Apaf-1和Caspase 9基因都出现指数增长, 并到达平台期, 得到很好的扩增, 通过复孔取平均值, 得到每个基因扩增时的Ct值(图1).
大肠癌在北美、西欧、澳大利亚、新西兰等地的发病率最高, 居内脏肿瘤前2位. 在我国, 随着人民生活水平的提高, 饮食结构的改变, 其发病率呈逐年上升趋势.
大肠癌的发生、发展是一个多因素、多基因作用的复杂过程. 而细胞的抗凋亡作用是肿瘤发生的一个重要因素. 近年研究揭示, 细胞凋亡是通过不同的通路实现的. 其中主要的两条通路是Fas/TNFR1介导的死亡受体途径及线粒体依赖途径. Apaf-1是线粒体依赖途径的关键蛋白酶, 当细胞的凋亡刺激(如DNA损伤)启动凋亡后, Bax蛋白由胞液转移至线粒体膜上, 在此构建膜孔或裂隙. 细胞色素C从构建的孔隙中进入胞液, 在dATP的协助下, Apaf-1的C端WD重复区, Apaf-1发生构象改变而活化, 活化的Apaf-1借助N端的CARD结构域经同源作用与proCaspase 9分子中的CARD结构域寡聚化, 形成凋亡小体(apoptosome), 促使proCaspase 9自身活化, 活化的Caspase 9激活下游的Caspase 2、3、6、7、8和10, 切割特定的凋亡底物, 诱导细胞凋亡[6-9].
对细胞凋亡的耐受是肿瘤细胞逃避化疗药物治疗和免疫介导破坏的一个潜在机制. 大多数抗肿瘤药物, 细胞凋亡始于细胞色素C/Apaf-1/Caspase 9途径[10-11], 失去激活细胞凋亡途径可以导致细胞对多种化疗药物的耐受. 在dATP和ATP的作用下, Apaf-1/细胞色素C复合物通过CARD-CARD结构域相互作用与Caspase 9前体结合, 从而激活Caspase 9, 即成熟Caspase 9从凋亡小体中释放出来[12-14], 一旦与Apaf-1结合, Caspase 9就被细胞色素C和dATP激活, 进而激活Caspase 3, 导致细胞凋亡.
由此我们推断, Apaf-1与Caspase 9的表达活性降低, 可能参与了大肠癌发生发展过程, 也可能是大肠癌治疗过程中出现耐药的影响因素之一.
Apaf-1是一种分子质量为130 kDa的蛋白质, 由3个结构域组成. 其氨基末端含有一个半胱氨酸蛋白酶募集域(caspase recruitment domain, CARD), CED24同源域内包含一个保守的P环, 长的羧基末端结构域则由12个WD240重复片段组成. 人脑、心、肝、脾、肺、胰、肾、胸腺、小肠、大肠、骨骼肌、卵巢、睾丸、外周血白细胞及胚脑、肝、肺、肾等多种组织内均有Apaf-1. 其中, Apaf-1在成人脾、外周血白细胞和胚脑、肺、肾的表达最高, 与这些组织内高水平的凋亡发生率相一致.
Caspase 9基因广泛表达于人类的正常组织, 如神经、肌肉、肝脏、脾脏、胃和肺等. 有研究表明[15-16], 在胃癌、皮肤黑色素瘤和白血病中都发现Caspase 9基因转录和翻译水平的下调.
本文60例大肠癌中, Apaf-1和Caspase 9基因在癌组织中表达明显低于正常组织, 而在癌旁组织及正常组织中表达相近. 癌组织与癌旁组织相比, Apaf-1与Caspase 9基因表达明显下调, 二者差异有显著性, 提示Apaf-1与Caspase 9基因与大肠癌的发生发展可能相关. 我们拟进一步检测并分析不同病理类型、分化程度和预后的大肠癌标本中Apaf-1与Caspase 9的表达, 为揭示大肠癌的发病机制提供新的依据.
大肠癌是常见的消化系恶性肿瘤. Apaf-1和Caspase 9是c-Myc诱导肿瘤细胞凋亡中p53的下游成分, 参与线粒体介导的凋亡途径. 本文旨在探讨Apaf-1和Caspase 9基因在大肠癌中的表达.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
既往的研究表明, 在胃癌、黑色素瘤、白血病等多种肿瘤患者标本中发现有Apaf-1和Caspase 9表达下调, 而目前尚未见利用实时定量逆转录聚合酶链反应方法来检测结肠癌组织中二者的表达情况.
应用荧光定量RT-PCR方法同时检测结肠癌组织中Apaf-1和Caspase 9基因, 检测手段先进, 检测指标新颖.
Apaf-1与Caspase 9在大肠癌组织中的表达下调, 表明二者可能参与了大肠癌发生发展过程, 也可能是大肠癌治疗过程中出现耐药的影响因素之一.
本研究选题尚可, 有一定可读性, 若能Western blot进一步检测Apaf-1和Caspase 9蛋白表达会更好.
编辑: 李军亮 电编: 何基才
| 1. | Correa P. The biological model of gastric carcinogenesis. IARC Sci Publ. 2004;301-310. [PubMed] |
| 2. | Höfler H, Becker KF. Molecular mechanisms of carcinogenesis in gastric cancer. Recent Results. Cancer Res. 2003;162:65-72. [PubMed] |
| 3. | Johnstone RW, Ruefli AA, Lowe SW. Apoptosis: a link between cancer genetics and chemotherapy. Cell. 2002;108:153-164. [PubMed] [DOI] |
| 4. | Soengas MS, Capodieci P, Polsky D, Mora J, Esteller M, Opitz-Araya X, McCombie R, Herman JG, Gerald WL, Lazebnik YA. Inactivation of the apoptosis effector Apaf-1 in malignant melanoma. Nature. 2001;409:207-211. [PubMed] [DOI] |
| 5. | Fu WN, Bertoni F, Kelsey SM, McElwaine SM, Cotter FE, Newland AC, Jia L. Role of DNA methylation in the suppression of Apaf-1 protein in human leukaemia. Oncogene. 2003;22:451-455. [PubMed] [DOI] |
| 6. | Ruiz-Vela A, Korsmeyer SJ. Proapoptotic histone H1.2 induces CASP-3 and -7 activation by forming a protein complex with CYT c, APAF-1 and CASP-9. FEBS Lett. 2007;581:3422-3428. [PubMed] [DOI] |
| 7. | Orzáez M, Mondragón L, Marzo I, Sanclimens G, Messeguer A, Pérez-Payá E, Vicent MJ. Conjugation of a novel Apaf-1 inhibitor to peptide-based cell-membrane transporters: effective methods to improve inhibition of mitochondria-mediated apoptosis. Peptides. 2007;28:958-968. [PubMed] [DOI] |
| 8. | Ashraf QM, Mishra OP, Delivoria-Papadopoulos M. Mechanisms of expression of apoptotic protease activating factor-1 (Apaf-1) in nuclear, mitochondrial and cytosolic fractions of the cerebral cortex of newborn piglets. Neurosci Lett. 2007;415:253-258. [PubMed] [DOI] |
| 9. | Anichini A, Mortarini R, Sensi M, Zanon M. APAF-1 signaling in human melanoma. Cancer Lett. 2006;238:168-179. [PubMed] [DOI] |
| 10. | Cecconi F, Alvarez-Bolado G, Meyer BI, Roth KA, Gruss P. Apaf1 (CED-4 homolog) regulates programmed cell death in mammalian development. Cell. 1998;94:727-737. [PubMed] [DOI] |
| 11. | Fortin A, Cregan SP, MacLaurin JG, Kushwaha N, Hickman ES, Thompson CS, Hakim A, Albert PR, Cecconi F, Helin K. APAF1 is a key transcriptional target for p53 in the regulation of neuronal cell death. J Cell Biol. 2001;155:207-216. [PubMed] [DOI] |
| 12. | Robles AI, Bemmels NA, Foraker AB, Harris CC. APAF-1 is a transcriptional target of p53 in DNA damage-induced apoptosis. Cancer Res. 2001;61:6660-6664. [PubMed] |
| 13. | Ho AT, Li QH, Hakem R, Mak TW, Zacksenhaus E. Coupling of Caspase 9 to Apaf1 in response to loss of pRb or cytotoxic drugs is cell-type-specific. EMBO J. 2004;23:460-472. [PubMed] [DOI] |
| 14. | Zou H, Henzel WJ, Liu X, Lutschg A, Wang X. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of Caspase 3. Cell. 1997;90:405-413. [PubMed] [DOI] |
| 15. | Frank O, Brors B, Fabarius A, Li L, Haak M, Merk S, Schwindel U, Zheng C, Müller MC, Gretz N. Gene expression signature of primary imatinib-resistant chronic myeloid leukemia patients. Leukemia. 2006;20:1400-1407. [PubMed] [DOI] |
| 16. | Kuwahara D, Tsutsumi K, Oyake D, Ohta T, Nishikawa H, Koizuka I. Inhibition of Caspase 9 activity and Apaf-1 expression in cisplatin-resistant head and neck squamous cell carcinoma cells. Auris Nasus Larynx. 2003;30 Suppl:S85-S88. [PubMed] [DOI] |