修回日期: 2008-08-17
接受日期: 2008-08-26
在线出版日期: 2008-09-08
目的: 探讨长效奥曲肽对四氯化碳(CCl4)诱发大鼠肝纤维化门静脉高压的影响和机制.
方法: SD大鼠40只, 随机分为正常对照组(n = 8)、肝纤维化门脉高压组(n = 16)和长效奥曲肽组(n = 16). 以400 mL/L CCl4 sc(3 mL/kg)建立大鼠肝纤维化门脉高压症模型, 长效奥曲肽组同时给以长效奥曲肽(0.8 mg/kg), 每4 wk肌肉注射1次. 8 wk后检测门静脉压力、肝脏组织形态学改变、血浆胰高血糖素和内皮素等.
结果: 长效奥曲肽组门静脉压、胰高血糖素和内皮素较肝纤维化门脉高压组显著降低(t = 2.5, P<0.05; t = 2.088, P<0.05; t = 2.102, P<0.05), 但仍高于正常对照组(t = 5.152, P<0.01; t = 2.896, P<0.01; t = 2.770, P<0.05). 正常对照组大鼠肝脏大体形态和组织学无异常改变; 肝纤维化门脉高压组及长效奥曲肽组大鼠肝脏组织形态学表现为肝纤维化改变, 但后者的病理损害指标显著轻于前者(P<0.05).
结论: 长效奥曲肽组大鼠门静脉压力显著低于肝纤维化门脉高压组, 其机制可能与肝脏组织损害减轻、血浆胰高血糖素和内皮素降低等有关.
引文著录: 杨文燕, 吴建新, 戴强, 江佛湖. 长效奥曲肽对大鼠肝纤维化门静脉高压形成的影响. 世界华人消化杂志 2008; 16(25): 2815-2819
Revised: August 17, 2008
Accepted: August 26, 2008
Published online: September 8, 2008
AIM: To observe the effect of long-acting release octreotide (Sandostatin LAR) on the genesis of portal hypertension in rats with liver fibrosis induced by carbon tetrachloride (CCl4).
METHODS: Forty SD rats were assigned randomly into 3 groups: normal control group (n = 8), fibrosis with portal hypertension group (n = 16) and Sandostatin LAR group (n = 16). Except those in the normal control group, the rats in the remaining two groups were subcutaneously injected with 400 mL/L CCl4 (3 mL/kg) for induction of fibrosis with portal hypertension. Sandostatin LAR (0.8 mg/kg) was used intramuscularly once every 4 weeks. After 8 weeks, the pressures of portal vein were measured before pathological evaluation including macroscopic features of the liver, and plasma glucagon as well as endothelin was determined by radioimmunoassay.
RESULTS: The portal pressure, plasma glucagon and endothelin levels were significantly lower in the Sandostatin LAR group than those in the fibrosis with portal hypertension group (t = 2.5, P < 0.05; t = 2.088, P < 0.05; t = 2.102, P < 0.05), but still higher than those in the normal control group (t = 5.152, P < 0.01; t = 2.896, P < 0.01; t = 2.770, P < 0.05). In the normal control group, liver morphology and histology were had no abnormal changes; in the fibrosis with portal hypertension group and Sandostatin LAR group, fibrotic changes were observed, and moreover, the severity was higher in the former group (P < 0.05).
CONCLUSION: Long-acting octreotide can remarkably decrease the pressures of portal vein, which may be attributed to reduced liver fibrosis and decreased plasma glucagon and endothelin levels.
- Citation: Yang WY, Wu JX, Dai Q, Jiang FH. Effect of long-acting octreotide on portal hypertension in rats with liver fibrosis. Shijie Huaren Xiaohua Zazhi 2008; 16(25): 2815-2819
- URL: https://www.wjgnet.com/1009-3079/full/v16/i25/2815.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i25.2815
肝硬化门脉高压症并发食管胃底静脉曲张破裂(esophageal varicis bleeding, EVB)和/或门脉高压性胃病(portal hypertension gastropathy, PHG)可以引起致命性上消化道大出血. 能有效防治这些并发症的药物及其效果有限. 以普萘洛尔为代表的β-受体阻滞剂药物疗效肯定[1], 但至少有30%的门脉高压症患者服药后仍然出现门静脉压力增高, 并发再出血. 生长抑素及其类似物(奥曲肽)控制急性出血有效[2]. 然而, 这类药物半衰期短, 只能短期应用于急诊抢救, 不作为预防用药. 新近推出的以缓释技术生产的长效奥曲肽, 弥补了药效短促缺点, 但这一制剂目前临床上仅用于肿瘤, 尚未有防治肝硬化(肝纤维化)门脉高压症并发食管胃底静脉曲张破裂出血方面的研究. 为此, 本研究应用长效奥曲肽干预大鼠肝纤维化门脉高压形成, 观察这一药物对肝纤维化病理组织学损伤、门静脉血液动力学以及血浆相关激素的影响, 评价其降低门脉压力的效果和作用机制.
健康♂SD大鼠40只, 体质量162±10 g, 购买于中国人民解放军第二军医大学动物实验中心(SPF级动物实验室). 上述大鼠的饲养以及整个动物实验在中国人民解放军第二军医大学动物实验中心进行. 长效奥曲肽(商品名善龙, 诺华制药), 20 mg/支, 4 ℃冰箱内保存, 注射前24 h室温放置, 给药前用生理盐水配制成0.5 g/L; 四氯化碳(CCl4, 上海化学制剂厂, 化学纯), 用橄榄油配制成浓度为400 mL/L; 胰高血糖素放免试剂药盒(北京北方生物技术研究所); 血管内皮素放免试剂药盒(中国人民解放军总医院科技开发中心)等.
SD大鼠称质量并标记后, 根据SAS软件随机分组数据分为正常对照(n = 8)、肝纤维化门脉高压症(n = 16)和长效奥曲肽(n = 16)3组. 肝纤维化门脉高压组每周2次 sc 400 mL/L CCl4 3 mL/kg, 首剂sc 5 mL/kg; 每4 wk肌肉注射生理盐水1次; 长效奥曲肽组每周2次 sc 400 ml/L CCl4 3 mL/kg(首剂5 mL/kg), 同时每4 wk给予长效奥曲肽肌肉注射1次(0.8 mg/kg); 正常对照组仅给以橄榄油和生理盐水, 注射方法及剂量与其他2组相同. 3组大鼠均于8 wk后经腹腔注射30 g/L戊巴比妥钠(2 mL/kg)麻醉后开腹, 暴露门静脉主干, 测定门静脉压力(用L型毛细玻璃测压管); 腹主动脉采集血用放免法检测胰高血糖素和内皮素; 同时采集肝脏组织标本, 以40 g/L甲醛固定、脱水、常规石蜡包埋, 连续切片行HE染色和Masson三色染色并参照有关标准进行纤维化程度评定[3].
统计学处理 各组测定值计量数据用mean±SD表示, 组间比较采用t检验; 计数资料组间比较采用卡方检验. 检验水准α = 0.05; 当P<0.05时, 组间差异具有统计学显著性意义.
肝纤维化门脉高压组与长效奥曲肽组大鼠门静脉压显著高于正常对照组(20.9±3.6 cmH2O 18.2±1.9 cmH2O vs 14.3±0.9 cmH2O, t = 5.054, 5.152, P<0.01), 长效奥曲肽组大鼠门静脉压力低于肝纤维化门脉高压组(t = 2.5, P<0.05).
肝纤维化门脉高压组大鼠血浆胰高血糖素、内皮素水平显著高于正常对照组(P<0.01); 长效奥曲肽大鼠血浆胰高血糖素、内皮素水平也较正常对照组高(P<0.01, P<0.05), 但显著低于肝纤维化门脉高压组(P<0.05; 表1).
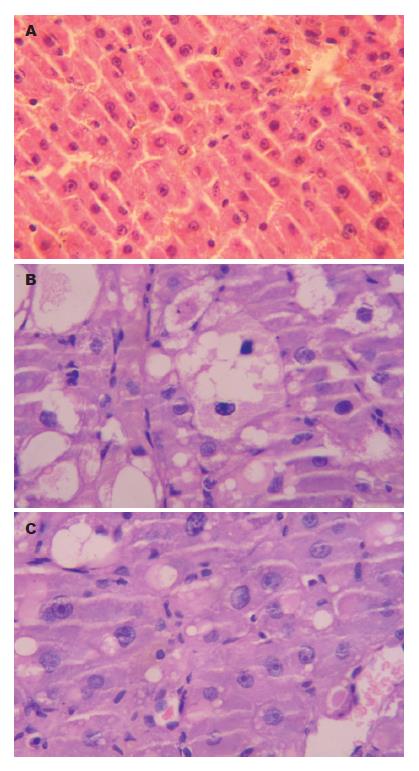
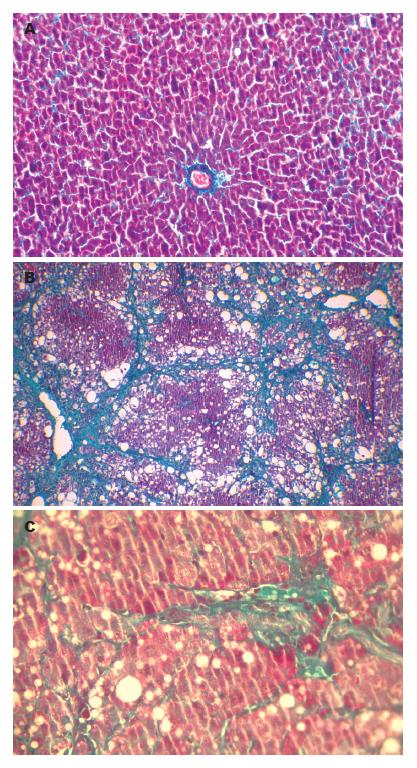
正常对照组大鼠肝脏组织切片HE和Masson染色见肝脏小叶结构正常, 未见脂肪变性、坏死和纤维组织增生(图1A, 图2A). 肝纤维化门脉高压组大鼠肝脏质地变硬, 边缘变钝, 表面呈明显结节状. 肝脏切片HE和Masson染色可见肝细胞脂肪变性、坏死, 有纤维组织增生, 肝脏正常结构被破坏, 假小叶形成(图1B, 图2B). 长效奥曲肽组大鼠肝脏质地变硬, 边缘变钝, 表面呈明显结节状, 肝脏组织切片HE和Masson染色可见肝脏细胞脂肪变性、坏死, 纤维组织增生. 但与肝纤维化门脉高压组相比较, 肝脏细胞脂肪变性、坏死数量减少, 纤维组织增生减轻, 肝脏组织正常结构破坏少[4](P<0.05, 图1C, 图2C).
长效奥曲肽在目前主要用于某些恶性肿瘤的治疗. 但是, 20多年来生长抑素及其类似物有效地用于抢救门脉高压症并发食管胃底静脉曲张破裂出血的事实, 启迪本课题组去探讨他能否具有降低或阻止门脉压力增高、预防并发再次出血的作用. 本研究的结果显示, CCl4诱发的大鼠肝纤维化模型, 经长效奥曲肽干预后, 门静脉压力显著低于肝纤维化组. 不仅如此, 肝脏纤维化损害的程度也明显减轻; 与门静脉高压形成相关的激素或细胞因子如胰高糖素和内皮素也显著低于肝纤维化组. 长效奥曲肽显示了缓慢而持久地减少门静脉系统血流、降低门静脉压力的特征, 而且还表现为一定程度上抑制了肝组织损害和门静脉高动力循环的形成. 这些结果强烈提示, 长效奥曲肽有可能是用于预防门脉高压症并发食管胃底静脉曲张破裂出血的又一选择.
生长抑素及其类似物具有抑制多种激素的释放, 抑制激素和多种细胞因子对靶细胞的作用, 同时具有广泛的抑制细胞增殖活性的作用[5], 对肝脏慢性炎症、肝纤维化以及门脉高压相关的多种细胞因子、激素具有调控或抑制作用[6-7]. 慢性肝病及肝纤维化其细胞外基质代谢的异常, 关键在于肝星状细胞异常活化和异常分泌, 致使大量胶原沉积, 肝脏发生重构异常, 形成再生结节和假小叶, 从而使肝内血管阻力增加. 有些学者研究了生长抑素及其类似物对慢性肝脏损害、抑制肝纤维形成的影响后发现, 生长抑素及其类似物给药后, 不仅有肝星状细胞活化的抑制, 而且还出现了与肝星状细胞活化相关的多种细胞因子调控异常的改善[8]. 这些细胞因子包括转化生长因子β1(TGF-β1)、血小板衍生生长因子(PDGF)以及结缔组织生长因子(CTGF)等[9]. 本研究虽然没有进一步作上述相关指标的检测, 但长效奥曲肽组大鼠肝脏纤维化病理组织学的明显改善, 足以证明该药在抑制门脉高压症形成的机制中, 可以减轻肝纤维化组织损害, 进而降低门脉系统血管阻力.
体内许多血管活性因子参与并且维持了门静脉高动力循环[10]. 根据这些血管活性因子的功能, 大致可以分为扩血管因子和缩血管因子两类. 扩血管因子以胰高血糖素、一氧化氮、前列腺素E2等为代表; 缩血管物质有内皮素、神经肽Y等. 本研究检测的两个代表性因子胰高血糖素和内皮素, 结果都显示了肝纤维化门脉高压组这两个血管活性因子显著增高, 而应用长效奥曲肽后, 上述两种血管活性因子的水平显著低于前者. 早在20年前, 生长抑素及其类似物就已经被证实为可以显著抑制血中胰高血糖素水平, 并用于胰高糖素瘤的治疗. 事实上, 胰高糖素在体内除了具有升高血糖的作用外, 又是一个作用很强的内脏血管扩张剂, 与其他相关生物因子一起, 促成并维持了门脉高压症血液学的高动力循环特征. 所以, 有人提出, 胰高糖素血症直接的后果就是门脉系统等血管的扩张, 高动力循环形成. 当然, 肝硬化胰高糖素血症的形成, 还与慢性肝功能损害, 肝脏降解胰高血糖素发生障碍等多种因素有关. 所以, 血浆胰高血糖素水平升高的程度与肝功能损害的程度成正相关. 这与本研究的结果完全一致. 另外, 胰高糖素增高也与体内许多激素分子等有关, 例如胃泌素、胆囊收缩素(CCK)、乙酰胆碱、胰岛素以及胰泌素等. 这些激素或细胞因子恰恰都受生长抑素及其类似物靶向负调节的影响[11], 本研究中长效奥曲肽组出现的血浆胰高血糖素和门脉压低于肝纤维化组的事实就是例证.
门脉高动力循环病理生理的另一特征是血管收缩因子的异常. 动物实验及临床研究均证实了外源性内皮素可以引起门静脉高压[12]. 本研究也显示肝纤维化大鼠血浆内皮素含量明显升高. 在参与门脉压力调节的多种血管活性因子中, 内皮素是目前已知最强的内源性缩血管活性肽. 肝纤维化时, 活化的肝星状细胞大量分泌内皮素; 而内皮素又能刺激肝星状细胞[13]. 肝星状细胞具有收缩性, 使肝内血管阻力增加. 内皮素亦可直接刺激肾小球旁细胞合成和释放肾素、血管紧张素, 使血中醛固酮潴留, 从而使血管收缩、钠回吸收增加[14], 这正是高动力循环的重要物质基础. 生长抑素及其类似物能抑制肝星状细胞的活化, 抑制其分泌内皮素, 这也可能是长效奥曲肽抑制门脉高压形成重要机制[15], 而缓释的药理作用特征使得这种抑制机制得以持续而充分地发挥.
长效奥曲肽在目前主要用于某些恶性肿瘤的治疗. 但是, 20多年来生长抑素及其类似物有效地用于抢救门脉高压症并发食管胃底静脉曲张破裂出血的事实, 启迪本课题组去探讨他能否具有降低或阻止门脉压力增高、预防并发再次出血的作用.
张晓岚, 教授, 河北医科大学第二医院消化内科
生长抑素及其类似物(奥曲肽)半衰期短, 只能短期应用于急诊抢救, 不作为预防用药. 新近推出的以缓释技术生产的长效奥曲肽, 弥补了药效短促缺点, 但这一制剂目前临床上仅用于肿瘤, 尚未有防治肝硬化(肝纤维化)门脉高压症并发食管胃底静脉曲张破裂出血方面的研究.
门脉高动力循环病理生理的另一特征是血管收缩因子的异常. 动物实验及临床研究均证实了外源性内皮素可以引起门静脉高压.
长效奥曲肽显示了缓慢而持久地减少门静脉系统血流、降低门静脉压力的特征, 而且还表现为一定程度上抑制了肝组织损害和门静脉高动力循环的形成.
本研究有一定的创新性, 层次分明, 思路清晰, 讨论客观, 具有较好的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Nanji AA, Jokelainen K, Tipoe GL, Rahemtulla A, Dannenberg AJ. Dietary saturated fatty acids reverse inflammatory and fibrotic changes in rat liver despite continued ethanol administration. J Pharmacol Exp Ther. 2001;299:638-644. [PubMed] |
| 5. | Patel YC. Somatostatin and its receptor family. Front Neuroendocrinol. 1999;20:157-198. [PubMed] [DOI] |
| 6. | Fort J, Oberti F, Pilette C, Veal N, Gallois Y, Douay O, Rousselet MC, Rosenbaum J, Calès P. Antifibrotic and hemodynamic effects of the early and chronic administration of octreotide in two models of liver fibrosis in rats. Hepatology. 1998;28:1525-1531. [PubMed] [DOI] |
| 7. | Sharma K, Patel YC, Srikant CB. C-terminal region of human somatostatin receptor 5 is required for induction of Rb and G1 cell cycle arrest. Mol Endocrinol. 1999;13:82-90. [PubMed] [DOI] |
| 9. | Chowers Y, Cahalon L, Lahav M, Schor H, Tal R, Bar-Meir S, Levite M. Somatostatin through its specific receptor inhibits spontaneous and TNF-αlpha- and bacteria-induced IL-8 and IL-1 beta secretion from intestinal epithelial cells. J Immunol. 2000;165:2955-2961. [PubMed] |
| 11. | 萧 树东. 江绍基胃肠病学. 第1版. 上海: 上海科学技术出版社 2001; 64. |
| 13. | Pinzani M, Milani S, De Franco R, Grappone C, Caligiuri A, Gentilini A, Tosti-Guerra C, Maggi M, Failli P, Ruocco C. Endothelin 1 is overexpressed in human cirrhotic liver and exerts multiple effects on activated hepatic stellate cells. Gastroenterology. 1996;110:534-548. [PubMed] [DOI] |
| 15. | Reynaert H, Vaeyens F, Qin H, Hellemans K, Chatterjee N, Winand D, Quartier E, Schuit F, Urbain D, Kumar U. Somatostatin suppresses endothelin-1-induced rat hepatic stellate cell contraction via somatostatin receptor subtype 1. Gastroenterology. 2001;121:915-930. [PubMed] [DOI] |