修回日期: 2008-07-07
接受日期: 2008-07-14
在线出版日期: 2008-08-28
牛磺酸通过激活细胞膜上的甘氨酸受体(GlyR)而抑制Kupffer细胞(KC)的活性. GlyR通道的激活促使氯离子内流, 导致细胞膜超极化进而抑制脂多糖(LPS)诱导的KC激活. 在内毒素诱导的大鼠肝损伤模型中, 喂食牛磺酸可通过激活GlyR, 继而抑制KC起到保护肝损伤的作用. 在高渗透压下, LPS诱导的环氧化酶-2和前列腺素的合成明显增加. 牛磺酸可抑制KC内高渗透压诱导的环氧化酶-2和前列腺素, 而对LPS诱导的肝损伤起到保护作用. 牛磺酸可能有益于LPS诱导的肝损伤的临床治疗.
引文著录: 张耘, 魏思东, 龚建平. 牛磺酸通过抑制Kupffer细胞保护内毒素诱导的肝损伤. 世界华人消化杂志 2008; 16(24): 2756-2760
Revised: July 7, 2008
Accepted: July 14, 2008
Published online: August 28, 2008
Taurine has been characterized as an inhibitor of Kupffer cells which activates a glycine receptor (GlyR) expressing in cell membranes. Activation of the GlyR channel allows the influx of chloride, preventing depolarization of the plasma membrane and the potentiation of excitatory signals in Kupffer cells. Dietary taurine has protective effects in rat models against lipopolysaccharide (LPS)-induced liver injury by inactivating Kupffer cells via actvivating GlyR. LPS leads to an induction of cyclooxygenase-2 and prostanoid forma tion, which are markedly enhanced during hyperosmotic conditions. It's been demonstrated that taurine protects against LPS-induced liver injury in Kupffer cells by inhibiting the hyperosmolarity-induced induction of cyclooxygenase-2 and stimulation of prostaglandin production. Taurine may be useful in clinic for the treatment of LPS-induced liver injury.
- Citation: Zhang Y, Wei SD, Gong JP. Protective effect of taurine against lipopolysaccharide-induced liver injury via inactivating Kupffer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(24): 2756-2760
- URL: https://www.wjgnet.com/1009-3079/full/v16/i24/2756.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i24.2756
尽管有种类繁多的抗菌药物和不断更新的监测手段, 脓毒症患者的死亡率仍高达28%[1]. 在内毒素血症时, 脂多糖(lipopolysaccharide, LPS)的刺激诱导Kupffer细胞(KC)释多种炎症介质. 这些炎症介质在LPS诱导的肝损伤中具有特别重要的作用. 而用中和炎症介质的方法来治疗脓毒症始终存在着争议[2]. 最近报道显示牛磺酸能够通过抑制KC而对LPS诱导的肝损伤具有保护作用. 本文对牛磺酸在LPS诱导的肝损伤中的保护作用及其机制予以综述.
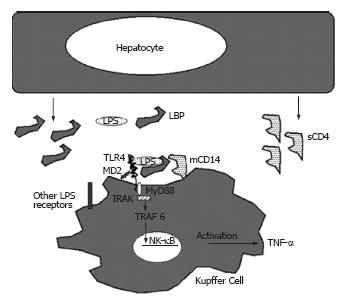
LPS通过细胞内的信号转导激活巨噬细胞, 导致全身炎症反应综合征和脓毒症. LPS通过CD14, 髓样分化蛋白-2(myeloid differentiation protien, MD2)和Toll受体(Toll like receptor, TLR)结合于KC[3](图1), 血浆因子和LPS结合蛋白(LPS-binding protein, LBP)有助于这种结合. CD14缺陷的小鼠对LPS不敏感, TLR4基因敲除小鼠则能够耐受LPS的刺激[4]. TLR4的下游信号转导通过两条途径: 依赖于髓样分化因子(myeloid differentiation factor 88, MyD88)的IL-1受体途径和不依赖于MyD88的途径. 最后核因子B(nuclear factor-κB, NF-κB)转入细胞核内诱导靶基因的表达(图1). 虽然大量证据支持TLR4是膜CD14的一个重要的下游配体, 但仍存在其他的配体[4].
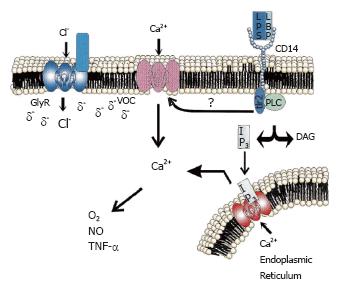
磷脂酶C(phospholipase, PLC), PLA2, PLD和蛋白激酶也介导了LPS的KC内信号转导[5]. PLC被LPS激活后释放甘油二酯和三磷酸肌醇(Inositol 1,4,5-trisphosphate, IP3), IP3诱导细胞内Ca2+浓度升高(图2). 细胞内Ca2+的升高通过线粒体呼吸链增加ROS生成酶的活性和加快自由基的合成. 细胞质内的Ca2+同样是产生ROS氧化酶的重要调节因素, ROS产物很大程度上依赖于[Ca2+]i的移动, 其机制包括了小鼠巨噬细胞内的PKC, PLA2和 Rac途径[5].
KC上LPS的刺激同样可引起磷酸化和蛋白激酶的激活, 这些蛋白激酶包括蛋白酪氨酸激酶和细胞丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)等[6]. 蛋白酪氨酸激酶介导细胞因子的产生而MAPK激活细胞质内PLA2释放花生四烯酸脂.
牛磺酸像β-丙氨酸一样是一个β-氨基酸, 但磺基簇代替了丙氨酸的羧基簇. 他在肝脏和脑内由甲硫氨酸和半胱氨酸转化而来, 半胱亚磺酸脱羧酶(cysteine sulfinate decarboxylase, CSD)是主要的催化酶, 维生素B6为辅助因子. CSD为牛磺酸合成的限速酶, 各物种间活性不同, 但在许多哺乳类动物组织内活性低, 所以各种细胞供应的牛磺酸主要是通过牛磺酸转运蛋白从饮食中吸收的牛磺酸. 牛磺酸的双性离子特性阻止了他通过细胞的脂质层, 牛磺酸是主动转运进入组织, 通过肾和胆道排出, 血浆内浓度低. 牛磺酸以逆浓度梯度的方式吸收依赖钠离子和氯离子, 在牛磺酸转运过程中, 牛磺酸转运蛋白的化学计量是2钠∶1氯∶1牛磺酸, 和正常饮食相比, 低牛磺酸饮食时肾脏调整增加牛磺酸的吸收. 另外, 牛磺酸的外流同样依赖于氯化钠. 牛磺酸的外流依赖于系统中的钠, 氯和细胞内牛磺酸的量, 一旦牛磺酸外流开始, 外部牛磺酸的量和β-丙氨酸不能改变这种外流. 禁食, 普通饮食或低牛磺酸饮食可改变牛磺酸的吸收, 但不能改变牛磺酸的排出[9].
虽然牛磺酸既不是供能物质, 又不构成蛋白质, 但他在生理功能方面具有重要的作用, 如构成结合性胆汁酸, 调整中枢神经系统的功能, 参与细胞再生和对抗氧化诱导的组织损伤. 牛磺酸还是KC的重要的有机渗透物, 在KC内了影响了细胞吞噬, 前列腺素和细胞因子的合成[10].
给予LPS后大鼠出现活动下降, 颤抖和呼吸困难等严重的临床表现, 但在给予LPS以前给予牛磺酸, 可减轻这些严重的临床征象. 在给予LPS以前给予4 wk牛磺酸的预处理组, 和单纯使用LPS组相比, 血清转氨酶活性, 肝内丙二醛和脱氧胆酸盐水平均降低[11], 谷胱甘肽和维生素E水平均升高, 维生素C水平, 超氧化物歧化酶和谷胱甘肽过氧化物酶均没有改变. Erman et al[12]通过检测发现, 给予大鼠饮水内加入的牛磺酸(1.5%, w/v)4 wk可使正常大鼠肝脏内的牛磺酸(128%)的浓度明显增加. 单独摄入牛磺酸不影响大鼠TNF-α或氮氧化物的血浆水平. 况且在正常对照组血浆中未能检测到TNF-α, 但给予静脉推注LPS(5 mg/kg)1.5 h后这些细胞因子明显增加. 给予饮食中加入牛磺酸2 wk能明显阻止LPS诱导的血浆TNF-α的升高. 这说明摄入牛磺酸可对LPS诱导的肝损伤起到保护作用[13].
最近提出采用预防性或者手术前用药的方法给予牛磺酸, 可能治疗由吞噬细胞介导的疾病, 但是研究发现, 牛磺酸对腹膜巨噬细胞和小鼠巨噬细胞RAW 264.7上LPS诱导的NO, 前列腺素E2和TNF-α没有影响[14].
LPS-LBP复合物通过细胞表面的CD14和TLR-4受体激活KC, 引起的[Ca2+]i瞬间升高, 细胞因子的产生依赖于这种[Ca2+]i的升高[15]. 就像中枢神经系统一样, KC存在glyR, 激活氯离子内流可阻止LPS诱导的[Ca2+]i的升高, 降低KC内毒性介质的合成和释放[16]. 牛磺酸可激活KC上的glyR, 使KC中氯离子吸收增加, 说明氯离子可从细胞外流入细胞内, 从而抑制LPS诱导的[Ca2+]i升高. 同时当使用牛磺酸时, LPS诱导的TNF-α降低了40%. KC上的氯内流阻止剂番木鳖硷, 可逆转牛磺酸对LPS诱导的[Ca2+]i升高的抑制作用, 当细胞被放入无氯的缓冲液中, 牛磺酸则失去了阻止LPS诱导的[Ca2+]i升高的作用. 所以, 牛磺酸抑制LPS诱导的[Ca2+]i升高依赖于细胞外的氯离子通过glyR进入KC. 采用分离的大鼠KC的研究表明, 牛磺酸是以剂量依赖性的方式阻止LPS诱导的[Ca2+]i升高, 同时相同剂量的牛磺酸抑制了LPS诱导的TNF-α升高. 这说明牛磺酸以可以达到的剂量阻止了LPS诱导的[Ca2+]i及其相关的TNF-α升高[17]. 然而, 牛磺酸并不能完全阻止LPS诱导的TNF-α升高, 可能是KC吞噬依赖的[Ca2+]i升高[18]不能被牛磺酸抑制所致.
氯离子内流阻止细胞内钙升高假设的原理是[15,17,19], 甘氨酸或牛磺酸激活了细胞膜上的GlyR引起氯离子的内流, 导致了细胞膜的超极化. 在LPS的刺激下, 细胞外的游离钙通过电压门控通道, 电压依赖性内流, 氯离子内流所致的细胞膜超极化状态阻止了这种细胞内钙的升高.
如果在KC上同时使用牛磺酸和甘氨酸, 则二者在促进氯离子内流方面具有累加效应, 然而由于存在其他的受体/信号机制, 激活GlyR并不能完全抑制Ca2+的内流[15].
3.2.1 渗透压对信号转导的影响: PLA2和环氧合酶(cyclooxygenase, COX)共同参与膜结合的花生四烯酸酯转化成前列腺素(prostaglandin, PG)E2的过程. 在哺乳动物多种类型的细胞中, LPS诱导的COX-2在高渗透压环境中明显升高, 并且影响PLA2活性的MAPK在高渗透压环境被激活. 高渗透压对未激活的KC PGE2和PGD2的合成影响很小, 但当细胞周围的渗透压从300 mosmol/L变为350 mosmol/L时, LPS诱导的PGE2和PGD2的合成增加7-10倍. 尿素是膜渗透性良好的渗透物, 在尿素加入等渗液形成的高渗液中, 高渗透压对LPS诱导的PGE2的合成和Cox-2的表达没有影响. 所以, 可能是细胞外高渗透压引起的细胞皱缩, 激发了前列腺素合成的改变而不是高渗透压本身[20]. Ca2+的升高可激活和刺激前列腺素的合成, 但高渗透压对未激活的KC和激活的KC内Ca2+的浓度均没有影响[20]. 因此, 高渗PLA2的激活和刺激前列腺素的合成不是细胞内Ca2+的升高所引起的.
3.2.2 渗透压影响牛磺酸的吸收和排出: 有机渗透物是保持细胞容量代谢的物质, 当细胞因高渗皱缩时吸收, 当细胞因低渗膨胀时从细胞内排出. Warskulat et al[21]的研究显示牛磺酸是大鼠KC的有机渗透物, 并可能调节KC的功能, 如花生四烯酸的合成. 牛磺酸在细胞上的吸收是渗透压依赖性的, 把细胞放入高渗透压环境8 h可看到KC内牛磺酸增加, 而随后放入低渗环境中3-4 h, KC内牛磺酸的增加减少了. 把培养的KC放入高渗液中12 h以诱导牛磺酸的吸收, 之后, 在同样的培养液中加入牛磺酸(10 mmol/L)4 h, 最后放入检测液中, 当检测液为高渗时, 2 h内牛磺酸的排出量是细胞内的10%-l5%, 当检测液是低渗液时, 1 h内牛磺酸的排出量为细胞内的50%. 渗透压的增加使KC牛磺酸转运蛋白(taurine transporter, TAUT)的mRNA水平增加, 相反地, 低渗降低了TAUT的mRNA水平. 加入5 mmol/L的牛磺酸, 高渗诱导的TAUT mRNA水平降低了37%±10%.
3.2.3 牛磺酸抑制PGE2和Cox-2的表达: LPS诱导KC中PGE2和Cox-2的合成, 当培养液同时为高渗透压时PGE2和Cox-2的增加更加明显. 牛磺酸能剂量依赖性地降低诱导Cox-2的表达, 同样的, 牛磺酸可抑制PGE2的合成. 对花生四烯酸的合成调节, 进一步证明了牛磺酸的免疫调节作用. 水合作用影响LPS诱导的Cox-2的表达, 牛磺酸可能增加了细胞的水和作用进而抑制了的Cox-2表达和PGE的合成[21].
最近的研究显示, 预先或同时使用甘氨酸可有效地抑制KC上LPS诱导的IRAK-4表达[22], 而且甘氨酸还可以减低KC上LPS诱导的CD14表达和NF-kB的结合力[23]. 牛磺酸和甘氨酸一样激活KC上的GlyR, 因此牛磺酸有可能抑制KC上LPS诱导的IRAK-4和CD14的表达. Scheel et al[24]在人KC上的研究证明, LPS可使钙传导-电压激活的钾通道激活, 而这种激活过程是细胞膜相关的信号结构所介导的. 但是, 这种离子通道激活的特点, 机制及其在促进炎症信号产生中的准确作用还不完全清楚.
用DNA重组技术合成的人活性蛋白C(human activated protein C, rhAPC), 具有抗炎和抗凝作用, 能够改善重症脓毒症患者的预后, 虽然于2001年由FDA批准应用于临床, 但其临床和实用方面的优势还没有定论, 仍需进一步的考证[25]. 牛磺酸对LPS诱导的肝损伤具有保护作用, 与KC上的GlyR表达、KC的渗透压改变和前列腺素E2分泌相关. 尽管牛磺酸的这种保护机制还不完全清楚, 但这种内源性物质可能为LPS诱导的肝损伤的治疗提供一个有效的途径.
尽管有种类繁多的抗菌药物和不断更新的监测手段, 脓毒症患者的死亡率仍高达28%. 在内毒素血症时, 脂多糖LPS的刺激诱导Kupffer细胞(KC)释多种炎症介质. 这些炎症介质在LPS诱导的肝损伤中具有特别重要的作用.
周伟平, 教授, 中国人民解放军第二军医大学东方肝胆外科医院肝外三科; 程树群, 副教授, 中国人民解放军第二军医大学东方肝胆外科医院综合治疗三科.
中和炎症介质的方法来治疗脓毒症始终存在着争议.
Warskulat et al的研究显示牛磺酸是大鼠KC的有机渗透物, 并可能调节KC的功能, 如花生四烯酸的合成.
尽管牛磺酸的这种保护机制还不完全清楚, 但这种内源性物质可能为LPS诱导的肝损伤的治疗提供一个有效的途径.
本文对目前的最新进展进行了概括, 目的明确, 条理清楚, 论据有力, 结论合理, 有一定的前瞻性和实用性, 对研究方向的提出有一定的指导作用.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Christ-Crain M, Morgenthaler NG, Struck J, Harbarth S, Bergmann A, Müller B. Mid-regional pro-adrenomedullin as a prognostic marker in sepsis: an observational study. Crit Care. 2005;9:R816-R824. [PubMed] [DOI] |
| 2. | Van Amersfoort ES, Van Berkel TJ, Kuiper J. Receptors, mediators, and mechanisms involved in bacterial sepsis and septic shock. Clin Microbiol Rev. 2003;16:379-414. [PubMed] [DOI] |
| 3. | Moriya T, Fukatsu K, Maeshima Y, Ikezawa F, Ueno C, Kang W, Takakayama E, Saitoh D, Mochizuki H, Miyazaki M. Nutritional route affects ERK phosphorylation and cytokine production in hepatic mononuclear cells. Ann Surg. 2007;245:642-650. [PubMed] [DOI] |
| 4. | Su GL. Lipopolysaccharides in liver injury: molecular mechanisms of Kupffer cell activation. Am J Physiol Gastrointest Liver Physiol. 2002;283:G256-G265. [PubMed] |
| 5. | Jin SW, Zhang L, Lian QQ, Yao SL, Wu P, Zhou XY, Xiong W, Ye DY. Close functional coupling between Ca2+ release-activated Ca2+ channels and reactive oxygen species production in murine macrophages. Mediators Inflamm. 2006;2006:36192. [PubMed] |
| 6. | Chow CW, Grinstein S, Rotstein OD. Signaling events in monocytes and macrophages. New Horiz. 1995;3:342-351. [PubMed] |
| 7. | Billack B. Macrophage activation: role of toll-like receptors, nitric oxide, and nuclear factor kappa B. Am J Pharm Educ. 2006;70:102. [PubMed] |
| 8. | Ashare A, Monick MM, Powers LS, Yarovinsky T, Hunninghake GW. Severe bacteremia results in a loss of hepatic bacterial clearance. Am J Respir Crit Care Med. 2006;173:644-652. [PubMed] [DOI] |
| 9. | Han X, Patters AB, Jones DP, Zelikovic I, Chesney RW. The taurine transporter: mechanisms of regulation. Acta Physiol (Oxf). 2006;187:61-73. [PubMed] |
| 10. | Warskulat U, Borsch E, Reinehr R, Heller-Stilb B, Mönnighoff I, Buchczyk D, Donner M, Flögel U, Kappert G, Soboll S. Chronic liver disease is triggered by taurine transporter knockout in the mouse. FASEB J. 2006;20:574-576. [PubMed] |
| 11. | Balkan J, Parldar FH, Doğru-Abbasoğlu S, Aykaç-Toker G, Uysal M. The effect of taurine or betaine pretreatment on hepatotoxicity and prooxidant status induced by lipopolysaccharide treatment in the liver of rats. Eur J Gastroenterol Hepatol. 2005;17:917-921. [PubMed] [DOI] |
| 12. | Erman F, Balkan J, Cevikbaş U, Koçak-Toker N, Uysal M. Betaine or taurine administration prevents fibrosis and lipid peroxidation induced by rat liver by ethanol plus carbon tetrachloride intoxication. Amino Acids. 2004;27:199-205. [PubMed] [DOI] |
| 13. | Kim SK, Kim YC. Attenuation of bacterial lipopolysaccharide-induced hepatotoxicity by betaine or taurine in rats. Food Chem Toxicol. 2002;40:545-549. [PubMed] [DOI] |
| 14. | Kim C, Park E, Quinn MR, Schuller-Levis G. The production of superoxide anion and nitric oxide by cultured murine leukocytes and the accumulation of TNF-alpha in the conditioned media is inhibited by taurine chloramine. Immunopharmacology. 1996;34:89-95. [PubMed] [DOI] |
| 15. | Froh M, Thurman RG, Wheeler MD. Molecular evidence for a glycine-gated chloride channel in macrophages and leukocytes. Am J Physiol Gastrointest Liver Physiol. 2002;283:G856-G863. [PubMed] |
| 16. | Ikejima K, Qu W, Stachlewitz RF, Thurman RG. Kupffer cells contain a glycine-gated chloride channel. Am J Physiol. 1997;272:G1581-G1586. [PubMed] |
| 17. | Seabra V, Stachlewitz RF, Thurman RG. Taurine blunts LPS-induced increases in intracellular calcium and TNF-alpha production by Kupffer cells. J Leukoc Biol. 1998;64:615-621. [PubMed] |
| 18. | Lichtman SN, Wang J, Zhang C, Lemasters JJ. Endocytosis and Ca2+ are required for endotoxin-stimulated TNF-alpha release by rat Kupffer cells. Am J Physiol. 1996;271:G920-G928. [PubMed] |
| 19. | Wheeler MD, Ikejema K, Enomoto N, Stacklewitz RF, Seabra V, Zhong Z, Yin M, Schemmer P, Rose ML, Rusyn I. Glycine: a new anti-inflammatory immunonutrient. Cell Mol Life Sci. 1999;56:843-856. [PubMed] [DOI] |
| 20. | Zhang F, Warskulat U, Wettstein M, Schreiber R, Henninger HP, Decker K, Häussinger D. Hyperosmolarity stimulates prostaglandin synthesis and cyclooxygenase-2 expression in activated rat liver macrophages. Biochem J. 1995;312:135-143. [PubMed] |
| 21. | Warskulat U, Zhang F, Häussinger D. Taurine is an osmolyte in rat liver macrophages (Kupffer cells). J Hepatol. 1997;26:1340-1347. [PubMed] [DOI] |
| 22. | Liu ZJ, You HB, Li XH, Chen XF, Liu HZ, Peng Y, Liu CA, Gong JP. [The mechanism and treatment phases chosen of glycine for inhibition lipopolysaccharide induced Kupffer cells activation]. Zhonghua Waike Zazhi. 2006;44:189-192. [PubMed] |
| 23. | Peng Y, Gong JP, Liu CA, Li SW, Gan L, Li SB. [The effect of glycine on CD14 and NF-kappa B in Kupffer cells from rat liver grafts after ischemia-reperfusion injury]. Zhonghua Ganzangbing Zazhi. 2005;13:179-182. [PubMed] |
| 24. | Scheel O, Papavlassopoulos M, Blunck R, Gebert A, Hartung T, Zähringer U, Seydel U, Schromm AB. Cell activation by ligands of the toll-like receptor and interleukin-1 receptor family depends on the function of the large-conductance potassium channel MaxiK in human macrophages. Infect Immun. 2006;74:4354-4356. [PubMed] [DOI] |
| 25. | Costa V, Brophy JM. Drotrecogin alfa (activated) in severe sepsis: a systematic review and new cost-effectiveness analysis. BMC Anesthesiol. 2007;7:5. [PubMed] [DOI] |