内毒素脂多糖(lipopolysaccharide, LPS)诱导的肝损伤参与了多种肝脏疾病发生发展的进程, 肝脏巨噬细胞(即Kupffer细胞)在LPS诱导肝损伤的过程中发挥着重要作用. 一方面, Kupffer细胞通过LPS信号转导系统被激活而释放促炎因子, 并在肝脏内其他细胞的相互作用下介导肝脏损害; 另一方面, Kupffer细胞的活性又被LPS耐受和其他生理调控机制所抑制, 避免Kupffer细胞活化而诱导肝脏损害. 因此, Kupffer细胞同时受到激活和抑制性因素的共同作用并维持在相对平衡状态, 一旦这种平衡机制被病理因素打破, 就可能招致肝脏损伤; 而Kupffer细胞活性的抑制性干预就成为保护内毒素诱导肝损伤的重要策略.
关键词: Kupffer细胞; 内毒素; 脂多糖; 信号转导; 肝损伤
引文著录: 胡玉川, 徐峰, 徐发良, 龚建平. Kupffer细胞在内毒素诱导肝损伤发病机制中的作用. 世界华人消化杂志 2008; 16(24): 2751-2755
Role of Kupffer cells in the pathogenesis of endotoxin-induced liver injury
Yu-Chuan Hu, Feng Xu, Fa-Liang Xu, Jian-Ping Gong
Yu-Chuan Hu, Feng Xu, Department of Surgery, Liangshan Hospital of Sichuan Province, Xichang 615000, Sichuan Province, China
Fa-Liang Xu, Jian-Ping Gong, Department of Hepatobiliary Surgery, the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
Supported by: National Natural Science Foundation of China, No. 30471696, No. 30500473
Correspondence to: Jian-Ping Gong, Department of Hepatobiliary Surgery, the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China. gongjianping11@126.com
Received: April 1, 2008
Revised: July 7, 2008
Accepted: July 14, 2008
Published online: August 28, 2008
0 引言
肝脏是清除肠源性细菌及其内毒素脂多糖(LPS)的重要场所, 肝脏巨噬细胞(Kupffer细胞, KC)能被LPS激活并导致局部和全身炎症反应. 许多研究也证实, KC活化是导致内毒素性肝损伤的关键环节. 但在生理状态下, KC并未引发肝脏明显的炎症反应和炎症损伤, 这提示KC可能同时受到肝内LPS激活和LPS耐受这两种因素的共同作用, 一旦这种耐受与活化的平衡机制被病理因素打破, 就可能招致内毒素性肝损伤. KC占全身巨噬细胞总数的80%-90%, 是体内最大的巨噬细胞群; 同时KC定居于肝窦, 占肝脏细胞总数的15%, 占肝窦细胞总数的30%, 是肝内主要的LPS反应细胞和炎症细胞因子主要来源. KC特殊的解剖结构和生理功能, 以及他在肝脏和全身巨噬细胞中所处的地位和性质, 决定了他在肝脏乃至全身天然免疫和获得性免疫反应中具有的重要作用, 是内毒素性肝损害和多种肝脏疾病发生发展的关键因素. KC常受肠道细菌、微生物碎片和LPS等因子刺激, 释放细胞因子、类前列腺素、氧化亚氮和活性氧簇; 这些因子一方面调控KC自身的功能活性, 介导炎症反应, 另一方面又和临近细胞(肝细胞、星形细胞、内皮细胞以及其他旁路免疫细胞)产生交互调控[1-2]. 因此, 内毒素性肝损伤的发生发展, 跟KC的LPS信号转导密切相关, 并受局部多种因素的交互影响. 本文从KC的LPS反应性的角度对内毒素性肝损伤的发病机制和治疗原理作一简要综述.
1 单核-巨噬细胞LPS信号转导机制
LPS是革兰氏阴性细菌内毒素(endotoxin)的重要成分, 是最经典最古老的致病因子, 是迄今研究最彻底的病原体相关模式分子(PAPM). 目前有关LPS的识别和信号转导的研究已经在很大程度上勾画出了LPS信号转导及其诱发炎性疾病的确切途径, 这为人们理解和研究细胞激活及内毒素耐受等机制提供了极大的方便, 也是KC导致内毒素性肝损伤的重要基础.
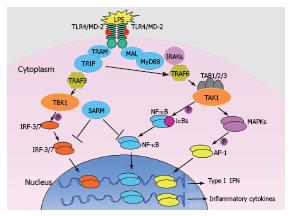
单核-巨噬细胞LPS识别和信号转导过程包括LPS识别、信号转导和细胞效应等关键环节(图1)[3-5]. 游离的LPS首先跟LPS结合蛋白(LPS binding protein, LBP)结合并被转运到CD14, 再通过CD14向细胞膜LPS受体富集和转运; 同时, 可溶型髓样分化蛋白-2(myeloid differential protein-2, MD-2)也可结合游离的LPS, 并以LPS/MD-2复合体的形式向细胞膜LPS受体转运. 完整的LPS受体是由Toll样受体-4(Toll like receptor 4, TLR4)及其辅助分子CD14和MD-2组成的复合受体CD14/TLR4/MD-2: 其中CD14和MD-2虽然能结合LPS但缺乏跨膜结构, 因而不能独立完成LPS信号转导; TLR4具有跨膜结构和LPS结合基序(motif), 但缺乏CD14或MD-2辅助时其结合LPS及信号转导的效率都会大大降低. 因此, LPS复合受体的功能完整性是细胞完成LPS识别和信号转导的关键. LPS与受体结合即导致TLR4寡聚化而被激活[3-5], 一方面通过MyD88-依赖的途径富集衔接分子TIRAP(TIR domain-containing adapter protein)和MyD88, MyD88聚集IL-1R相关激酶(IL-1R-Associated kinase, IRAK)-1/4和TRAF6并激活TAK1/TAB1/2/3复合体, 诱导IκBα/β降解、NF-κB核转位和AP-1磷酸化激活, 促进TNF-α、IL-1、IL-6和IL-8等炎症细胞因子的基因转录. 另一方面, TLR4激活后也通过Trif-依赖的途径(非MyD88依赖途径)富集衔接分子TRAM和Trif[3-5], 诱导干扰素调节因子-3/7(IRF-3/7)磷酸化和核转位, 促进干扰素(interferon, INF)的基因转录. 总之, LPS在细胞外被识别后导致TLR4受体寡聚化激活, 将LPS刺激信号向细胞内转导, 通过MyD88依赖和非MyD88依赖的两条途径触发一系列的信号激联反应, 诱导NF-κB、AP-1和IRF-3等转录因子磷酸化和核转位, 上调TNF-α、IL-1、IL-6、IL-8和IFN-γ等细胞因子的表达, 最后启动炎症反应并有利于病原体清除和机体康复. 当LPS受体被持续激活或病理因素导致LPS信号转导负调控缺陷时, 炎症细胞将释放大量细胞因子, 导致过度或失控性炎症反应, 最终引起宿主组织器官的炎性病理损害. LPS识别和信号转导机制贯穿了KC导致内毒素性肝损伤的全过程(图1).
2 KC的LPS激活与内毒素性肝损伤
KC活化是内毒素性肝损害的关键. Yee et al证实[6-8], KC激活、TNF-α释放、中性粒细胞浸润和凝血系统活化是内毒素性肝损伤的关键因素. 氯化钆(KC功能抑制剂)预处理可有效减轻LPS诱导的肝损伤; LPS刺激后血浆促炎因子TNF-α升高早于肝脏实质细胞的损害; TNF-α合成抑制剂及TNF-α抗血清均可有效减轻LPS诱导的肝损害; 这些研究提示, 在LPS诱导的肝损伤中, 非实质细胞的作用比LPS与肝细胞的直接作用更显著, KC活化及其释放的TNF-α是介导LPS性肝损伤的重要媒介. 同时, TNF-α诱导中性粒细胞在肝内聚集, 一方面导致肝脏炎性损害; 另一方面又促进肝内凝血系统活化, 进一步加重肝脏损害. 进一步研究表明, KC中NF-κB活化是内毒素性肝损伤的重要机制[9-10]. Hirose et al[9]用人工合成甘露糖偶联阿伦膦酸盐(MANA)选择性地剔除KC, 显著改善了LPS诱导的肝损伤、降低了血浆TNF-α和IL-1, 使所有接受致死量LPS注射的小鼠均无内毒素血症的任何表现. Higuchi et al[10]发现, 静脉注射的NF-κB圈套复合体(能有效抑制NF-κB介导的细胞因子转录)迅速被KC摄取而引起复合体在肝内高浓度聚集, 导致LPS诱导的血浆TNF-α、IFN-γ、ALT和AST比对照组显著降低, 肝内活化NF-κB显著减少, 改善了LPS诱导的肝损伤, 而KC吞噬活性性抑剂制氯化钆则能抵消这种效应. 这表明KC及其NF-κB活化在内毒素性肝损伤发病过程中具有重要作用.
KC具有完整而独特的LPS识别和信号转导系统. KC是典型的单核-巨噬细胞群, 具有单核-巨噬细胞的一般属性, 能通过前述LPS信号转导的共同途径被激活, 但也具有自身的LPS识别和信号转导特性. 研究发现[11-12], LBP能促进LPS刺激的正常小鼠KC产生TNF-α, 但C3H/HeJ小鼠(TLR4功能缺陷)KC在LBP存在时也表现LPS低反应性或无反应性; 抗CD14抗体能显著降低LPS刺激的正常KC产生TNF-α, CD14基因敲除KC在等量LPS刺激下产生TNF-α比野生型KC显著减少. 我们发现[13], KC表达TLR4/MD-2受体, LPS激活TLR4/MD-2受体后导致促炎细胞因子TNF-α合成释放, 而抗TLR4抗体可有效抑制这种LPS刺激效应. 这些研究表明, LPS激活KC的过程依赖于TLR4信号转导分子的功能完整性, 而LBP、MD-2和CD14则具有十分重要的作用. 值得注意的是, KC的LPS识别和信号转导系统也具有自身独特性. KC选择性表达两种内毒素结合蛋白(p31和p34)[14], 这两种蛋白在腹腔巨噬细胞和其他多个单核/巨噬细胞株中未见表达, 此前发现的内毒素结合蛋白多存在于细胞外血浆中, 但这两种蛋白具有跨膜结构、定位于细胞膜脂质双分子层内层, 且能结合二磷酰脂质A并激活KC释放TNF-α; 他们跟二磷酰脂质A的结合不需要血浆的存在, 提示他们刺激促炎细胞因子释放的机制有别于CD14和LBP. 因此, KC一方面在LBP和CD14参与下通过TLR4/MD-2完成LPS的识别和信号转导, 介导炎症反应; 另一方面, KC又选择性表达某些蛋白, 并经特定的信号途径被激活而释放炎症介质.
此外, KC的LPS反应性还受肝细胞的影响. 肝脏的LPS反应性异常复杂, 涉及到肝细胞和肝脏非实质细胞(尤其KC)间的相互作用: KC被LPS活化后释放大量炎症细胞因子, 激活肝细胞, 进而扩大炎症反应的范围和程度; 反之, 肝细胞也表达TLR4受体[15], 并在LPS的作用下被激活而释放炎症细胞因子, 促进肝脏非实质细胞(主要是KC)活化. 此外, Scott et al[16]也发现肝细胞能促进肝脏非实质细胞的LPS反应性, LPS刺激肝细胞-肝脏非实质细胞共培养细胞, 产生TNF-α和IL-6比肝脏非实质细胞单独培养时显著增加, 而肝细胞-TLR4突变型(C3H/HeJ)或CD14缺陷型肝脏非实质细胞共培养、LBP缺陷型肝细胞-野生型肝脏非实质细胞共培养以及肝细胞-肝脏非实质细胞共培养被过滤系统分离后, 前述促细胞因子效应均消失. 这表明, 肝脏非实质细胞表达TLR4/CD14、肝细胞分泌的LBP以及紧密的肝细胞-肝脏非实质细胞间相互作用, 都是影响肝脏非实质细胞分泌炎症因子的关键.
3 KC的LPS反应性调控与内毒素肝损伤保护
KC的LPS耐受的生理机制. 肠源性LPS是单核-巨噬细胞激活因子, 在理论上可激活KC导致炎症反应; 但在生理状态下, KC持续暴露于肠源性内毒素LPS, 却并未产生肝内或全身有害的细胞因子反应, 这可能跟KC的LPS耐受有关. 早期研究表明[17-19]: KC的LPS耐受跟肝脏特殊的高精氨酸酶微环境、KC释放大量抗炎因子IL-10以及持续低浓度LPS对KC的刺激等因素有关. 肝内高精氨酸酶活性致使局部左型精氨酸含量降低、LPS刺激的KC中TNF-α产生显著下降而PGE2显著增加; LPS刺激无左型精氨酸培养的腹腔、胸腔和肺泡巨噬细胞TNF-α和PGE2产生均显著高于KC, 提示精氨酸酶TNF-α抑制效应可能为KC特有. 生理条件下持续暴露于门静脉LPS的KC释放大量IL-10, 抑制IL-6和TNF-α合成, 调控肝脏免疫反应; LPS耐受KC吞噬活性明显增强, 促炎因子TNF-α和IL-6释放减少, 抗炎因子PGE2合成增加. 我们发现[20], 经LPS预处理的KC中IRAK-4表达、NF-kB活性和TNF-α释放均显著降低, 提示IRAK-4抑制可能是诱导KC的LPS耐受的另一种潜在机制. 最近发现[21], KC合成LPS脱酰解毒的关键酶-酰基水解酶, 在肝脾酰基水解酶作用下选择性地脱去LPS第二个脂肪酰基链, 脱酰基解毒后的LPS不能再被哺乳动物LPS受体所识别. 酰基水解酶缺陷小鼠不能完成LPS脱酰反应, 其对低剂量LPS刺激的炎症反应就跟野生型小鼠LPS攻击后3 d的表现类似, 出现显著的肝脾肿大; 重组酰基水解酶能恢复酰基水解酶基因敲除小鼠的LPS脱酰作用, 防止LPS诱导的肝肿大. 因此, 酰基水解酶介导的脱酰作用是防止肝脾对革兰氏阴性细菌及其内毒素反应延长的新机制.
KC活性的生理性抑制机制. 研究表明[22], CD4+CD25+调节型T细胞(Treg)也参与KC活性调控, 在没有Treg存在时肝窦内皮细胞、KC和肝细胞均能刺激CD4+ T细胞增殖; 然而有Treg存在时CD4+ T细胞增殖受抑. KC与Treg的相互作用能有效刺激Treg细胞增殖, 另外两种细胞不能刺激Treg细胞增殖. 在CpG-oligonucleotides刺激下, 三种细胞都可克服Treg细胞介导的免疫抑制; 但在LPS作用下只有KC和肝细胞能克服Treg免疫抑制活性; 而LPS作用下TLR4缺陷型肝细胞也无法克服Treg的抑制效应. 总之, Treg细胞可以抑制肝脏各种细胞(包括KC)对CD4+ T细胞的刺激; 而在病原微生物作用下, 肝脏各种细胞可以克服Treg抑制效应, 因而肝脏各种细胞可以通过调控Treg细胞抑制活性, 将肝脏从免疫耐受状态转换到炎症状态. 新近研究表明[23], KC高表达肝脏X受体-α(liver X receptor, LXR-α), LXR激动剂能激活LXR-α, 并以剂量依赖的方式抑制LPS诱导KC产生TNF-α和PGE2, 从而改善内毒素血症动物模型的肝损伤和功能异常. 这些研究表明KC一方面接受来自Treg细胞的抑制性调控, 另一方面也接受其自身LXR介导的跟LPS信号转导发生交互调控的抑制信号, 共同调控KC的活性.
KC的LPS信号转导的抑制性干预. 在KC介导内毒素性肝损伤的理论支持下, 人们对LPS信号转导的抑制性干预进行了大量的研究, 发现了一些有效抑制物及其抑制LPS信号转导的机制. 有研究表明[24], 人工合成的多功能蛋白酶抑制剂甲磺酸卡萘司他(nafamostat mesilate)能下调肝脏LPS受体TLR4/CD14的表达, 从而抑制LPS诱导的炎症反应, 显著降低LPS攻击动物血浆AST、ALT、TNF-α、IL-1b和IFN-g水平, 保护LPS诱导的肝损伤. 早期研究证实甘氨酸是廉价、副作用少的细胞保护剂, 具有炎症抑制和免疫调控功能; 新近发现, KC表达α/b型甘氨酸门控氯通道, 通过刺激氯离子内流而抑制KC对LPS的反应性, 介导内毒素性肝损伤的肝脏保护效应[25]; 甘氨酸类似物也能通过同样的细胞信号机制抑制KC功能[26]. 我们在这些研究的基础上发现, 甘氨酸还能下调内毒素受体TLR4的信号转导, 降低NF-kB的DNA结合活性, 在抑制TNF-α合成释放的同时却促进IL-10产生, 从而抑制LPS诱导的KC炎症反应, 保护动物内毒素性肝损伤[27]. 此外, 牛黄酸也具有抑制KCTNF-α释放、保护内毒素性肝损伤的功能[28].
4 结论
内毒素性肝损伤的发病机制异常复杂, 主要与KC功能活性有关. KC是数量最多的组织巨噬细胞群, 其特殊的解剖定位和生理功能决定了他在肝脏乃至全身免疫调控中都具有十分重要的作用. KC的功能状态取决于激活与耐受两方面刺激的最终结果: 一方面, KC是典型的单核-吞噬细胞, 在肠源性细菌及其内毒素的刺激下被激活而介导炎症反应甚至局部免疫损害; 另一方面, KC又处于肝脏特殊的微环境, 其活性受到来自KC内部LPS信号转导系统以及KC附近多种细胞的交互调控. 激活与耐受的作用达到平衡时肝脏免疫反应维持在生理范围; 在大量LPS作用下KC的LPS信号转导系统被激活, 释放大量促炎因子, 介导肝脏炎症反应和病理损害, 最终可能发展为全身炎症反应. 目前关于KC的LPS信号转导及其在内毒素性肝损伤的研究取得了不少进步, 但还需加强相关机制的研究, KC抑制性干预及其机制研究仍有进一步拓展的空间. 由于KC的LPS反应性与肝细胞/KC相互作用有关, 探讨肝内除KC以外的各种细胞在KC的LPS反应性中的作用对于阐明内毒素性肝损伤发生机制具有重要意义.
评论
背景资料
LPS是革兰氏阴性细菌内毒素(endotoxin)的重要成分, 是最经典最古老的致病因子, 是迄今研究最彻底的病原体相关模式分子(PAPM). 目前有关LPS的识别和信号转导的研究已经在很大程度上勾画出了LPS信号转导及其诱发炎性疾病的确切途径.
同行评议者
殷正丰, 教授, 中国人民解放军第二军医大学东方肝胆外科医院; 陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科.
相关报道
有研究表明, 人工合成的多功能蛋白酶抑制剂甲磺酸卡萘司他能下调肝脏LPS受体TLR4/CD14的表达, 从而抑制LPS诱导的炎症反应, 显著降低LPS攻击动物血浆AST、ALT、TNF-α、IL-1b和IFN-g水平, 保护LPS诱导的肝损伤.
应用要点
探讨肝内除KC以外的各种细胞在KC的LPS反应性中的作用对于阐明内毒素性肝损伤发生机制具有重要意义.
同行评价
本文内容全面, 语言流畅, 选题有特色, 学术价值较好.