修回日期: 2008-07-24
接受日期: 2008-07-29
在线出版日期: 2008-08-28
替诺福韦酯(TDF)是一种新型的无环核苷(酸)类似物, 于2001年被美国FDA批准治疗人免疫缺陷病毒(HIV)的感染. 目前TDF已经是广泛使用的治疗HIV的核苷(酸)类逆转录酶抑制剂之一. 替诺福韦酯在临床实践中的效果, 良好的适用性和合适的剂量均使其成为一线治疗的最流行药物之一. 已有临床研究显示, TDF对合并感染HIV及乙型肝炎病毒(HBV)的患者具有较好的疗效. 本文主要对TDF的研发背景、作用机制、药理学特点、不良反应、在CHB相关疾病方面的临床应用以及在治疗CHB的费用效能分析等方面的研究作一简要述评.
引文著录: 张久聪, 聂青和. 治疗慢性乙型肝炎新药-替诺福韦酯. 世界华人消化杂志 2008; 16(24): 2679-2688
Revised: July 24, 2008
Accepted: July 29, 2008
Published online: August 28, 2008
Tenofovir disoproxil fumarate (TDF) is an oral prodrug of tenofovir, a novel, acyclic nucleotide analogue with in vitro activity against HIV-1 and HIV-2. TDF is licensed by American Food and Drug Administration (FDA) in 2001 for the treatment of HIV infection. TDF is currently one of the most widely used nucleotide reverse transcriptase inhibitors (NRTIs) for the treatment of HIV infection. Its efficacy, favorable toxicity profile, and convenient dosing have made this drug one of the most popular first-line treatment. Numerous studies have demonstrated the use of TDF in the treatment of HIV infection. It also has been shown to be effective in HIV/HBV coinfected patients and in patients with wild-type and lamivudine-resistant strains. Accumulating evidence suggests that TDF is more potent in suppressing HBV replication. In this review, we summarize the study progress of TDF in treating HBV infection.
- Citation: Zhang JC, Nie QH. New antiviral choice for chronic hepatitis B: tenofovir disoproxil fumarate. Shijie Huaren Xiaohua Zazhi 2008; 16(24): 2679-2688
- URL: https://www.wjgnet.com/1009-3079/full/v16/i24/2679.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i24.2679
乙型肝炎(hepatitis B)是一种发病率高、感染力强、严重危害人类健康的世界性流行性传染病[1-4]. 目前, 全世界约有20亿人感染过乙型肝炎病毒(hepatitis B virus, HBV), 其中3.5亿人成为慢性HBV携带者, 全球每年约100万人死于HBV感染相关的肝脏疾病[5-8]. 我国是乙型肝炎的高发区, 根据1992-1995年全国病毒性肝炎血清流行病学调查显示, 我国HBV感染率为57.6%, HBV携带率为9.75%, 推算全国有6.9亿人曾感染过HBV. 根据2002年全国HBV感染者血清流行病学调查, HBsAg的流行率为9.09%, 约有1.2亿人携带HBV. 其中慢性乙型肝炎(chronic hepatitis B, CHB)患者3000多万. 慢性乙肝患者中有15%-25%的危险死于HBV相关性肝脏疾病, 包括慢性重型肝病、肝硬化及肝细胞癌[9-10], 肝硬化失代偿的年发生率约3%, 5年累计发生率约16%[11], 其中6%-15%可发展为肝细胞癌(hepatic cell carcinoma, HCC)[12-13]. 慢性乙肝、代偿期和失代偿期肝硬化的5年病死率分别为0%-2%、14%-20%和70%-86%. 我国每年有30万人以上死于乙肝相关性并发症. 此外, 婴儿时期感染HBV者, 90%以上成为慢性HBV携带者, 并且随着年龄的增长演变为慢性肝炎、肝硬化、肝衰竭和肝细胞癌. HBV的持续复制是造成慢性乙肝患者肝脏炎症持续发展, 并导致肝硬化和肝癌发生的重要因素[14-16].
自Dienstag et al[17]发现拉米夫定(LMV)可抑制HBV DNA以来, 以LMV为代表的核苷(酸)类似物抗HBV的临床应用是CHB治疗史上的里程碑, 其问世推动了CHB治疗的进程[18]. 迄今为止, 已有4种核苷(酸)类似物即拉米夫定(LMV)、阿德福韦酯(ADV)、恩替卡韦(ETV)和替比夫定(LdT)获得美国食品与药品管理局(FDA)及中国批准用于慢性乙型病毒性肝炎的治疗[19-20]. 这类药物因其具有迅速抑制HBV复制, 降低病毒载量, 促进HBeAg血清转换, 改善肝组织炎症坏死病变, 延缓肝纤维化进程的作用, 以及良好的耐受性、安全性和服用方便等特点, 已广泛应用于临床抗HBV治疗[21-25]. 但是在临床继续应用几年后遇到越来越多的治疗问题, 尤其是核苷(酸)类似物治疗CHB的耐药性问题[26-28], 以及合并了人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染后的耐药性, 已成为临床医生的棘手问题. 因此, 研发低耐药发生率, 并对临床常见耐药株有较好作用的新型核苷(酸)类似物显得十分迫切.
临床治疗CHB的耐药性问题呼唤新的具有较好作用的新型核苷(酸)类似物的进一步研发和推广. 在2007-11第58届美国肝病研究协会年会和2008-04第43届欧洲肝病年会上, 关于替诺福韦酯(tenofovir disoproxil fumarate, TDF)治疗CHB的多家报道引起了广泛的关注, 成为会议的亮点之一. 鉴于此, 本文主要对TDF的研发背景、作用机制、药理学特点、不良反应、在慢性乙型肝炎相关疾病方面的临床应用以及在治疗慢性乙型肝炎的费用效能分析等方面的研究作一述评.
新型核苷(酸)类似物-TDF于2001-10被美国食品与药品管理局(FDA)批准治疗HIV感染[29-31]. 他在体外能够显著抑制HBV复制的活性, 因此很有希望成为HIV/HBV合并感染HAART疗法一员. TDF是替诺福韦(tenofovir)的前药, 是一个新型的无环核苷(酸)类似物, 在体外有抗HIV-1和HIV-2的活性. TDF已经被批准HIV-1的治疗, 也有多个实验证实了TDF在HIV感染中的良好作用[29,32-33]. TDF在HIV/HBV合并感染中对抗HBV的作用已经在一些短期的治疗中做过报道[34-42], 但TDF对HIV/HBV合并感染中HBV的作用研究还是很少.
TDF还表现出体外抗野生型(wild type)和LMV耐药型HBV的活性[43]. TDF对于大多数核苷(酸)类似物耐药的病毒和罕见的(3%)经96 wk治疗后的K65R耐药突变都有很好的抗病毒活性[32,44-47]. 在回顾性的研究中, TDF表现出一个强效的持续的抑制HIV/HBV合并感染中HBV病毒载量的作用, 包括LMV耐药的毒株[48]和前C区突变[49]. 1个24 wk和2个48 wk的回顾性研究证实了这些效果[37,42]. Lacombe et al[50]通过HIV/HBV合并感染中的HBV消退动力学研究也证实了这一点. 许多因素, 如肝损伤的程度(组织学状态和肝脏生化功能)和LMV的联合用药以及HBV特征(基线病毒载量、基因型、HBe状态和pol变异)等, 均会影响抗病毒治疗HBV单一感染的效果, 但是他们对HBV/HIV合并感染患者的影响还有待研究. HIV感染患者中出现HBV耐药的长期临床转归还不明确. 但是, 正如在HBV感染患者中所观察到的, CHB恶化和肝衰竭已经发生在有LMV耐药HBV出现的HIV/HBV的合并感染中[51-54], 并且与HBV单一感染相比较, 合并HIV感染的患者有并发肝硬化和潜在肝脏疾病相关病死率增加的危险[55-56].
目前TDF已经是广泛使用的治疗HIV的核苷(酸)类逆转录酶抑制剂之一[57]. 其突出的效果, 良好的适用性和合适的剂量都使他成为一线最流行的治疗药物, 并且目前已经被很多指南推荐为一线抗病毒治疗的较好核苷(酸)类逆转录酶抑制剂使用[58-59].
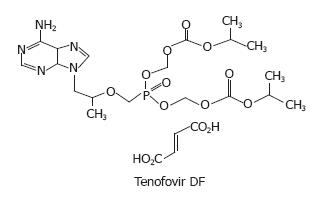
TDF是核苷(酸)逆转录酶抑制剂(nucleotide analog reverse transcriptase inhibitors, NRTI)替诺福韦的酯类前药, 其化学结构如图1. 替诺福韦具有抗HIV逆转录酶活性, 但口服吸收差, TDF与替诺福韦相比, 其在肠道的吸收及摄取显著提高. TDF口服吸收后很快水解为替诺福韦, 替诺福韦可被细胞激酶磷酸化为具有药理活性的代谢产物替诺福韦二磷酸, 后者可与5'-三磷酸脱氧腺苷酸竞争, 参与病毒DNA的合成, 其进入病毒DNA链后, 由于其缺乏3'-OH基团, 因而可导致DNA延长受阻, 进而阻断病毒的复制[60].
TDF单药po 300 mg/d的生物利用度约为25%, 标准高脂肪餐饮食可使之增至39%. TDF单药po 300 mg/d, 血清峰值浓度(peak concentration, Cmax)为: 296±90 μg/L, 达峰时间(peak time, Tpeak)为1.0±0.4 h, 曲线下面积(area under the curve, AUC)为2287±685 (ng·h)/mL. 血清消除半衰期(T1/2)为17 h, 细胞内消除半衰期为10-50 h. TDF主要通过肾脏代谢, 给予TDF 72 h后, 大约70%-80%以原形随尿液排出. 因此TDF与影响肾脏功能或由肾脏竞争清除的药物合用, 其血清浓度会增高[61].
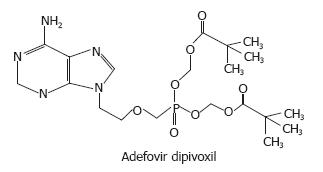
TDF与ADV的分子结构十分相似(ADV化学结构见图2), 很可能以相似的机制作用于LMV耐药的HBV株变异的多聚酶位点. 体外试验显示的抑制HBV活性也相似, 但由于该药几乎无肾毒性, 临床应用的剂量为300 mg/d高于ADV的10 mg/d, 故较ADV有更强的抑制HBV的作用. 有病例报道, 接受TDF治疗出现病毒学应答的患者换用ADV后, 易出现HBV反弹, 但换回TDF, HBV则再次被抑制. 虽有体外试验表明, TDF对ADV相关耐药位点rtN236T和rtA181V阳性的HBV的药物敏感性分别下降5倍和1倍, 但在临床应用中未发现这两个耐药位点的出现. van Bömmel et al[34]认为, 两个药物结构相似而疗效不同可能是由于不同的剂量造成的. 有趣的是, Marcellin et al[62]用ADV 30 mg/d而不是10 mg/d治疗HBV感染患者, 观察到一个与TDF 300 mg/d治疗结果相似的病毒载量的降低.
用药间隔的调整由患者的肌酐清除率(creatinine clearance rate, CCR)决定, CCR<50 mL/min都需做出用药时间的调整[63], 当CCR≥50 mL/min时, 推荐用药间隔为24 h; 当CCR在30-49 mL/min时, 推荐用药间隔为2 d; 当CCR在10-29 mL/min时, 推荐用药间隔为2 wk. 仅有轻度肾脏功能不全但不伴其他疾病的患者(CCR = 50-80 mL/min), 单次po TDF 300 mg, 其吸收和清除与健康志愿者(CCR>80 mL/min)相比无显著差异; 对于不伴其他疾病的中至重度肾脏功能不全者, TDF的肾脏清除明显下降. 终末期肾病患者接受标准高流量血液透析, 可有效清除TDF. 肾脏功能不全患者使用TDF应调整用药间隔.
TDF被美国FDA批准用于HIV感染的治疗, 并在HIV和HBV重叠感染的患者中显示出对HBV野生株和LMV耐药株有很强的抑制作用. 在美国, po TDF与其他抗逆转录病毒药物联合用于治疗HIV-1的感染[50,64]. 欧洲用TDF与其他抗逆转录病毒药物联用治疗抗病毒治疗失败的HIV感染的成年患者, 现在则同时用于曾接受或未接受过抗逆转录病毒治疗的患者. 在感染HIV-1 Ⅲb的MT-2细胞中, TDF抑制HIV复制的作用与齐多夫定(zidovudine)、安普那韦(amprenavir)、奈韦拉平(nevirapine)和地拉夫定(delavirdine)有强大的协同作用; 与地丹诺辛(didanosine)、奈非那韦(nelfinavir)和阿德福韦(adefovir)有轻至中度协同作用; 与阿巴卡韦(abacavir)、LMV、司他夫定(stavudine)、扎西他滨(zalcitabine)、茚地那韦(idinavir)、利托那韦(ritonavir)和沙奎那韦(saquinavir)有相加作用[32]. TDF与其他抗逆转录病毒药物无明显的阻抗作用.
目前TDF尚未被美国FDA批准用于CHB的治疗. 最近与TDF治疗CHB相关的试验和论文比较多[34-36,38,42,48,65], 涉及到TDF在CHB的Ⅲ期临床试验、LMV和ADV耐药患者的疗效、耐药变异的检测方法、多重耐药的治疗、联合抗病毒治疗及相关体外药物敏感试验、肝移植等诸方面, 目前已被批准用于治疗合并HIV感染的CHB, 但尚未获准用于单一CHB的治疗, 不过有关TDF用于治疗单一CHB的Ⅲ期临床研究目前正在进行中+.
德国学者van Bömmel et al[67]报道, 在德国和荷兰共15个研究中心参加的联合实验中, 所有HBV单一感染的患者采用了TDF单独治疗并做了相应的回顾性分析. 127名患者用TDF治疗的平均周期为20 mo(6-54), 其中6名患者之前未经抗HBV治疗, 121名有过抗HBV药物治疗史(16个LMV, 9个ADV, 93个LMV联合ADV, 2个ETV, 1个LMV联合ETV). 治疗12 mo, 仍观察的103名患者中, HBV DNA的降低达到了-4.1±1.3[1.4-7]log, 88个患者(85%)血清中HBV DNA消失, 未见病毒学突破(HBV DNA从最低点>1 log)病例. 12名患者(16%)发生了HBeAg血清学转换, 1名患者(1%)发现HBsAg消失. 70%患者(72/103)ALT复常, 而治疗开始时仅有33%患者(42/127)ALT正常. 具有ADV耐药基因型的患者在第12月时HBV DNA降低很不显著(P<0.004), 而其中HBV DNA<7 log copy/mL的患者的HBV DNA则在观察中消失. 研究表明, 在这一群难治型的患者中, TDF单独治疗是有效的并且能够很好的耐受, 没有发现显著的副作用, 进一步的随访资料将会逐渐公布.
加拿大学者Heathcote et al报道了TDF与ADV对照的HBeAg阳性CHB的随机、双盲、多中心的Ⅲ期临床试验. 266名初治的HBeAg阳性和HBeAg阴性代偿性CHB患者按2∶1比例随机、双盲分组, 分别给予TDF和ADV, 治疗48 wk后两组均给予TDF治疗至5年. 于治疗前、治疗48 wk和治疗5年结束时, 分别做肝活检. 治疗48 wk时, TDF组和ADV组完全应答率分别为67%和12%(P<0.001), 组织学应答率为74%和68%(P>0.05), HBV DNA<400 copy/mL率为74%和12%(P<0.001), ALT复常率为69%和54%(P = 0.018), HBeAg血清转换率为21%和18%(P>0.05), HBsAg消失率为3%和0%(P = 0.018). TDF治疗组安全性和耐受性良好, 耐药变异检测未见耐药变异. Heathcote et al[68]认为, TDF持续治疗48 wk后可引起显著的病毒抑制, HBeAg的血清学转换和HBsAg的消失; 而48 wk ADV治疗后转为TDF治疗更能提供显著的病毒抑制, 并且72 wk的TDF治疗均有很好的耐受.
法国学者Marcellin et al报道了HBeAg阴性CHB单一感染者随机进行1个双盲TDF组(n = 250)和ADV组(n = 125)的Ⅲ期临床试验. 治疗48 wk时, TDF组和ADV组完全应答率分别为71%和49%(P<0.001), 组织学应答率为72%和69%(P>0.05), HBV DNA<300 copy/mL率为92%和59%(P<0.001), ALT复常率为77%和78%(P>0.05). TDF治疗组安全性和耐受性良好, 耐药变异检测未见耐药变异. Marcellin et al[69]将48 wk后HBeAg阴性, 且符合要求的患者转入第二期TDF治疗(为期4年). 病毒学测定和肝组织活检结果提示, TDF持续治疗48 wk后可引起病毒的抑制, 而48 wk ADV治疗后转为TDF治疗更能够提供显著的病毒抑制和组织学改善, 且TDF在治疗过程中均有很好的耐受.
核苷(酸)类似物和逆转录酶抑制剂LMV联合治疗CHB已经展示出有效且无副作用的抑制HBV复制的作用[70-78], 而TDF在治疗LMV耐药患者的效果已经被多个试验所证实[36-38,48,65-68]. 体外研究表明[79], TDF对LMV耐药的HBV有强大疗效. 在LMV耐药患者中[70], TDF耐受性良好, 能显著改善患者病毒学、血清学和组织学, 与ADV高剂量(30 mg/d)疗效相似, 但ADV在高剂量时有肾毒性, 而TDF则无肾毒性. 1个53例HBV DNA高水平复制和LMV耐药患者参加的试验比较TDF和ADV的作用[34]. 所有接受TDF治疗的患者在刚开始治疗几周就显示强大的HBV抑制作用. 在第48周, HBV DNA水平<105 copy/mL的患者ADV组为44%, 而TDF组为100%. TDF治疗的患者中未出现长期治疗而引起的基因型病毒耐药.
van Bömmel et al[65]在研究TNF治疗5例LMV治疗2-3年后失败的HBV/HIV混合感染的患者, 这些患者血清HBV载量均>20×106 copy/mL, 并持续至少1年, 其中4例HBeAg阳性. 应用线性探针法发现HBV聚合酶基因C区均有变异. 5例患者中4例基线时测定有L528M和M552V变异, 1例有M552I/V/L/M551I变异. 后来治疗延续LMV同时加用TDF治疗, 经24-30 wk治疗, 患者血清HBV载量降至均数为(5460±3100) copy/mL(<4000-7800 copy/mL), 相当于HBV DNA平均降低了(4.5±0.9)log, 前后对比有显著差异(P = 0.004). 4例患者基线时ALT正常或接近正常水平, TDF治疗期间仍然无变化. 1例开始时ALT升高, 治疗后复常. 整个治疗期间无TDF相关的严重临床副作用, 全血细胞计数、血小板计数或肾功能均无变化. 从而认为TDF抑制LMV耐药性HBV复制的效果有统计学显著意义, 但是由于治疗时间较短, 对于评估TDF对LMV引起变异患者的治疗效果, 尚需较长时间的观察和进一步的研究.
van Bömmel et al[35]还曾报道了1例CHB患者因LMV耐药导致严重的肝功能损害, 使用TDF治疗获得成功. Nunez et al[48]对12例LMV治疗失败或疗效差的HBV/HIV重叠感染患者使用TDF治疗. 24 wk后, 这些患者的HBV DNA水平比基线值下降3.78 log copy/mL. Ristig et al[36]使用TDF治疗6例α干扰素和LMV治疗失败合并HIV感染的CHB患者, 观察到具有良好的抗HBV活性. 基线时所有患者都持续服用LMV和依曲西他平, 这些患者的表面抗原和e抗原均为阳性, 有4例为肝硬化. 基线HBV病毒载量为7.95 log copy/mL, 治疗初期转氨酶可有一过性升高. 12 wk和24 wk时, HBV病毒载量分别下降至3.1 log copy/mL和4.3 log copy/mL, 没有患者出现e抗体. 因此, 认为TDF是治疗LMV治疗失败的HIV合并HBV感染的很有希望的药物.
van Bömmel et al报告了121例HBV DNA>105 copy/mL, 采用TDF治疗超过6 mo以上的来自13个中心的CHB患者. 其中HBeAg阳性有70例, 105例曾接受过LMV治疗, 75例由于LMV耐药换用ADV. 最终有101例患者接受了TDF(300 mg/d)治疗, 平均治疗时间14.8±12(6-63) mo. 结果表明, 治疗24 wk和48 wk时, HBV DNA分别降低了平均3.8和4.1 log10 copy/mL, HBV DNA<400 copy/mL率为72%和91%; 平均治疗9±3(2-33) mo时, HBeAg转换为23%; 在平均13±6(9-18) mo后, HBsAg消失为4%; 治疗基线时ALT升高的85例患者中, 治疗至48 wk时78%的ALT复常. 治疗基线时的年龄, 性别, 是否合并肝硬化, HBeAg状态和LMV耐药均未影响TDF的治疗应答. 整个治疗过程中, 未见HBV DNA>1 log10 copy/mL的病毒学反弹和TDF耐药的出现. 结论认为, 在曾用过核苷(酸)类似物, 难治性单一HBV感染的患者, TDF单一治疗有很高的疗效, 且无耐药的出现.
van Bömmel et al还对应用LMV耐药后, 换用ADV再次出现耐药的10例CHB患者进行了超过12 mo的TDF单一治疗, 并在治疗前和治疗过程中进行了HBV聚合酶基因克隆测序. 其中, TDF治疗前有4例存在rtA181T/V合并rtN236T位点耐药变异, 3例存在单一rtN236T位点耐药变异, 各有1例存在单一rtA181位点、rtM204Q合并rtA181T位点、rtM204合并rtL180M合并rtN236T位点的耐药变异. 结果显示, 治疗至12 mo时, HBV DNA下降4.4(2.8-5.5)log10 copy/mL, 10例中仍有8例可检测到平均为3.3(1.5-4.9) log10 copy/mL的HBV DNA. 在观察的平均17±2.4(12-24) mo中, 5例患者HBV DNA<400 copy/mL. TDF治疗12 mo时, 对其中2例患者加用LMV治疗, 2 mo后HBV DNA低于检测水平(35 copy/mL). 整个治疗过程中无患者出现病毒学突破. 结论认为, TDF单一治疗对ADV相关及合并的不同耐药变异位点的HBV DNA均有显著的抗病毒作用. 但是观察时间尚显较短, 要全面评价TDF对ADV耐药患者的治疗效果还需要更多的病例、更长的随访时间.
德国学者Manns et al[80]把70名LMV治疗12 wk以上和571名未经LMV治疗的HBeAg阳性或HBeAg阴性的CHB单一感染的患者以2∶1的比例分为TDF组和ADV组治疗48 wk观察, 发现在TDF组LMV治疗过的患者和未经LMV治疗的患者有着相似的治疗效果: HBV DNA<400 copy/mL(88% vs 86%), 组织学的改善(80% vs 72%), 血清ALT复常(78% vs 74%), 同时TDF组和ADV组均有着相似的安全性和耐受性.
新西兰学者Gane et al[81]在一个随机双盲的研究中评价TDF对HBeAg阳性和HBeAg阴性的CHB患者病毒基因型(A-H)的影响. 426名患者, 基因型分别为A(69, 16%), B(47, 11%), C(72, 17%)和D(211, 50%), 随机接受TDF 300 mg/d, 治疗48 wk. 48 wk后, 各组在ALT复常(74% A, 83% B, 73% C, 82% D)和达到HBV DNA<400 copy/mL(95% A, 91% B, 91% C, 90% D)没有显著差别. 在多种基因型中观察到HBeAg、HBsAg消失的现象, 而不只限于A型. 结论认为, TDF 300 mg的治疗提供了一个在HBV基因型A-D中有力的病毒学、血清学、生化反应及组织学上的改善的抗HBV新型药物.
法国学者Lada et al[82]为了评估TDF在应用过LMV治疗合并HIV感染的患者中的初期无反应率. 在147名HIV合并HBV感染的患者在单用TDF治疗37(14-56) mo后, 发现14名患者治疗初期无反应, 通过血浆TDF浓度测量发现其中7名患者没有坚持治疗, 剩余7名在治疗前都有LMV的治疗史, 4名患者感染了G型(其中2人合并A型), 2名A型, 1名E型. 正如预测之中, 这组接受过治疗的患者有很高的耐药突变的发生: rtV173I(28%), rtL180M(57%), rtA181T(14%), rtV191I(28%), S202I(14%), rtM204V(57%)和rtL229M(28%). 所有患者均有后续的治疗反应和血清HBV DNA的降低(≤3 log copy/mL), 未发现rtA194T变异, 并且6 mo治疗后未发现其他新的变异产生. 研究认为这一小部分患者对TDF延迟反应, 可能是由于HIV相关的免疫抑制, 或者是LMV的多重耐药突变造成的, 进一步的病毒准种和表型分析将阐明这一现象的机制.
德国学者Berg et al[83]在一个正在进行中的随机双盲多国合作的实验中, 把CHB单一感染的患者随机以1∶1的比例分为TDF组和TDF+恩曲他滨组(emtricitabine, FTC)接受治疗, 比较其治疗学差异. 治疗24 wk后TDF组中有68%患者HBV DNA<400 copy/mL, 58%患者HBV DNA<169 copy/mL, ALT复常率也达到了66%, 耐药性和安全性的数据也将在48 wk治疗结束后予以公布. TDF治疗提供了和已知HIV感染者的治疗一样有效的耐受性.
西班牙学者Buti et al[84]在比较用TDF治疗肝硬化时的效果时, 将肝硬化患者(Knodell纤维化分数 = 4)和非肝硬化肝脏疾病的患者随机以2∶1的比例进行双盲的TDF组和ADV组的为期48 wk的治疗. 研究发现, TDF组在大部分肝硬化患者的治疗中发挥了很好的疗效: 79%组织学上的改善, 85%达到HBV DNA<400 copy/mL, ALT复常率也达到了69%, 而在HBV DNA的抑制上则显著地优于ADV(48%, P<0.001). 他们认为, 与ADV相比较, TDF在治疗肝硬化时显示出了很好的安全性, 良好的耐受性以及更显著的HBV DNA抑制作用.
TDF可能引起乳酸中毒、与脂肪变性相关的肝肿大等不良反应. 曾报道使用TDF可以致命尤其是妇女, 肥胖史和延长使用是其危险因素, 肝功能不全患者用药时更应注意. TDF最常见的不良反应主要是胃肠道反应, 发生率为11%, 其他不良反应包括腹泻、乏力、头痛、呕吐、腹胀、腹痛、食欲减退等. 另外, TDF主要经肾脏排泄, 在HIV感染患者的治疗中已经有肾毒性的个案报道[85], 建议, 肾功能不全(CCR<60 mL/min)患者不宜使用[86-87]. 但法国学者Lacombe et al[88]比较TDF和其他核苷(酸)逆转录酶抑制剂治疗HIV/HBV合并感染者对肾功能的影响时, 认为TDF组和其他核苷(酸)逆转录酶抑制剂组对患者肾功能的影响没有显著差别.
英国学者Dakin et al[89]采用一个混合治疗比较(mixed treatment comparison, MTC)荟萃分析, 评估未经抗病毒治疗的HBeAg阳性的CHB患者在分别采用ADV, ETV, LMV, LdT和核苷(酸)类药物混合的治疗效果(表1). 结果发现, TDF组最终血清HBV DNA<300 copy/mL的百分比达到最高, 并且除了LdT和LMV联合治疗组显著增加了HBeAg血清学转换外, 其他各组核苷(酸)类药物与安慰剂对照在HBeAg血清学转换上均无统计学差别. 结果显示TDF的治疗效果明显好于所有其他组. 荟萃分析认为, 在该分析中TDF有98%的几率成为最有效的核苷类治疗药物, 但是关于疗效差异, 长期药效, 耐药性, 安全性和费用效能还需要更多的分析和临床实践证明.
| 治疗组(试验组数) | HBV DNA <300 copy/mL的患者百分比(95% CI) | HBeAg血清学转换的患者百分比(95% CI) |
| 替诺福韦酯(1) | 93.7(80.0-99.3)aL,eP | 26.7(11.1-49.1)P |
| ETV(3) | 73.1(57.6-87.6)L, P | 23.9(15.7-33.9)P |
| LdT(4) | 62.9(44.8-81.7)L, P | 25.7(17.1-36.1)P |
| LdT+LMV(1c)G | 53.3(21.9-84.3)P | 13.5(4.2-29.3)P |
| ADV(4) | 48.8(25.8-77.5)P | 22.1(11.6-36.1)P |
| LMV(9)J | 38.4(33.9-42.8)P | 23.5(16.4-32.1)P |
| ADV+LMV(1c)G | 37.5(12.5-68.7)P | 28.1(13.2-47.6)P |
| 安慰剂(5)J | 7.1(1.5-18.5) | 10.7(5.6-17.7)P |
美国学者Deniz et al[90]报道了在意大利和法国的一个TDF治疗HBeAg阴性的CHB患者的费用效能(cost-effectiveness)模拟实验的分析. 研究发现, 在第一列治疗中, TDF显示出很好的有效性, 与LMV和ADV对照显示治疗花费较少, 并且被预测, 与ETV相比, 在较少的花费情况下能够提供相似的治疗效果. 结论提示, 与LMV、ADV和ETV相比较, 在第一列治疗中, TDF是最佳的选择之一. 同样, Deniz et al[91]在西班牙也进行了费用效能模拟分析, 也得到了相似的结果, 即在第一列治疗中, TDF显示出较LMV、ADV和ETV较好的费用效能(表2-3).
| 结果 | 替诺福韦酯 | 拉米夫定 | 阿德福韦酯 | 恩替卡韦 |
| 质量调整生命年 | 14.53 | 12.27 | 13.71 | 14.47 |
| 生命年 | 16.73 | 14.79 | 16.04 | 16.66 |
| 平均每个患者的医疗消费(法国, 欧元) | 103.237 | 108.219 | 129.094 | 134.797 |
| 平均每个患者的医疗消费(意大利, 欧元) | 70.082 | 88.989 | 101.966 | 101.896 |
| 结果 | 替诺福韦酯 | 拉米夫定 | 阿德福韦酯 | 恩替卡韦 |
| 质量调整生命年 | 13.65 | 11.68 | 12.95 | 13.58 |
| 生命年 | 16.07 | 14.30 | 15.42 | 15.99 |
| 平均每个患者的医疗消费(欧元) | 70.589 | 87.394 | 95.859 | 90.549 |
| 1年后HBV DNA清除率(<300 copy/mL) | 92% | 59% | 72% | 91% |
我国是HBV感染的高流行区, 抗病毒治疗是CHB患者治疗的关键, 其目的是长期抑制HBV复制, 阻断病情发展, 从而提高患者的生存质量[92-95]. TDF为新型核苷(酸)类似物, 临床研究显示其对HBV、合并HIV感染及LMV耐药患者具有良好的抗病毒作用[96-99]. 而最新的研究也表明, TDF单独应用治疗CHB单一感染也有着较好的疗效和病毒抑制作用. 由于TDF的抗HBV作用优于ADV, 耐药发生率低, 且对大多数HBV耐药株有效. 因此, TDF在HBV感染的治疗中具有广阔的应用前景+, 有关TDF治疗单一CHB的疗效及安全性等诸多临床研究正在进行之中, 而针对TDF在肝功能不全、肾功能不全、肝移植等患者中的疗效及安全性尚需进一步大规模临床研究证实, 对孕妇和儿童CHB的疗效和安全性也需要进一步研究. 总之, TDF即将成为一种治疗CHB有效的临床用药.
替诺福韦酯(TDF)是替诺福韦的前药, 是一个新型的无环核苷(酸)类似物, 在体外有抗HIV-1和HIV-2的活性. 替诺福韦酯于2001年被美国FDA批准治疗HIV的感染, 目前替诺福韦酯已经是广泛使用的治疗HIV的核苷(酸)类逆转录酶抑制剂之一.
谭德明, 教授, 中南大学湘雅医院感染病科
有关替诺福韦酯治疗单一慢性乙型肝炎的疗效及安全性等诸多临床研究正在紧锣密鼓地进行之中.
最新的研究也表明, 替诺福韦酯单独应用治疗慢性乙型肝炎单一感染也有着较好的疗效和较强病毒抑制作用.
本文与其他相关文章的不同之处在于客观地从替诺福韦酯(TDF)的研发背景, 作用机制, 药理学特点, 不良反应, 在慢性乙型肝炎相关疾病方面的临床应用以及在治疗慢性乙型肝炎的费用效能分析等多方面研究, 综合、全面地介绍了替诺福韦酯治疗慢性乙型肝炎的基础、临床研究状况, 并且全面分析了替诺福韦酯与拉米夫定, 替诺福韦酯与阿德福韦酯的疗效差异.
由于替诺福韦酯的抗HBV作用优于阿德福韦酯, 耐药发生率低, 且对大多数HBV耐药株有效. 因此, 替诺福韦酯在HBV感染的治疗中具有广阔的应用前景.
本文基本反映了替诺福韦酯在抗乙肝病毒感染中应用的最新进展, 内容全面, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Lok AS. Chronic hepatitis B. N Engl J Med. 2002;346:1682-1683. [PubMed] [DOI] |
| 2. | Lok AS, McMahon BJ. Chronic hepatitis B: update of recommendations. Hepatology. 2004;39:857-861. [PubMed] [DOI] |
| 3. | Van Damme P, Van Herck K. A review of the efficacy, immunogenicity and tolerability of a combined hepatitis A and B vaccine. Expert Rev Vaccines. 2004;3:249-267. [PubMed] [DOI] |
| 4. | Borgia G, Gentile I. Treating chronic hepatitis B: today and tomorrow. Curr Med Chem. 2006;13:2839-2855. [PubMed] [DOI] |
| 6. | EASL Jury. EASL International Consensus Conference on Hepatitis B. 13-14 September, 2002: Geneva, Switzerland. Consensus statement (short version). J Hepatol. 2003;38:533-540. [PubMed] [DOI] |
| 7. | Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis. 2002;2:395-403. [PubMed] [DOI] |
| 8. | Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors. J Hepatol. 2008;48:335-352. [PubMed] [DOI] |
| 9. | Liaw YF, Leung N, Guan R, Lau GK, Merican I, McCaughan G, Gane E, Kao JH, Omata M. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2005 update. Liver Int. 2005;25:472-489. [PubMed] [DOI] |
| 10. | Wright TL. Introduction to chronic hepatitis B infection. Am J Gastroenterol. 2006;101 Suppl 1:S1-S6. [PubMed] [DOI] |
| 11. | de Franchis R, Hadengue A, Lau G, Lavanchy D, Lok A, McIntyre N, Mele A, Paumgartner G, Pietrangelo A, Rodés J. EASL International Consensus Conference on Hepatitis B. 13-14 September, 2002 Geneva, Switzerland. Consensus statement (long version). J Hepatol. 2003;39 Suppl 1:S3-25. [PubMed] [DOI] |
| 12. | Lok AS. Prevention of hepatitis B virus-related hepatocellular carcinoma. Gastroenterology. 2004;127:S303-S309. [PubMed] [DOI] |
| 13. | Tran TT, Martin P. Hepatitis B: epidemiology and natural history. Clin Liver Dis. 2004;8:255-266. [PubMed] [DOI] |
| 14. | Tan J, Lok AS. Update on viral hepatitis: 2006. Curr Opin Gastroenterol. 2007;23:263-267. [PubMed] [DOI] |
| 15. | Lok AS, Heathcote EJ, Hoofnagle JH. Management of hepatitis B: 2000--summary of a workshop. Gastroenterology. 2001;120:1828-1853. [PubMed] [DOI] |
| 16. | Lin CL, Kao JH. Hepatitis B viral factors and clinical outcomes of chronic hepatitis B. J Biomed Sci. 2008;15:137-145. [PubMed] [DOI] |
| 17. | Dienstag JL, Perrillo RP, Schiff ER, Bartholomew M, Vicary C, Rubin M. A preliminary trial of lamivudine for chronic hepatitis B infection. N Engl J Med. 1995;333:1657-1661. [PubMed] [DOI] |
| 21. | Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology. 2007;45:507-539. [PubMed] [DOI] |
| 22. | Pramoolsinsup C. Management of viral hepatitis B. J Gastroenterol Hepatol. 2002;17 Suppl:S125-S145. [PubMed] [DOI] |
| 23. | Loomba R, Rowley A, Wesley R, Liang TJ, Hoofnagle JH, Pucino F, Csako G. Systematic review: the effect of preventive lamivudine on hepatitis B reactivation during chemotherapy. Ann Intern Med. 2008;148:519-528. [PubMed] |
| 24. | Mahoney FJ. Update on diagnosis, management, and prevention of hepatitis B virus infection. Clin Microbiol Rev. 1999;12:351-366. [PubMed] |
| 25. | Liaw YF. Current therapeutic trends in therapy for chronic viral hepatitis. J Gastroenterol Hepatol. 1997;12:S346-S353. [PubMed] [DOI] |
| 26. | Leung N. Lamivudine for chronic hepatitis B. Expert Rev Anti Infect Ther. 2004;2:173-180. [PubMed] [DOI] |
| 27. | Lok AS, Zoulim F, Locarnini S, Bartholomeusz A, Ghany MG, Pawlotsky JM, Liaw YF, Mizokami M, Kuiken C. Antiviral drug-resistant HBV: standardization of nomenclature and assays and recommendations for management. Hepatology. 2007;46:254-265. [PubMed] [DOI] |
| 28. | Fung SK, Lok AS. Management of hepatitis B patients with antiviral resistance. Antivir Ther. 2004;9:1013-1026. [PubMed] |
| 29. | Schooley RT, Ruane P, Myers RA, Beall G, Lampiris H, Berger D, Chen SS, Miller MD, Isaacson E, Cheng AK. Tenofovir DF in antiretroviral-experienced patients: results from a 48-week, randomized, double-blind study. AIDS. 2002;16:1257-1263. [PubMed] [DOI] |
| 30. | McGovern BH. The epidemiology, natural history and prevention of hepatitis B: implications of HIV coinfection. Antivir Ther. 2007;12 Suppl 3:H3-13. [PubMed] |
| 31. | Pawlotsky JM, Dusheiko G, Hatzakis A, Lau D, Lau G, Liang TJ, Locarnini S, Martin P, Richman DD, Zoulim F. Virologic monitoring of hepatitis B virus therapy in clinical trials and practice: recommendations for a standardized approach. Gastroenterology. 2008;134:405-415. [PubMed] [DOI] |
| 32. | Squires K, Pozniak AL, Pierone G, Steinhart CR, Berger D, Bellos NC, Becker SL, Wulfsohn M, Miller MD, Toole JJ. Tenofovir disoproxil fumarate in nucleoside-resistant HIV-1 infection: a randomized trial. Ann Intern Med. 2003;139:313-320. [PubMed] |
| 33. | Gallant JE, Staszewski S, Pozniak AL, DeJesus E, Suleiman JM, Miller MD, Coakley DF, Lu B, Toole JJ, Cheng AK. Efficacy and safety of tenofovir DF vs stavudine in combination therapy in antiretroviral-naive patients: a 3-year randomized trial. JAMA. 2004;292:191-201. [PubMed] [DOI] |
| 34. | van Bömmel F, Wünsche T, Mauss S, Reinke P, Bergk A, Schürmann D, Wiedenmann B, Berg T. Comparison of adefovir and tenofovir in the treatment of lamivudine-resistant hepatitis B virus infection. Hepatology. 2004;40:1421-1425. [PubMed] [DOI] |
| 35. | Van Bömmel F, Schernick A, Hopf U, Berg T. Tenofovir disoproxil fumarate exhibits strong antiviral effect in a patient with lamivudine-resistant severe hepatitis B reactivation. Gastroenterology. 2003;124:586-587. [PubMed] [DOI] |
| 36. | Ristig MB, Crippin J, Aberg JA, Powderly WG, Lisker-Melman M, Kessels L, Tebas P. Tenofovir disoproxil fumarate therapy for chronic hepatitis B in human immunodeficiency virus/hepatitis B virus-coinfected individuals for whom interferon-alpha and lamivudine therapy have failed. J Infect Dis. 2002;186:1844-1847. [PubMed] [DOI] |
| 37. | Benhamou Y, Tubiana R, Thibault V. Tenofovir disoproxil fumarate in patients with HIV and lamivudine-resistant hepatitis B virus. N Engl J Med. 2003;348:177-178. [PubMed] [DOI] |
| 38. | Dore GJ, Cooper DA, Pozniak AL, DeJesus E, Zhong L, Miller MD, Lu B, Cheng AK. Efficacy of tenofovir disoproxil fumarate in antiretroviral therapy-naive and -experienced patients coinfected with HIV-1 and hepatitis B virus. J Infect Dis. 2004;189:1185-1192. [PubMed] [DOI] |
| 39. | Neff GW, Nery J, Lau DT, O'Brien CB, Duncan R, Shire NJ, Ruiz P, Nery C, Montalbano M, Muslu H. Tenofovir therapy for lamivudine resistance following liver transplantation. Ann Pharmacother. 2004;38:1999-2004. [PubMed] [DOI] |
| 40. | Kuo A, Dienstag JL, Chung RT. Tenofovir disoproxil fumarate for the treatment of lamivudine-resistant hepatitis B. Clin Gastroenterol Hepatol. 2004;2:266-272. [PubMed] [DOI] |
| 41. | Bani-Sadr F, Palmer P, Scieux C, Molina JM. Ninety-six-week efficacy of combination therapy with lamivudine and tenofovir in patients coinfected with HIV-1 and wild-type hepatitis B virus. Clin Infect Dis. 2004;39:1062-1064. [PubMed] [DOI] |
| 42. | Nelson M, Portsmouth S, Stebbing J, Atkins M, Barr A, Matthews G, Pillay D, Fisher M, Bower M, Gazzard B. An open-label study of tenofovir in HIV-1 and Hepatitis B virus co-infected individuals. AIDS. 2003;17:F7-10. [PubMed] [DOI] |
| 43. | Ying C, De Clercq E, Nicholson W, Furman P, Neyts J. Inhibition of the replication of the DNA polymerase M550V mutation variant of human hepatitis B virus by adefovir, tenofovir, L-FMAU, DAPD, penciclovir and lobucavir. J Viral Hepat. 2000;7:161-165. [PubMed] [DOI] |
| 44. | Shirasaka T, Kavlick MF, Ueno T, Gao WY, Kojima E, Alcaide ML, Chokekijchai S, Roy BM, Arnold E, Yarchoan R. Emergence of human immunodeficiency virus type 1 variants with resistance to multiple dideoxynucleosides in patients receiving therapy with dideoxynucleosides. Proc Natl Acad Sci U S A. 1995;92:2398-2402. [PubMed] [DOI] |
| 45. | Margot NA, Isaacson E, McGowan I, Cheng A, Miller MD. Extended treatment with tenofovir disoproxil fumarate in treatment-experienced HIV-1-infected patients: genotypic, phenotypic, and rebound analyses. J Acquir Immune Defic Syndr. 2003;33:15-21. [PubMed] |
| 46. | Margot NA, Isaacson E, McGowan I, Cheng AK, Schooley RT, Miller MD. Genotypic and phenotypic analyses of HIV-1 in antiretroviral-experienced patients treated with tenofovir DF. AIDS. 2002;16:1227-1235. [PubMed] [DOI] |
| 47. | von Wyl V, Yerly S, Böni J, Bürgisser P, Klimkait T, Battegay M, Bernasconi E, Cavassini M, Furrer H, Hirschel B. Factors associated with the emergence of K65R in patients with HIV-1 infection treated with combination antiretroviral therapy containing tenofovir. Clin Infect Dis. 2008;46:1299-1309. [PubMed] [DOI] |
| 48. | Núñez M, Pérez-Olmeda M, Díaz B, Ríos P, González-Lahoz J, Soriano V. Activity of tenofovir on hepatitis B virus replication in HIV-co-infected patients failing or partially responding to lamivudine. AIDS. 2002;16:2352-2354. [PubMed] [DOI] |
| 49. | Bruno R, Sacchi P, Zocchetti C, Ciappina V, Puoti M, Filice G. Rapid hepatitis B virus-DNA decay in co-infected HIV-hepatitis B virus 'e-minus' patients with YMDD mutations after 4 weeks of tenofovir therapy. AIDS. 2003;17:783-784. [PubMed] [DOI] |
| 50. | Lacombe K, Gozlan J, Boelle PY, Serfaty L, Zoulim F, Valleron AJ, Girard PM. Long-term hepatitis B virus dynamics in HIV-hepatitis B virus-co-infected patients treated with tenofovir disoproxil fumarate. AIDS. 2005;19:907-915. [PubMed] [DOI] |
| 51. | Perrillo RP. Acute flares in chronic hepatitis B: the natural and unnatural history of an immunologically mediated liver disease. Gastroenterology. 2001;120:1009-1022. [PubMed] [DOI] |
| 52. | Bonacini M, Kurz A, Locarnini S, Ayres A, Gibbs C. Fulminant hepatitis B due to a lamivudine-resistant mutant of HBV in a patient coinfected with HIV. Gastroenterology. 2002;122:244-245. [PubMed] [DOI] |
| 53. | Bruno R, Sacchi P, Malfitano A, Filice G. YMDD-mutant HBV strain as a cause of liver failure in an HIV-infected patient. Gastroenterology. 2001;121:1027-1028. [PubMed] |
| 54. | Benhamou Y, Fleury H, Trimoulet P, Pellegrin I, Urbinelli R, Katlama C, Rozenbaum W, Le Teuff G, Trylesinski A, Piketty C. Anti-hepatitis B virus efficacy of tenofovir disoproxil fumarate in HIV-infected patients. Hepatology. 2006;43:548-555. [PubMed] [DOI] |
| 55. | Colin JF, Cazals-Hatem D, Loriot MA, Martinot-Peignoux M, Pham BN, Auperin A, Degott C, Benhamou JP, Erlinger S, Valla D. Influence of human immunodeficiency virus infection on chronic hepatitis B in homosexual men. Hepatology. 1999;29:1306-1310. [PubMed] [DOI] |
| 56. | Thio CL, Seaberg EC, Skolasky R, Phair J, Visscher B, Muñoz A, Thomas DL. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet. 2002;360:1921-1926. [PubMed] [DOI] |
| 57. | de Mendoza C, Jiménez-Nacher I, Garrido C, Barreiro P, Poveda E, Corral A, Zahonero N, González-Lahoz J, Soriano V. Changing patterns in HIV reverse transcriptase resistance mutations after availability of tenofovir. Clin Infect Dis. 2008;46:1782-1785. [PubMed] [DOI] |
| 58. | Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1 infected adults and adolescents. Department of Health and Human Services. 2007-12-01, cited 2007-06-02; 1(1): 24 screens. Available from: http: //www.aidsinfo.nih.gov/contentfiles/adultandadolescentgl.pdf. |
| 59. | Johnson VA, Brun-Vézinet F, Clotet B, Günthard HF, Kuritzkes DR, Pillay D, Schapiro JM, Richman DD. Update of the drug resistance mutations in HIV-1: 2007. Top HIV Med. 2007;15:119-125. [PubMed] |
| 60. | DeChristoforo R, Penzak SR. Tenofovir: a nucleotide analogue reverse-transcriptase inhibitor for treatment of HIV infection. Am J Health Syst Pharm. 2004;61:86-98; quiz 99-100. [PubMed] |
| 61. | Gallant JE, Pham PA. Tenofovir disoproxil fumarate (Viread) for the treatment of HIV infection. Expert Rev Anti Infect Ther. 2003;1:415-422. [PubMed] [DOI] |
| 62. | Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, Jeffers L, Goodman Z, Wulfsohn MS, Xiong S. Adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B. N Engl J Med. 2003;348:808-816. [PubMed] [DOI] |
| 63. | Viread [package insert]. Foster City, CA: Gilead Sciences, 2003. |
| 64. | Pham PA, Gallant JE. Tenofovir disoproxil fumarate for the treatment of HIV infection. Expert Opin Drug Metab Toxicol. 2006;2:459-469. [PubMed] [DOI] |
| 65. | van Bömmel F, Wünsche T, Schürmann D, Berg T. Tenofovir treatment in patients with lamivudine-resistant hepatitis B mutants strongly affects viral replication. Hepatology. 2002;36:507-508. [PubMed] [DOI] |
| 66. | Kearney BP, Flaherty JF, Shah J. Tenofovir disoproxil fumarate: clinical pharmacology and pharmacokinetics. Clin Pharmacokinet. 2004;43:595-612. [PubMed] [DOI] |
| 67. | van Bmmel F, de Man RA, Stein K, Hppe D, Petersen J, Buggisch P, Wedemeyer H, Sarrazin C, Trojan J, Bcher W. A multicenter analysis of antiviral response after one year of tenofovir mono-therapy in HBV-monoinfected patients with prior nucleos(t)ide analog experience. J Hepatol. 2008;48:S32. [DOI] |
| 68. | Heathcote J, George J, Gordon S, Bronowicki JP, Sperl J, Williams R, Martin P, Beniowski M, Sorbel J, Anderson J. Tenofovir disoproxil fumarate (TDF) for the treatment of HBeAg positive chronic hepatitis B: week 72 TDF data and week 24 adefovir dipivoxil switch data (study 103). J Hepatol. 2008;48:S32. [DOI] |
| 69. | Marcellin P, Jacobson I, Habersetzer F, Senturk H, Andreone P, Moyes C, Horban A, Teuber G, Sorbel J, Anderson J. Tenofovir disoproxil fumarate (TDF) for the treatment of HBeAg negative chronic hepatitis B: week 72 TDF data and week 24 adefovir dipivoxil switch data (study 102). J Hepatol. 2008;48:S26. [DOI] |
| 70. | Lok AS, Lai CL, Leung N, Yao GB, Cui ZY, Schiff ER, Dienstag JL, Heathcote EJ, Little NR, Griffiths DA. Long-term safety of lamivudine treatment in patients with chronic hepatitis B. Gastroenterology. 2003;125:1714-1722. [PubMed] [DOI] |
| 71. | Sheldon J, Soriano V. Hepatitis B virus escape mutants induced by antiviral therapy. J Antimicrob Chemother. 2008;61:766-768. [PubMed] [DOI] |
| 72. | Leemans WF, Ter Borg MJ, de Man RA. Review article: Success and failure of nucleoside and nucleotide analogues in chronic hepatitis B. Aliment Pharmacol Ther. 2007;26 Suppl 2:171-182. [PubMed] |
| 73. | Papatheodoridis GV, Manolakopoulos S, Dusheiko G, Archimandritis AJ. Therapeutic strategies in the management of patients with chronic hepatitis B virus infection. Lancet Infect Dis. 2008;8:167-178. [PubMed] [DOI] |
| 74. | Fung SK, Lok AS. Update on viral hepatitis in 2004. Curr Opin Gastroenterol. 2005;21:300-307. [PubMed] |
| 75. | Fung SK, Lok AS. Drug insight: Nucleoside and nucleotide analog inhibitors for hepatitis B. Nat Clin Pract Gastroenterol Hepatol. 2004;1:90-97. [PubMed] [DOI] |
| 76. | Lok AS. Hepatitis B infection: pathogenesis and management. J Hepatol. 2000;32 Suppl 1:89-97. [DOI] |
| 77. | Chang MH. Hepatitis B virus infection. Semin Fetal Neonatal Med. 2007;12:160-167. [PubMed] [DOI] |
| 78. | Chae HB, Hann HW. Time for an active antiviral therapy for hepatitis B: An update on the management of hepatitis B virus infection. Ther Clin Risk Manag. 2007;3:605-612. [PubMed] |
| 79. | Lada O, Benhamou Y, Cahour A, Katlama C, Poynard T, Thibault V. In vitro susceptibility of lamivudine-resistant hepatitis B virus to adefovir and tenofovir. Antivir Ther. 2004;9:353-363. [PubMed] |
| 80. | Manns M, Jeffers L, Dalekos G, Berg T, Trepo C, Roberts S, Prieto M, Rizzetto M, Sorbel J, Anderson J. The antiviral response to tenofovir disoproxil fumarate (TDF) is comparable in lamivudine (LAM)-naive and lam-experienced subjects treated for chronic hepatitis B (CHB). J Hepatol. 2008;48:S33. [DOI] |
| 81. | Gane E, Benhamou Y, Gladysz A, Zeuzem S, Germanidis G, Heathcote J, Marcellin P, Sorbel J, K . Borroto-Esoda K, Rousseau F, Snow-Lampart A. Lack of influence of baseline genotype on antiviral response in subjects with chronic hepatitis b infection receiving tenofovir DF 300 mg QD for 1 year. J Hepatol. 2008;48:S256. [DOI] |
| 82. | Lada O, Gervais A, Branger M, Peytavin G, Colin G, Fraqueiro G, Males S, Martinot-Peignoux M, Matheron S, Marcellin P. Low rate of delayed response in lamivudine experienced HIV/HBV coinfected patients treated with tenofovir disoproxil fumarate (TDF). J Hepatol. 2008;48:S259. [DOI] |
| 83. | Berg T, Moller B, Trinh H, Chan S, Marcellin P, Suarez E, Snow-Lampart A, Frederick D, Oldach D, Sorbel J. Tenofovir disoproxil fumarate (TDF) versus emtricitabine plus TDF for treatment of chronic hepatitis B (CHB) in subjects with persistent viral replication receiving adefovir dipivoxil (ADV). J Hepatol. 2008;48:S34. [DOI] |
| 84. | Buti M, Hadziyannis S, Mathurin P, Urbanek P, Sherman M, Strasser S, Wang C, Petersen J, Sorbel J, Mondou E. Tenofovir disoproxil fumarate (TDF) is highly active for treatment of chronic hepatitis B in subjects with cirrhosis. J Hepatol. 2008;48:S33. [DOI] |
| 85. | Antoniou T, Raboud J, Chirhin S, Yoong D, Govan V, Gough K, Rachlis A, Loutfy M. Incidence of and risk factors for tenofovir-induced nephrotoxicity: a retrospective cohort study. HIV Med. 2005;6:284-290. [DOI] |
| 86. | Jones R, Stebbing J, Nelson M, Moyle G, Bower M, Mandalia S, Gazzard B. Renal dysfunction with tenofovir disoproxil fumarate-containing highly active antiretroviral therapy regimens is not observed more frequently: a cohort and case-control study. J Acquir Immune Defic Syndr. 2004;37:1489-1495. [PubMed] [DOI] |
| 87. | Sax PE, Gallant JE, Klotman PE. Renal safety of tenofovir disoproxil fumarate. AIDS Read. 2007;17:90-92, 99-104, C3. [PubMed] |
| 88. | Lacombe K, Boyd A, Bonnard P, Molina JM, Miailhes P, Meynard JL, Taulera L, Rachline A, Cotte L, Trylesinski A. Mdrd creatinine clearance is not altered in HIV-HBV co-infected patients with a normal renal function and treated with tenofovir. J Hepatol. 2008;48:S259. [DOI] |
| 89. | Dakin HA, Foster GR, James ES. Results of a mixed treatment comparison meta-analysis of nucleoside and nucleotide therapies for HBeAg-positive chronic hepatitis B. J Hepatol. 2008;48:S256. [DOI] |
| 90. | Deniz B, Everhard F. Cost-effectiveness simulation analysis of tenofovir disoproxil fumarate (tenofovir) in HbeAg negative (-) patients with chronic hepatitis-B (CHB) in Italy and France. J Hepatol. 2008;48:S210. [DOI] |
| 91. | Deniz B, Buti M, Brosa M, Casado MA, Rueda M, Everhard F, Esteban R. Cost-effectiveness simulation analysis of tenofovir disoproxil fumarate (tenofovir), lamivudine, adefovir dipivoxil (adefovir) and entecavir of HBeAg negative (-) patients with chronic hepatitis-B (CHB) in Spain. J Hepatol. 2008;48:S209. [DOI] |
| 92. | 聂 青和, 李 梦东. 加强病毒性肝炎的基础与临床研究. 胃肠病学和肝病学杂志. 2007;16:95-99. |
| 94. | Degertekin B, Lok AS. Update on viral hepatitis: 2007. Curr Opin Gastroenterol. 2008;24:306-311. [PubMed] [DOI] |
| 95. | Keeffe EB, Dieterich DT, Pawlotsky JM, Benhamou Y. Chronic hepatitis B: preventing, detecting, and managing viral resistance. Clin Gastroenterol Hepatol. 2008;6:268-274. [PubMed] [DOI] |
| 96. | Loomba R, Liang TJ. Treatment of chronic hepatitis B. Antivir Ther. 2007;12 Suppl 3:H33-H41. [PubMed] |
| 97. | Inada M, Yokosuka O. Current antiviral therapies for chronic hepatitis B. Hepatol Res. 2008;38:535-542. [PubMed] [DOI] |
| 98. | Palumbo E. New drugs for chronic hepatitis B: a review. Am J Ther. 2008;15:167-172. [PubMed] [DOI] |
| 99. | Inada M, Yokosuka O. Current antiviral therapies for chronic hepatitis B. Hepatol Res. 2008;38:535-542. |
| 100. | Wong SN, Lok AS. Tenofovir disoproxil fumarate: role in hepatitis B treatment. Hepatology. 2006;44:309-313. [PubMed] [DOI] |
| 101. | van Bömmel F, Zöllner B, Sarrazin C, Spengler U, Hüppe D, Möller B, Feucht HH, Wiedenmann B, Berg T. Tenofovir for patients with lamivudine-resistant hepatitis B virus (HBV) infection and high HBV DNA level during adefovir therapy. Hepatology. 2006;44:318-325. [PubMed] [DOI] |
| 102. | Reijnders JG, Janssen HL. Potency of tenofovir in chronic hepatitis B: mono or combination therapy? J Hepatol. 2008;48:383-386. [PubMed] [DOI] |
| 103. | Balsano C, Alisi A. Viral hepatitis B: established and emerging therapies. Curr Med Chem. 2008;15:930-939. [PubMed] [DOI] |
| 104. | Wong SN, Lok AS. Update on viral hepatitis: 2005. Curr Opin Gastroenterol. 2006;22:241-247. [PubMed] |