修回日期: 2008-07-12
接受日期: 2008-07-14
在线出版日期: 2008-08-18
目的: 探讨肝细胞癌组织中P14ARF、ARF-BP1及c-myc的mRNA表达及其与临床参数关系.
方法: 采用半定量逆转录-聚合酶链式反应(RT-PCR)技术, 对52例HCC组织及其中45例相应癌旁组织P14ARF、ARF-BP1及c-myc的mRNA表达丰度进行检测并分析他们之间的关系及其与临床参数的关系.
结果: 在52例HCC组织中P14ARF、ARF-BP1及c-myc的mRNA各表达77.0%、77.0%和75.0%, 与45例相应癌旁组织(11.1%、20.0%、53.3%)比较, 呈高表达. P14ARF、ARF-BP1 mRNA的表达与肿瘤大小有关(t = 2.169, 2.087, 均P<0.05); 而c-myc mRNA表达与肿瘤大小无关. P14ARF、ARF-BP1及c-myc的mRNA表达在性别、年龄、AFP、临床病理分级、浸润转移、HBV、包膜等无统计学差异. P14ARF与ARF-BP1、P14ARF与c-myc及ARF-BP1与c-myc的mRNA表达两两成正相关(r = 0.565, 0.436, 0.584, 均P<0.01).
结论: P14ARF、ARF-BP1、c-myc过度表达可能是HCC发生的早期指标; ARF-BP1过度表达可能是影响HCC发生、发展的关键, 干预ARF-BP1可能是治疗HCC的新途径.
引文著录: 覃新干, 罗殿中, 吕自力, 林静, 苏传丽. P14ARF、ARF-BP1及c-myc mRNA在肝细胞癌中的表达及临床意义. 世界华人消化杂志 2008; 16(23): 2656-2660
Revised: July 12, 2008
Accepted: July 14, 2008
Published online: August 18, 2008
AIM: To investigate the expression of P14ARF, ARF-BP1 and c-myc mRNAs in hepatocellular carcinoma (HCC) and their clinical significances.
METHODS: Abundance of P14ARF, ARF-BP1 and c-myc mRNAs was detected by semi-quantification reverse transcription polymerase chain reaction (RT-PCR) technique in the samples from 52 HCCs and their 45 non-tumorous liver tissues, and their clinical significances were assayed with the clinical parameters.
RESULTS: The expression levels of P14ARF, ARF-BP1 and c-myc mRNAs (77.0%, 77.0%, 75.0%) were higher in HCC tissues than those in the non-tumorous liver tissues (11.1%, 20.0%, 53.3%), respectively. The expression of P14ARF mRNA and ARF-BP1 mRNAs were related to tumor size (t = 2.169, 2.087; both P < 0.05), but the expression of c-myc mRNA was not. The expression of P14ARF, ARF-BP1 and c-myc mRNAs were not related to the gender, age, AFP level, clinical stageing, HBV infection, envelopes, infiltration and metastasis. There was a positive correlation between P14ARF and ARF-BP1 expression, P14ARF and c-myc expression as well as ARF-BP1 and c-myc expression (r = 0.565, 0.436, 0.584; all P < 0.01).
CONCLUSION: Over-expression of P14ARF, ARF-BP1 and c-myc mRNAs are markers in the early stage of HCC, and ARF-BP1 over-expression play an important role in the genesis and development of HCC. ARF-BP1 may become a novel therapeutic target against HCC.
- Citation: Qin XG, Luo DZ, Lv ZL, Lin J, Su CL. Expression of P14ARF, ARF-BP1 and c-myc mRNAs in hepatocellular carcinoma and their significances. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2656-2660
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2656.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2656
越来越多的研究表明E3泛素连接酶在癌形成过程中扮演着重要的角色[1], ARF-BP1是具有HECT(homologous to E6-AP C terminus)区域的E3泛素连接酶, 与P14ARF、p53、Myc蛋白相互作用[2-3]. P14ARF是p53上游基因, 也是抑癌基因, 通过抑制ARF-BP1功能, 抑制肿瘤的生长[2], 激活的癌基因如Myc、Ras及E1A诱导P14ARF表达[4]. c-myc是细胞原癌基因, 与细胞的增殖、分化、凋亡有关. 在肝细胞癌(hepatocellular carcinoma, HCC)组织中, ARF-BP1是否与P14ARF、c-myc发生相互作用并影响HCC的发生、发展, 目前仍未清楚. 我们采用半定量逆转录-聚合酶链式反应(RT-PCR)方法, 检测52例HCC组织中的P14ARF、ARF-BP1和c-myc mRNA表达水平并分析他们之间的关系及其与临床参数的关系, 探讨三者与HCC发生、发展的关系及其意义.
收集2005-03/2006-04在我院接受手术治疗的52例肝细胞癌患者的癌组织及其中相应的45例癌旁组织, 2例肝血管瘤患者的肝组织, 并收集相关临床资料. 52例HCC患者中, 男性45例, 女性7例, 年龄23-70(平均年龄43.60±10.87)岁. 所有病例均经病理学确诊, 肝癌组织学按WHO 2000年标准分级. 所有标本离体后迅速置入液氮速冻, 然后转-80℃超低温冰箱保存. TRIzol总RNA提取试剂盒(Invitrogen公司)、逆转录试剂盒(Fermentas公司)、PCR试剂Premix Tag(TaKaRa公司)、dNTP(上海生物工程技术有限公司).
1.2.1 总RNA提取: 取50 mg癌组织加入1 mL TRIzol, 按TRIzol总RNA提取试剂盒说明书进行操作, RNA放-80℃保存备用.
1.2.2 RT合成cDNA: 取3 µg RNA, 按逆转录试剂盒说明书进行操作, 产物-20℃保存备用.
1.2.3 PCR引物设计及扩增: 扩增目的基因P14ARF片段引物序列参见文献[5], 经NCBI BLAST软件确认其特异性. 扩增目的基因ARF-BP1、c-myc片段引物序列通过Primer3软件设计获取并经NCBI BLAST软件确认其特异性. 看家基因GAPDH作内对照具体见表1.
| 基因 | 引物 | 产物长度(bp) | 退火温度(℃) | 循环数(个) |
| P14ARF | 上游: 5'-ccctcgtgctgatgctactga-3' | 200 | 60 | 30 |
| 下游: 5'-accaccagcgtgtccaggaa-3' | ||||
| ARF-BP1 | 上游: 5'-ccacctccagcttctacagc-3' | 157 | 57 | 30 |
| 下游: 5'-ttgactgtgttggccatgtt-3' | ||||
| c-myc | 上游: 5'-cctaccctctcaacgacagc-3' | 248 | 55 | 30 |
| 下游: 5'-ctctgaccttttgccaggag-3' | ||||
| GAPDH | 上游: 5'-accacagtccatgccatcact-3' | 452 | 30 | |
| 下游: 5'-tccaccaccctgttgctgta-3' |
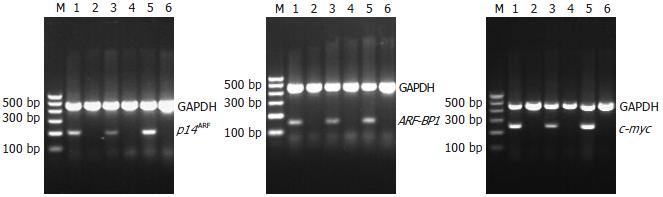
1.2.4 PCR扩增产物的鉴定: 20 g/L琼脂糖凝胶电泳检测扩增片段, 在157 bp处显带者为ARF-BP1 mRNA阳性, 200 bp处显带者为P14ARF mRNA阳性, 248 bp处显带者为c-myc mRNA阳性, 452 bp处显带者为GAPDH mRNA阳性. PCR扩增产物送广西医科大学医学科学实验中心测序鉴定.
1.2.5 目的基因RT-PCR产物半定量分析:P14ARF、ARF-BP1、c-myc、GAPDH RT-PCR产物在20 g/L琼脂糖凝胶上电泳后, 用凝胶电泳成像分析系统(Bio-Rad GeLDOC2000)对P14ARF、ARF-BP1、c-myc进行半定量分析. 用目的基因和看家基因两电泳条带单位面积内的灰度比值来反映目的基因的相对表达水平, 灰度分析采用凝胶电泳成像分析系统中的Quantity One软件分析.
统计学处理 采用SPSS10.0统计软件进行统计, 计量资料采用t检验, 两变量间相关分析采用直线相关和偏相关分析.
RT-PCR产物在20 g/L琼脂糖凝胶上电泳后, 凝胶图像显示: 200 bp处显带为P14ARF mRNA阳性; 157 bp处显带为ARF-BP1 mRNA阳性; 248 bp处显带为c-myc mRNA阳性. 所有条带显示清晰可见, 无杂带, 如图1. 测序结果经blast软件核对与GenBank的P14ARF、ARF-BP1、c-myc mRNA序列呈完全一致性, 未见缺失与突变(图1).
RT-PCR检测52例癌组织, P14ARF、ARF-BP1及c-myc mRNA阳性表达率分别为76.9%(40/52)、76.9%(40/52)、75.0%(39/52), 表达产物经半定量测定并结合临床资料统计分析, P14ARF、ARF-BP1 mRNA表达与肿瘤大小有关, P14ARF mRNA在大肝癌组织中表达明显高于小肝癌(t = 2.169, P = 0.04, P<0.05), ARF-BP1 mRNA在大肝癌组织中表达明显低于小肝癌(t = 2.087, P = 0.04, P<0.05). P14ARF、ARF-BP1 mRNA表达在性别、年龄、AFP、临床分级、浸润转移、HBV、包膜关系中没有统计学差异(P>0.05); c-myc mRNA表达在性别、年龄、肿瘤大小、AFP、临床分级、浸润转移、HBV、包膜关系中均无统计学差异(P>0.05, 表2). 45例癌旁组织中P14ARF、ARF-BP1及c-myc mRNA阳性表达率分别为11.1%(5/45)、20.0%(9/45)、53.3%(24/45), 表达产物经半定量测定并结合临床资料统计分析, 三者mRNA表达与性别、年龄、肿瘤大小、AFP、临床分级、浸润转移、HBV、包膜关系中均无统计学差异(P>0.05). P14ARF、ARF-BP1及c-myc mRNA在癌组织和癌旁组织中的表达有显著差异(P<0.05). 2例肝血管瘤中, P14ARF mRNA、ARF-BP1 mRNA均不表达; c-myc mRNA有1例表达(HBV阳性), 1例不表达.
| 临床参数 | n | P14ARF | n | ARF-BP1 | n | c-myc | |
| 性别 | 男 | 34 | 0.48±0.24 | 36 | 0.58±0.28 | 34 | 0.58±0.27 |
| 女 | 6 | 0.45±0.24 | 4 | 0.62±0.18 | 5 | 0.34±0.24 | |
| 年龄(岁) | ≤40 | 15 | 0.43±0.20 | 15 | 0.52±0.25 | 15 | 0.61±0.28 |
| >40 | 25 | 0.50±0.25 | 25 | 0.63±0.27 | 24 | 0.51±0.27 | |
| 肿瘤大小(cm) | >5 | 28 | 0.53±0.23 | 29 | 0.53±0.22 | 29 | 0.52±0.27 |
| ≤5 | 12 | 0.36±0.22 | 11 | 0.72±0.34 | 10 | 0.65±0.28 | |
| AFP(mg/L) | ≥400 | 19 | 0.52±0.22 | 19 | 0.55±0.22 | 19 | 0.56±0.29 |
| <400 | 21 | 0.44±0.25 | 21 | 0.62±0.31 | 20 | 0.54±0.24 | |
| HCC分级 | 高-中分化 | 26 | 0.49±0.23 | 27 | 0.60±0.28 | 26 | 0.56±0.28 |
| 低分化 | 14 | 0.46±0.25 | 13 | 0.55±0.24 | 13 | 0.54±0.27 | |
| 浸润转移 | 有 | 17 | 0.46±0.23 | 16 | 0.61±0.20 | 15 | 0.47±0.27 |
| 无 | 23 | 0.49±0.24 | 24 | 0.57±0.31 | 24 | 0.60±0.27 | |
| HBV | HBsAg(+) | 31 | 0.48±0.24 | 31 | 0.62±0.28 | 30 | 0.55±0.28 |
| HBsAg(-) | 9 | 0.46±0.23 | 9 | 0.48±0.19 | 9 | 0.56±0.26 | |
| 包膜 | 有 | 26 | 0.52±0.25 | 24 | 0.59±0.27 | 14 | 0.54±0.28 |
| 无 | 14 | 0.40±0.18 | 16 | 0.59±0.28 | 15 | 0.58±0.27 |
RT-PCR方法检测52例癌组织的P14ARF、ARF-BP1及c-myc mRNA表达, 结果P14ARF、ARF-BP1及c-myc mRNA各表达40、40、39例, 表达产物经凝胶电泳成像分析系统测定灰度比值. 灰度比值经相关分析P14ARF与ARF-BP1(r = 0.565, P<0.01)、P14ARF与c-myc(r = 0.436, P<0.01)及ARF-BP1与c-myc(r = 0.584, P<0.01)的mRNA表达两两成正相关; 灰度比值经偏相关分析, 控制c-myc则P14ARF与ARF-BP1不相关(r = 0.069, P>0.05), 控制P14ARF则ARF-BP1与c-myc表达成正相关(r = 0.632, P<0.01), 控制ARF-BP1则P14ARF与c-myc表达成正相关(r = 0.527, P<0.01), 而且ARF-BP1与c-myc相关性强于P14ARF与c-myc.
P14ARF是INK4a/ARF基因编码的两种蛋白(P16INK4a和ARF(P14ARF(人)/p19ARF(鼠))之一, 具有抑癌功能但机制尚未完全清楚. ARF在正常细胞表达很低, 激活的癌基因如Myc、ras及E1A诱导ARF表达[4]. 基因缺失、不恰当甲基化等引发ARF基因表达下调, 导致ARF基因抑癌功能下降或丧失, 如膀胱癌、非小细胞肺癌发生P14ARF基因缺失[6-7]; 在胃癌、结直肠癌中存在P14ARF基因启动子区CpG岛甲基化, 引发该基因表达下调[8-9]. P14ARF在肝细胞癌、宫颈癌有过表达报道[10-11], 本组资料结果与他们相似. ARF-BP1基因位于染色体Xp11.22上, 是近年来新发现的具有HECT区域的E3泛素连接酶, 他在多种人类肿瘤组织中的过表达是肿瘤细胞增殖所必需的[3]. ARF-BP1与ARF相互作用, 与ARF抑癌功能密切相关, ARF抑制ARF-BP1功能进而抑制肿瘤生长[2]. 同时, ARF-BP1与c-Myc的促细胞增殖、生长等作用有关, 抑制ARF-BP1表达则削弱Myc依赖基因的激活并消除Myc诱导细胞增殖功能[2]. c-myc基因属于癌基因[12], 过表达有促进肿瘤发生的作用[12-15]. 本研究结果显示P14ARF、ARF-BP1及c-myc三者mRNA在HCC高表达, P14ARF在小肝癌中表达低于大肝癌(P<0.05), ARF-BP1在小肝癌中表达高于大肝癌(P<0.05), 提示: (1)乙型肝炎病毒感染[16], DNA低甲基化[17-18]等原因引起c-myc过度表达, 促使肝细胞过度增殖、分化、恶性病变. 同时, c-Myc过度表达诱导P14ARF基因过度表达, 从而发挥P14ARF肿瘤抑制作用. (2)P14ARF、ARF-BP1、c-myc三者相互影响, 相互制约. 基于P14ARF mRNA在小肝细胞癌表达低于大肝细胞癌, ARF-BP1 mRNA在小肝细胞癌表达高于大肝细胞癌, c-myc过表达有促进肿瘤发生的作用, 可以推测高表达的P14ARF、ARF-BP1及c-myc mRNA可能是肝细胞过度增殖及恶性变的一个间接指征, 检测这些基因的表达可能为早期发现HCC提供依据.
ARF与ARF-BP1相互作用, 抑制ARF-BP1功能而抑制肿瘤生长[2]; ARF-BP1与c-myc相互作用, 抑制ARF-BP1表达则影响c-Myc蛋白功能, 导致肿瘤细胞增殖抑制并引起细胞周期停滞于G1期[3]. 研究表明过表达的c-Myc蛋白引起ARF表达, 而异常c-Myc蛋白表达又是ARF作用的靶点, 形成ARF与c-Myc蛋白负反馈调控机制, ARF结合c-Myc蛋白并调控他的转录活性功能, 阻止细胞过增殖和转化, 同时抑制c-Myc蛋白诱导的基因表达[19-20]. P14ARF、ARF-BP1、c-myc三者相互影响, 相互制约. 本实验检测结果P14ARF、ARF-BP1及c-myc mRNA在HCC高表达, 通过相关分析发现: P14ARF、ARF-BP1、c-myc的mRNA表达成两两正相关. 偏相关分析发现: 对影响P14ARF、ARF-BP1相关的c-myc进行控制, 则P14ARF与ARF-BP1的mRNA表达不相关(r = 0.069, P>0.05). 同样, 控制P14ARF, ARF-BP1与c-myc的mRNA表达成正相关(r = 0.632, P<0.01); 控制ARF-BP1, P14ARF与c-myc的mRNA表达成正相关(r = 0.527, P<0.01). P14ARF、ARF-BP1、c-myc可能存在如下关系: 各种致癌因素导致原癌基因c-myc激活并过度表达, 引发细胞恶性变, 为了克服这一异常过程诱发机体出现保护性的P14ARF抑癌基因高表达从而使ARF-BP1基因低表达, 进而影响c-Myc蛋白功能, 阻止细胞恶变[21]. 本实验结果ARF-BP1基因却高表达, 打破了c-myc过度表达引起P14ARF高表达使ARF-BP1低表达进而影响c-Myc蛋白功能, 阻止细胞恶变的负反馈调节路径, 导致肝癌的发生、发展, 提示在HCC中ARF-BP1是P14ARF、ARF-BP1及c-myc三者关系的中心环节, ARF-BP1过度表达可能是影响HCC发生、发展的关键, 干预ARF-BP1可能是治疗HCC的新途径, 其机制有待进一步研究.
肝癌是一个多基因参与的疾病, 其发病率和死亡率有逐年升高的趋势, 而疗效仍不佳. 泛素连接酶ARF-BP1与肿瘤的发生发展有密切相关. P14ARF蛋白通过P14ARF-Mdm2-P53的P53途径和非P53途径发挥抑癌作用. 激活的c-myc基因可导致细胞恶性转化. P14ARF与ARF-BP1、 P14ARF与Myc、ARF-BP1与Myc之间存在关系.
有研究表明过表达的c-Myc蛋白引起ARF表达, 而异常c-Myc蛋白表达又是ARF作用的靶点, 形成ARF与c-Myc负反馈调控机制, ARF结合c-Myc并调控c-Myc的转录活性功能, 阻止细胞过增殖和转化, 同时抑制c-Myc蛋白诱导的基因表达. 不管P53状态如何, ARF抑制ARF-BP1泛素连接酶活性, 就抑制肿瘤细胞生长. ARF-BP1通过赖氨酸63连接多聚泛素链, 泛素化Myc. 存在P14ARF-ARF-BP-Myc抑癌途径.
ARF-BP1、c-myc、P14ARF mRNA在肝癌中高表达, 他们之间两两成正相关; ARF-BP1可能是影响P14ARF抑制c-myc的因素.
干预ARF-BP1可能是治疗HCC的新途径.
偏相关分析: 是排除其他变量的干扰之后所测量到的2个变量真正的相关系数, 即偏相关分析是控制"第三者"后所获得的甲乙二者的"净"相关系数.
本研究内容全面, 设计合理, 层次分明, 具有较好的学术价值.
邱宝安, 主任医师, 中国人民解放军海军总医院肝胆外科
编辑: 李军亮 电编:郭海丽
| 1. | Chen C, Matesic LE. The Nedd4-like family of E3 ubiquitin ligases and cancer. Cancer Metastasis Rev. 2007;26:587-604. [PubMed] [DOI] |
| 2. | Chen D, Kon N, Li M, Zhang W, Qin J, Gu W. ARF-BP1/Mule is a critical mediator of the ARF tumor suppressor. Cell. 2005;121:1071-1083. [PubMed] [DOI] |
| 3. | Adhikary S, Marinoni F, Hock A, Hulleman E, Popov N, Beier R, Bernard S, Quarto M, Capra M, Goettig S. The ubiquitin ligase HectH9 regulates transcriptional activation by Myc and is essential for tumor cell proliferation. Cell. 2005;123:409-421. [PubMed] [DOI] |
| 5. | Tannapfel A, Busse C, Geissler F, Witzigmann H, Hauss J, Wittekind C. INK4a-ARF alterations in liver cell adenoma. Gut. 2002;51:253-258. [PubMed] [DOI] |
| 6. | Chang LL, Yeh WT, Yang SY, Wu WJ, Huang CH. Genetic alterations of p16INK4a and P14ARF genes in human bladder cancer. J Urol. 2003;170:595-600. [PubMed] [DOI] |
| 7. | Vonlanthen S, Heighway J, Tschan MP, Borner MM, Altermatt HJ, Kappeler A, Tobler A, Fey MF, Thatcher N, Yarbrough WG. Expression of p16INK4a/p16alpha and p19ARF/p16beta is frequently altered in non-small cell lung cancer and correlates with p53 overexpression. Oncogene. 1998;17:2779-2785. [PubMed] [DOI] |
| 8. | Iida S, Akiyama Y, Nakajima T, Ichikawa W, Nihei Z, Sugihara K, Yuasa Y. Alterations and hypermethylation of the p14(ARF) gene in gastric cancer. Int J Cancer. 2000;87:654-658. [PubMed] [DOI] |
| 9. | Esteller M, Tortola S, Toyota M, Capella G, Peinado MA, Baylin SB, Herman JG. Hypermethylation-associated inactivation of p14(ARF) is independent of p16(INK4a) methylation and p53 mutational status. Cancer Res. 2000;60:129-133. [PubMed] |
| 10. | Tannapfel A, Busse C, Weinans L, Benicke M, Katalinic A, Geissler F, Hauss J, Wittekind C. INK4a-ARF alterations and p53 mutations in hepatocellular carcinomas. Oncogene. 2001;20:7104-7109. [PubMed] [DOI] |
| 11. | Kanao H, Enomoto T, Ueda Y, Fujita M, Nakashima R, Ueno Y, Miyatake T, Yoshizaki T, Buzard GS, Kimura T. Correlation between p14(ARF)/p16(INK4A) expression and HPV infection in uterine cervical cancer. Cancer Lett. 2004;213:31-37. [PubMed] [DOI] |
| 12. | Adams JM, Harris AW, Pinkert CA, Corcoran LM, Alexander WS, Cory S, Palmiter RD, Brinster RL. The c-Myc oncogene driven by immunoglobulin enhancers induces lymphoid malignancy in transgenic mice. Nature. 1985;318:533-538. [PubMed] [DOI] |
| 13. | Felsher DW, Bishop JM. Reversible tumorigenesis by Myc in hematopoietic lineages. Mol Cell. 1999;4:199-207. [PubMed] [DOI] |
| 14. | Shachaf CM, Kopelman AM, Arvanitis C, Karlsson A, Beer S, Mandl S, Bachmann MH, Borowsky AD, Ruebner B, Cardiff RD. Myc inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular cancer. Nature. 2004;431:1112-1117. [PubMed] [DOI] |
| 16. | Wu CG, Salvay DM, Forgues M, Valerie K, Farnsworth J, Markin RS, Wang XW. Distinctive gene expression profiles associated with Hepatitis B virus x protein. Oncogene. 2001;20:3674-3682. [PubMed] [DOI] |
| 17. | 翁 玉蓉, 房 静远, 孙 丹凤, 陈 朝飞, 陆 嵘, 顾 伟齐, 朱 红音. 胃癌组织中肿瘤相关基因甲基化及其表达与叶酸和代谢酶MTHFR基因多态性的关系. 世界华人消化杂志. 2006;14:2192-2198. [DOI] |
| 19. | Qi Y, Gregory MA, Li Z, Brousal JP, West K, Hann SR. p19ARF directly and differentially controls the functions of c-Myc independently of p53. Nature. 2004;431:712-717. [PubMed] [DOI] |
| 20. | Datta A, Nag A, Pan W, Hay N, Gartel AL, Colamonici O, Mori Y, Raychaudhuri P. Myc-ARF (alternate reading frame) interaction inhibits the functions of Myc. J Biol Chem. 2004;279:36698-36707. [PubMed] [DOI] |
| 21. | Chen D, Brooks CL, Gu W. ARF-BP1 as a potential therapeutic target. Br J Cancer. 2006;94:1555-1558. [PubMed] |