修回日期: 2008-07-13
接受日期: 2008-07-14
在线出版日期: 2008-08-18
目的: 研究RASSF1A蛋白和CyclinD1在胃癌及癌前病变组织中的表达及二者的关系.
方法: 收集延安大学附属医院2005-01/2006-10行手术切除的69例胃癌患者临床病理资料和切除标本的组织蜡块. 同时收集慢性浅表性胃炎45例、慢性萎缩性胃炎45例、慢性胃炎伴肠化生45例及慢性胃炎伴不典型增生57例胃黏膜组织蜡块. 采用免疫组化SP法检测胃癌及癌前病变胃黏膜组织中RASSF1A蛋白和CyclinD1的表达.
结果: 胃癌组织中RASSF1A表达的阳性率低于其在慢性浅表性胃炎胃黏膜组织中的阳性表达率(χ2 = 10.4, P<0.05); RASSF1A蛋白的在胃癌癌前病变黏膜中阳性率表达逐渐降低(χ2 = 28.7, P<0.05), 并且与胃癌组织分化程度有关(P<0.05). 胃癌组织中CyclinD1表达的阳性率为84.1%, 慢性浅表性胃炎黏膜组织中的几乎不表达; CyclinD1在胃癌癌前病变黏膜中阳性率表达逐渐升高(χ2 = 11.9, P<0.05); 胃癌组与其他各组之间阳性率比较均存在显著性差异(χ2 = 22.0, 19.6, 29.4, P<0.01); RASSF1A蛋白和CyclinD1蛋白在胃癌中阳性表达率二者呈负相关(rs = -0.323, P<0.05).
结论: 胃黏膜在从慢性浅表性胃炎→慢性萎缩性胃炎→肠化生→不典型增生→胃癌这一演化模式过程中, RASSF1A蛋白表达减弱, CyclinD1蛋白表达增强; 二者的联合检测, 对研究胃癌发生发展机制有一定科学意义.
引文著录: 陈雅慧, 兰忠平, 惠起源, 李宝莉, 杨彦玲. RASSF1A与CyclinD1在胃黏膜病变组织中表达及二者的关系. 世界华人消化杂志 2008; 16(23): 2604-2609
Revised: July 13, 2008
Accepted: July 14, 2008
Published online: August 18, 2008
AIM: To investigate the expression of Ras association domain family 1A gene (RASSF1A) and CyclinD1 as well as their correlations in gastric mucosal lesions.
METHODS: We detected the expression of RASSF1A and CyclinD1 in tissue specimens of gastric cancer (n = 69), chronic superficial gastritis (n = 45), chronic atrophic gastritis (n = 45), chronic gastritis accompanied with intestinal metaplasia (n = 45) and chronic gastritis accompanied with atypical hyperplasia (n = 47) using SP immunohistochemistry.
RESULTS: The positive rate of RASSF1A expression was significantly lower in gastric carcinoma than that in chronic superficial gastritis (χ2 = 10.4, P < 0.05); In the mucosa of precancerous lesions, the expression of RASSF1A protein was decreased gradually (χ2 = 28.7, P < 0.05), and obviously correlated with the degrees of tumor differentiation (P < 0.05). CyclinD1 protein was hardly expressed in chronic superficial gastritis, but its expression was significantly elevated in gastric cancer (84.1%). The expression of CyclinD1 was increased gradually in the mucosa of precancerous lesions (χ2 = 11.9, P < 0.05), and it was markedly higher in gastric carcinoma than that in the other lesions (χ2 = 22.0, 19.6, 29.4; all P < 0.01). There was a negative correlation between the expression of RASSF1A and CyclinD1 protein in gastric carcinoma (rs = -0.323, P < 0.05).
CONCLUSION: RASSF1A expression is down-regulated while CyclinD1 expression is up-regulated in gastric mucosa during the evolution process of chronic superficial gastritis→chronic atrophic gastritis→intestinal metaplasia→gastric dysplasia→gastric carcinoma. Combined detection of the two markers may help to study the mechanism of gastric cancer pathogenesis and development.
- Citation: Chen YH, Lan ZP, Hui QY, Li BL, Yang YL. Expression of RASSF1A and CyclinD1 in gastric mucosal lesions and their correlations. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2604-2609
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2604.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2604
Ras相关区域家族1A(Ras association domain family 1A gene, RASSF1A)是新近发现的候选抑癌基因, 他的表达与肿瘤的发生、发展和预后有密切的关系; 同时, 其与细胞周期素D1蛋白的相关性也日益受到广大学者的关注; 为此, 我们检测胃癌及癌前病变胃黏膜组织中RASSF1A与CyclinD1的蛋白表达, 分析RASSF1A与CyclinD1在胃癌发生、发展中的作用及其两种基因的相关性.
收集延安大学附属医院2005-01/2006-10行手术切除的69例胃癌患者的临床病理资料和切除标本的组织蜡块, 所有病例系首次确诊未进行放疗和化疗, 手术后均经病理证实. 其中高分化腺癌13例; 中分化腺癌25例; 低分化腺癌31例; 同时收集慢性浅表性胃炎(chronic superficial gastritis, CSG)45例、慢性萎缩性胃炎(chronic atrophic gastritis, CAG)45例、慢性胃炎伴肠化生(imtesnal metaplasisa, IM)45例及慢性胃炎伴不典型增生(gastric dysplasia, DYS)57例胃黏膜组织蜡块. RASSF1A鼠抗人mAb(ab23950)购自英国abcam公司, Cyclind1兔抗人抗体(RMA-0541)购自福州迈新生物技术开发公司, 免疫组化S-P试剂盒(SP-9002)购自北京中杉金桥生物技术有限公司, 显微图像分析系统购于北京泰克仪器有限公司.
免疫组化染色采用S-P法, 阴性对照用PBS液代替一抗作为空白对照, 阳性对照用预实验已知的阳性为对照片. RASSF1A阳性表达在细胞质出现棕黄色. CyclinD1阳性表达主要在细胞核, 少量组织有胞质同时非特异性着色. 表达强度判定标准如下: 每张切片随机取10个高倍视野, 每个视野计100个细胞中的阳性细胞数, 取均值, 以百分数表示阳性指数, 结果进行半定量分析. 对阳性评分(0%-10%为0分, 11%-25%为1分, 26%-50%为2分, 51%-75%为3分, 76%-100%为4分); 同时对染色强度进行评分(不着色为0, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分). 结果取两者相加之和, 0-1分(-), 2-3分(±), 4-5分为(+), 6-7分为(++). 将(-)和(±)定为阴性, (+) 和(++)定为阳性. 用显微图像分析系统测定每张阳性片的染色平均光密度来半定量表达, 即在每张切片随机选5个视野(400×), 测量每张切片抗原阳性表达产物的平均光密度值, 并分别取其平均值, 最后计算出来平均光密度反映该切片的表达强度.
统计学处理 百分率的检验采用χ2检验及Fisher精确概率法, 各组染色光密度值采用t检验, 相关性分析采用Spearmam等级相关分析, 所有数据都使用统计学软件SPSS11.5进行处理, P<0.05有统计学意义.
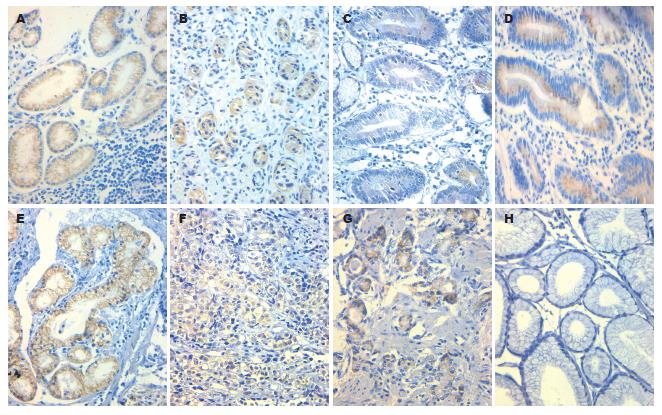
RASSF1A蛋白在胃黏膜中主要表达于腺上皮细胞胞质着色中, 表现为棕黄色颗粒, 颗粒粗大不规则(图1). 在慢性浅表性胃炎中RASSF1A表达最强, 表达率为86.7%(39/45); RASSF1A在胃癌组织中阳性表达率为56.5%(39/69), 二者阳性率比较有显著性差异(χ2 = 10.4, P<0.05). RASSF1A在其他胃黏膜病变中表达率见表1, 阳性表达率随着胃黏膜病变程度加重而逐渐降低, 各组阳性率经趋势检验有显著性意义(χ2 = 28.7, P<0.05); 慢性萎缩性胃炎组、肠上皮化生组和不典型增生组分别与胃癌组织比较, 阳性率无显著性意义(χ2 = 2.84; 1.45; 1.49; P>0.05).
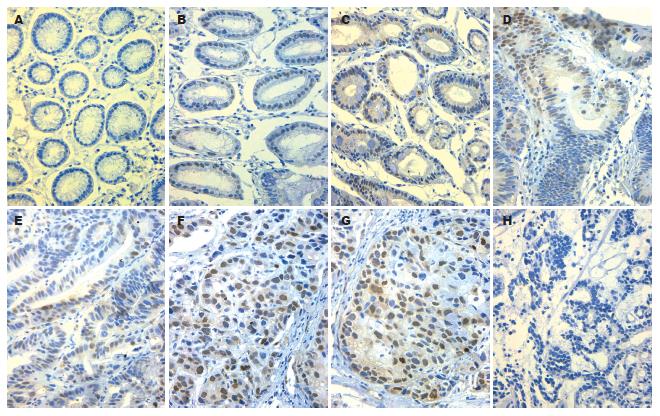
CyclinD1阳性染色位于细胞核, 表现为棕黄色颗粒, 有时伴细胞质的非特异性染色(图2). 在胃黏膜从慢性浅表性胃炎→慢性萎缩性胃炎→肠化生→非典型性增生→胃癌这一演化模式过程中, 细胞核的染色逐渐增加, 随着胃癌的恶性程度的增加, 癌细胞核的阳性染色也逐渐加深(图 2); CyclinD1蛋白在各种黏膜中表达的阳性率如表1, 经趋势检验, 各组CyclinD1蛋白阳性表达率有增高趋势(χ2 = 11.9, P<0.05). CyclinD1在慢性浅表性胃炎和慢性萎缩性胃炎之间及慢性萎缩性胃炎与不典型增生之间的表达差异无显著性(P>0.05); 但胃癌与其他各组之间均存在显著性差异(χ2 = 22.0; 19.6; 29.4; P<0.05).
用显微图像分析系统测量RASSF1A蛋白和CyclinD1在各种黏膜中的表达强度进行定量分析, 用均数和标准误表示结果, 各组染色平均光密度统计结果见表2. 在慢性浅表性胃黏膜RASSF1A蛋白表达的平均光密度是0.219±0.070; 在胃癌组RASSF1A蛋白表达的平均光密度是0.102±0.030; 二者经t检验平均光密度有显著性意义(F = 25.61, P<0.05). RASSF1A在不同胃黏膜病变中表达的平均光密度值, 从慢性浅表性胃炎→慢性萎缩性胃炎→肠化生→不典型增生→胃癌是逐渐减弱的见表2, 各组之间平均光密度均值比较有显著性差异(F = 12.57, P<0.05). CyclinD1在胃黏膜病变中从慢性浅表性胃炎→慢性萎缩性胃炎→肠化生→不典型增生→胃癌表达的平均光密度是逐渐增强的见表2, 各组之间平均光密度均值比较有显著性差异(F = 10.24, P<0.05); 胃癌组与其他各组之间平均光密度均值比较有显著性意义(F = 13.24, 12.57, 5.56, P<0.05).
RASSF1A蛋白阳性表达与癌组织分化程度有关, 低分化组与高、中分化组相比较有显著性意义(χ2 = 9.84, 8.74, P<0.05); CyclinD1蛋白的阳性表达与癌组织分化程度无关, 低分化组与高、中分化组相比较无显著性意义(P> 0.05, 表3). 用显微图像分析系统测量RASSF1A蛋白和CyclinD1蛋白在不同分化程度胃癌组织中的表达强度进行定量分析, 用均数和标准误表示结果, 各分化组染色平均光密度统计结果见表3. RASSF1A蛋白在高、中及低分化胃癌中平均光密度逐渐降低, 低分化组与高、中分化组相比较有显著性意义(F = 6.382, 4.868, P<0.05). CyclinD1蛋白表达在高、中及低分化胃癌中平均光密度逐渐升高, 低分化组与高、中分化组相比较无显著性意义(F = 0.039, 0.046, P>0.05).
RASSF1A蛋白与CyclinD1蛋白在胃癌组织中表达关系统计结果, 二者表达都为阳性26例, 都为阴性5例; 经Spearmam相关性检验二者呈负相关(rs = -0.323, P<0.05).
RASSF1A是Dammann et al[1]2000年克隆出的候选抑癌基因, 在肺和乳腺的正常组织中均有表达, 但在肺癌和乳腺癌的细胞株和术后标本中有着很高的缺失率和甲基化. 其cDNA序列中含有6个外显子, 共1873 bp核苷酸, 编码由340个氨基酸组成, 分子质量为38.8 kDa的蛋白质. 目前认为, RASSF1A蛋白可能是一种参与细胞周期调控的重要抑制蛋白, 其通过多种途径抑制细胞生长、促进细胞凋亡和衰老. RASSF1A蛋白表达缺失或降低可导致肿瘤的发生. 目前其作用机制还不十分清楚. 可能通过以下机制发挥作用: (1)RASSF1A作为Ras蛋白的效应器与凋亡前激酶MTS1结合促进细胞凋亡[2]; (2)RASSF1A可能通过与微管结合中心体和纺锤体的功能, 进而调节微管的稳定性, RASSF1A还能与CDC20结合抑制后期促进联合体(APC)来调节有丝分裂的进展[3]; (3)RASSF1A可以抑制CyclinD1的积聚, 使细胞周期停滞在G1/S期[4].
研究表明, RASSF1A蛋白在几乎所有正常组织呈高表达, 而在肺癌、乳腺癌、卵巢癌、食管癌, 鼻咽癌、肝癌、胃癌、肾癌和头颈部肿瘤组织中呈低表达或缺失, 且其蛋白表达的阳性率与这些肿瘤的恶性程度、淋巴转移及临床分期均呈负相关[2,5-8]. 本实验发现RASSF1A蛋白在胃癌组织中表达阳性率56.8%, 较其他胃黏膜组织表达低; 同时胃黏膜从慢性浅表性胃炎→慢性萎缩性胃炎→肠化生→不典型增生→胃癌这一演化模式过程中, RASSF1A蛋白的表达逐渐降低; RASSF1A蛋白的阳性表达率与胃癌组织分化程度有统计学意义, 此结果与国内外文献[6,9-10]报道相似, 这说明在胃癌发生发展过程中有RASSF1A基因缺失或改变, 应用免疫组化技术测定胃癌中RASSF1A蛋白的表达情况, 可对判断肿瘤的恶性程度及淋巴转移具有重要的参考价值.
细胞周期素D1为细胞周期相关癌基因, 可激活CDK4/6的蛋白激酶活性, 促使细胞从G1期顺利进入S期, 完成DNA复制. 细胞周期素D1的过渡表达可使细胞持续增值, 从而导致细胞失控性生长[11]. 在乳腺癌、食道癌、肺癌, 胃癌及肝癌等多种肿瘤组织中都存在CyclinD1基因扩增及蛋白过渡表达[12-13]. 本实验结果显示CyclinD1在胃癌中阳性率为84.1%, 显著高于其他胃黏膜病变组织(P<0.05), 但与肿瘤分化程度无关, 这提示CyclinD1表达异常可能是胃癌发生发展过程中早期的分子事件. 目前认为, CyclinD1基因扩增与CyclinD1蛋白表达间有分离现象[14]. 仅仅CyclinD1的过表达还不足引起多数细胞发生转化, 需要其他的肿瘤原癌基因或抑癌基因连续协同作用. 可见CyclinD1并不是转化的唯一因子, 但他是维持转化细胞所必需.
RASSF1A在体内和体外均抑制人类肿瘤细胞的生长, 提示该基因为肿瘤抑制基因[15], 具有多种功能, 涉及信号转导、生长调节通路和细胞增殖、完整及凋亡的调节. 本研究发现RASSF1A蛋白和CyclinD1蛋白在胃癌中阳性表达率二者呈负相关, 这提示RASSF1A表达的降低和CyclinD1表达的升高, 这两基因表达的变化发生在胃癌的发生发展期. Shivakumar et al[4]将RASSF1A瞬时转染人不表达该基因的肺腺癌细胞株H1299后发现, 细胞周期被阻断在G1/S期. 认为RASSF1A从翻译水平上抑制了CyclinD1的聚集即阻断了CyclinD1介导的细胞增殖旁路, 从而阻止了细胞从G1向S期转变, 但CyclinD1或其下游的G1/S期跃迁因子(如细胞周期蛋白A或E7)的表达增多抑制RASSF1A诱导的细胞周期停滞. 然而, 胃癌的发生是多基因参与, 多步骤发展的过程, CyclinD1的表达也是多因素影响的结果, 而且在胃癌发生过程中CyclinD1基因变异; 各种影响因素的总和, 在整个肿瘤细胞生长增殖调控网络中, RASSF1A基因对CyclinD1表达的影响大小及其作用机制未完全阐明, 还有待于通过其他更敏感的实验方法的证实.
胃癌是发病率较高的恶性肿瘤之一, 他的发生发展是一个多基因多因素共同作用的复杂过程. 本文通过探讨研究RASSF1A蛋白和CyclinD1蛋白在胃癌及癌前病变组织中的表达及二者的关系, 为研究胃癌发生发展机制提供一定科学依据.
汪思应, 教授, 安徽医科大学实验动物中心; 戴冬秋, 教授, 中国医科大学附属第一医院肿瘤外科
目前关于胃癌及癌前病变的发展变化备受关注, 也是胃癌研究领域的热点, 有关二者具体发展机制有待于进一步阐明.
国内外许多研究发现RASSF1A和CyclinD1的异常表达与胃癌的发生发展密切相关, 此二者基因的检测有助于为胃癌及癌前病变的发生发展提供科学意义.
本文比较系统阐释了RASSF1A蛋白和CyclinD1蛋白在胃癌及癌前病变组织中的表达, 并分析了二者的相关性, 为胃癌及癌前病变二者具体发展机制提供一定科学依据.
RASSF1A和CyclinD1在胃癌及癌前病变的异常表达, 可以较准确为胃癌发生发展机制提供生物学依据; 并且为胃癌临床基因治疗提供新的治疗思路.
本文选题有一定的使用价值, 研究方法内容较新颖, 但文章总体水平一般.
编辑: 李军亮 电编:何基才
| 1. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319x. [PubMed] |
| 2. | Agathanggelou A, Honorio S, Macartney DP, Martinez A, Dallol A, Rader J, Fullwood P, Chauhan A, Walker R, Shaw JA. Methylation associated inactivation of RASSF1A from region 3p21.3 in lung, breast and ovarian tumours. Oncogene. 2001;20:1509-1518. [PubMed] [DOI] |
| 3. | Song MS, Song SJ, Ayad NG, Chang JS, Lee JH, Hong HK, Lee H, Choi N, Kim J, Kim H. The tumour suppressor RASSF1A regulates mitosis by inhibiting the APC-Cdc20 complex. Nat Cell Biol. 2004;6:129-137. [PubMed] [DOI] |
| 4. | Shivakumar L, Minna J, Sakamaki T, Pestell R, White MA. The RASSF1A tumor suppressor blocks cell cycle progression and inhibits cyclin D1 accumulation. Mol Cell Biol. 2002;22:4309-4318. [PubMed] [DOI] |
| 5. | Lo PH, Xie D, Chan KC, Xu FP, Kuzmin I, Lerman MI, Law S, Chua D, Sham J, Lung ML. Reduced expression of RASSF1A in esophageal and nasopharyngeal carcinomas significantly correlates with tumor stage. Cancer Lett. 2007;257:199-205. [PubMed] [DOI] |
| 6. | Byun DS, Lee MG, Chae KS, Ryu BG, Chi SG. Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma. Cancer Res. 2001;61:7034-7038. [PubMed] |
| 7. | Hogg RP, Honorio S, Martinez A, Agathanggelou A, Dallol A, Fullwood P, Weichselbaum R, Kuo MJ, Maher ER, Latif F. Frequent 3p allele loss and epigenetic inactivation of the RASSF1A tumour suppressor gene from region 3p21.3 in head and neck squamous cell carcinoma. Eur J Cancer. 2002;38:1585-1592. [PubMed] [DOI] |
| 8. | Li Y, Wei Q, Cao F, Cao X. Expression and promoter methylation of the RASSF1A gene in sporadic breast cancers in Chinese women. Oncol Rep. 2008;19:1149-1153. [PubMed] |
| 10. | Kang GH, Lee S, Kim JS, Jung HY. Profile of aberrant CpG island methylation along the multistep pathway of gastric carcinogenesis. Lab Invest. 2003;83:635-641. [PubMed] |
| 11. | Youssef EM, Hasuma T, Morishima Y, Takada N, Osugi H, Higashino M, Otani S, Fukushima S. Overexpression of cyclin D1 in rat esophageal carcinogenesis model. Jpn J Cancer Res. 1997;88:18-25. [PubMed] |
| 12. | Donnellan R, Chetty R. Cyclin D1 and human neoplasia. Mol Pathol. 1998;51:1-7. [PubMed] |
| 13. | Mate JL, Ariza A, Aracil C, López D, Isamat M, Pérez-Piteira J, Navas-Palacios JJ. Cyclin D1 overexpression in non-small cell lung carcinoma: correlation with Ki67 labelling index and poor cytoplasmic differentiation. J Pathol. 1996;180:395-399. [PubMed] [DOI] |
| 14. | Bartkova J, Lukas J, Müller H, Lützhøft D, Strauss M, Bartek J. Cyclin D1 protein expression and function in human breast cancer. Int J Cancer. 1994;57:353-361. [PubMed] [DOI] |
| 15. | Burbee DG, Forgacs E, Z汁chbauer-Müller S, Shivakumar L, Fong K, Gao B, Randle D, Kondo M, Virmani A, Bader S. Epigenetic inactivation of RASSF1A in lung and breast cancers and malignant phenotype suppression. J Natl Cancer Inst. 2001;93:691-699. [PubMed] [DOI] |