修回日期: 2008-06-05
接受日期: 2008-06-12
在线出版日期: 2008-08-08
目的: 在基因水平上观察BMP2在肝组织的表达和肝再生过程中的动态变化特征, 并结合NF-κB在肝再生过程中的表达变化特征, 探讨BMP2对肝再生的影响.
方法: 健康成年♂Wistar大鼠54只, 随机分为3组: 正常对照(NC)组, 即0 h组(n = 6), 假手术(SO)组(n = 24), 肝部分切除术(PH)组(n = 24). 采用原位杂交和免疫组化的方法分别测定大鼠再生肝脏组织中BMP2 mRNA和NF-κB的表达.
结果: BMP2 mRNA表达在SO组与PH组6、12、24 h时间点组间存在统计学差异(灰度值: 99.74±6.85 vs 114.41±5.12, 130.59±6.74, 113.74±7.32, 均P<0.05). SO组与NC组无统计学意义. NC组肝组织内NF-κB阴性, SO组术后各时相点未见特异性染色. PH组NF-κB最初少量弱阳性表达, 术后6、12、24 h, NF-κB表达逐步增强, 灰度值降低(96.22±3.12, 89.59±3.24, 83.72±4.32), 有统计学差异(P<0.05).
结论: BMP2在正常大鼠肝组织中有表达且在肝再生过程中BMP2表达呈现先减弱后增强的趋势. NF-κB在正常大鼠肝脏组织中无表达, 在肝再生过程中NF-κB表达逐渐增强. BMP2可能抑制肝再生.
引文著录: 冀文敏, 许翠萍. BMP2 mRNA在大鼠再生肝组织的表达与意义. 世界华人消化杂志 2008; 16(22): 2453-2457
Revised: June 5, 2008
Accepted: June 12, 2008
Published online: August 8, 2008
AIM: To analyze the dynamic changes of BMP2 mRNA in liver regeneration process, and to investigate the effect of BMP2 mRNA on liver regeneration in combination with the characteristics of nuclear factor kappa B (NF-κB) expression.
METHODS: Fifty-four healthy adult male Wister rats were randomly divided into 3 groups: normal control group (NC, n = 6), sham operation group (SO, n = 24), partial hepatectomy group (PH, n = 24). Using in situ hybridization and immunohistochemistry method, we measured the expression of BMP2 mRNA and NF-κB in regenerated liver tissue, separately.
RESULTS: BMP2 mRNA was significantly different between the SO and PH group at 6, 12 and 24 (gray values: 99.74 ± 6.85 vs 114.41 ± 5.12, 130.59 ± 6.74, 113.74 ± 7.32; all P < 0.05). There was no significance between the SO group and NC group. NF-κB was negative in the NC group, and there was no specific staining at various postoperative time points in the SO group. NF-κB was weakly positive at the initial stage in the PH group, and it was increased at 6, 12 and 24 h (gray values: 96.22 ± 3.12, 89.59 ± 3.24, 83.72 ± 4.32) (P < 0.05).
CONCLUSION: BMP2 is expressed in normal liver tissue of rats, and it displays a trend of increase after an initial decrease in hepatic regeneration. NF-κB is not expressed in normal liver tissue, but its expression gradually increases in the process of liver regeneration. Therefore, BMP2 may inhibit liver regeneration.
- Citation: Ji WM, Xu CP. Expression of BMP2 mRNA in regenerated liver tissue of rats and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(22): 2453-2457
- URL: https://www.wjgnet.com/1009-3079/full/v16/i22/2453.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i22.2453
骨形态发生蛋白(bone morphogenetic proteins, BMPs)又名成骨蛋白(osteogenic proteins, OPs), 属于转化生长因子β(transforming growth factor-β, TGF-β)超家族. BMPs可调节细胞增殖、分化、凋亡, 还对组织器官的形态发生, 维持起重要作用. BMPs除参与骨组织再生外, 还参与其他组织包括肝组织在内的发育与生长过程[1-2]. 因肝脏类似于骨组织也具有强大再生能力, BMPs很有可能对肝脏发挥类似对骨组织的作用. Xu et al[3]已用免疫组织化学方法在蛋白水平上初步证明BMP2在肝组织中有表达, 并且与肝再生有一定的关系, 但还需要进一步研究.
核因子-κB(NF-κB)是一类主要参与炎性分子表达调控的转录因子[4], 可被多种炎症刺激物激活[5]. 然后与靶基因启动子或增强子上的κB位点结合, 从而启动或增强这些基因的转录[6], 进而参与组织的损伤过程[7]. 2005年, Yang et al[8]提出经过70%门静脉分支结扎, 在肝脏中DNA结合NF-κB的活性部位大大增加, 在肝再生和凋亡中NF-κB起着重要作用. 以上研究结论说明NF-κB促进肝脏的再生. 本文旨在探讨BMP2与NF-κB对肝再生调控的联系及意义.
BMP2原位杂交试剂盒购于武汉博士德公司. NF-κB鼠单克隆抗体、山羊血浆封闭液、生物素羊抗鼠抗体购于Santa Crue试剂公司.
1.2.1 肝再生模型的建立: 健康♂Wistar大鼠54只, 体质量180-220 g. 随机分为3组. 正常对照(NC)组即0 h组6只, 不施加任何处理因素; 假手术(SO)组24只. 于腹部正中施加3 cm切口暴露腹腔, 摆动肝脏左叶与中叶, 关闭腹腔; 肝部分切除术(PH)组24只. 依据Higgins创建的经典方法, 腹部正中切口进入腹腔, 轻轻挤出肝脏的左叶和中叶于肝蒂部结扎, 于结扎点远端切除肝脏的左叶和中叶(切除量约占全肝的68%-70%), 关闭腹腔.
1.2.2 标本处理: 分别予SO和PH术后0, 6, 12, 24, 48 h各时间点采用100 g/L戊巴比妥钠(30 mg/kg)ip麻醉动物, 并开腹取出动物肝右叶(每组于各个时间点分别处理6只动物). 取肝右叶部分组织以40 g/L多聚甲醛/0.1 mol/L PBS(pH7.0-7.6)固定1 h, 常规脱水、浸蜡、包埋, 6 μm切片, 供原位杂交方法检测用. 和取肝右叶取部分组织以40 g/L中性甲醛固定, 石蜡包埋, 4 μm切片, 供NF-κB免疫组织化学检测.
1.2.3 原位杂交: 石蜡切片常规脱蜡至水, 30 mL/L H2O2室温10 min, 滴加30 g/L柠檬酸稀释的胃蛋白酶, 37℃消化10 min, 10 g/L多聚甲醛/0.1 mol/L PBS(pH7.0-7.6), 室温10 min, 加预杂交液, 39℃放置4 h, 加杂交液, 39℃过夜. 37 ℃ 2×SSC, 0.5×SSC, 0.2×SSC充分梯度洗涤, 加封闭液37℃ 30 min. 加生物素化鼠抗地高辛37℃ 60 min. 加SABC 37℃ 30 min. 加生物素化过氧化物酶37℃ 30 min. PBS洗3 min 3次. DAB显色. 苏木素复染, 水洗. 酒精脱水. 二甲苯透明, 封片. 杂交前各步严防RNase污染.
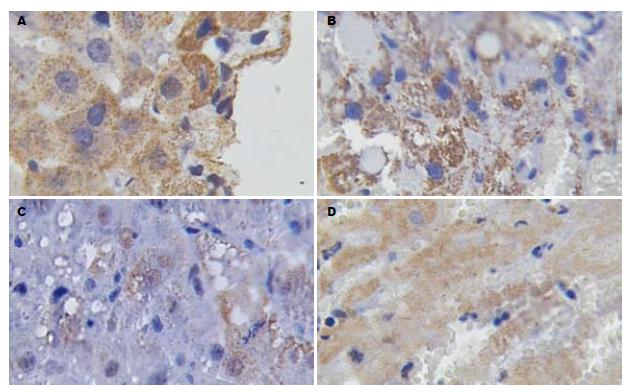
同时设置空白对照(以PBS代替杂交液与预杂交液)、阳性对照(用己知有BMP2表达的颌骨牙骨质化纤维瘤中组织石蜡切片). 阳性标准为胞质或核周或胞外基质中有棕黄色颗粒状染色, 阴性标准为胞质或核周或胞外基质中均无棕黄色颗粒状染色.
1.2.4 SABC免疫组化: 石蜡切片常规脱蜡至水, 15 mL/L H2O2室温10 min, 10 mmol/L枸橼酸盐缓冲液(pH6.0)煮沸10 min, 滴加正常山羊血浆封闭液, 室温20 min. 滴加鼠抗NF-κB mAb(1:50), 4℃孵育过夜, 滴加生物素羊抗鼠抗体, 室温30 min, 滴加预先混合的SABC复合物, 室温30 min, DAB显色. 苏木素复染, 水洗. 酒精脱水. 二甲苯透明, 封片.
同时设置空白对照(以PBS代替第一抗体与第二抗体)、阳性对照(用己知有NF-κB表达的溃疡性结肠炎大鼠模型小肠组织石蜡切片). 阳性标准为胞质或核周或核内中有棕黄色颗粒状染色, 阴性标准为胞质或核周或核内中均无棕黄色颗粒状染色.
1.2.5 对原位杂交: 免疫组化的片子进行图像灰度分析, 每张片子测3个视野取平均值.
统计学处理 使用SPSS13.0统计软件, 数值以mean±SD表示, 单因素方差分析, P<0.05有统计学意义.
对于实验动物NC组肝脏组织中BMP2 mRNA在门静脉, 中央静脉, 汇管区的表达量较多(99.74±6.85), 细胞质中表达棕黄色颗粒. PH组术后BMP2 mRNA表达逐渐减少, 6 h为(114.41±5.12), 并在12 h时减少到最低(130.59±6.74). 随后BMP2 mRNA表达逐渐增多, 并在48 h表达量接近于NC组(96.16±6.52). SO组(99.74±6.85)与PH组6, 12, 24 h时间点组间存在统计学差异. SO组与NC组无统计学意义(图1-2)(BMP mRNA表达量越多灰度值越低).
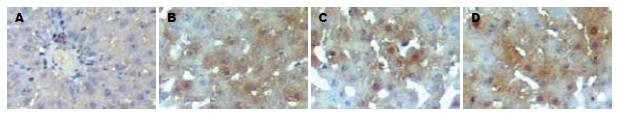
正常NC组肝组织内NF-κB阴性(99.74±3.85), 汇管区的棕色部位为非特异性着色. SO组(101.08±5.10)术后各时相点未见特异性染色. PH组NF-κB最初少量弱阳性表达于术后6 h(96.22±3.12)肝细胞质与肝细胞核; 12 h NF-κB表达增强(89.59±3.24), 主要出现在肝细胞质, 少数呈弱阳性表达分布于肝细胞核; 24 h NF-κB表达(83.72±4.32)进一步增强, 仍主要出现在肝细胞质, 少数呈弱阳性表达分布于肝细胞核; 48 h NF-κB多表达于肝细胞核且强度增加(77.18±3.52), 仍可见少量肝细胞核有NF-κB表达, 呈散在或小片状分布(图3) (蛋白表达量越多灰度值越低).
大鼠肝脏PH后12 h内NF-κB动态变化与BMP2动态变化经Pearson直线相关分析, r = -0.860(P<0.05)呈负相关. PH后12 h到48 h内NF-κB动态变化与BMP2动态变化经Pearson直线相关分析, r = 0.821(P<0.05)呈正相关.
本实验使用原位杂交的方法从基因水平进一步证实了BMP2 mRNA在肝再生过程中的变化情况. 对于实验动物肝脏再生过程中BMP2半定量检测结果是PH组BMP2 mRNA表达逐渐减少, 并在12 h后减少到最低. 随后BMP2 mRNA表达逐渐增多, 并在48 h表达量接近于NC组. SO组与PH组存在统计学差异. SO组与NC组无统计学意义. 与前期[3]的研究结果相一致. 再次提示BMP2信号负性调节肝细胞增殖.
实验PH后6 h残余肝组织可见NF-κB的表达及少量核移位的出现, 与细胞质中BMP2 mRNA表达水平下降的时间点一致; 12 h NF-κB表达增强, 主要出现在肝细胞质, 少数呈弱阳性表达分布于肝细胞核. 而12 h细胞质中BMP2 mRNA的表达呈现最低; 24 h NF-κB表达进一步增强, 仍主要出现在肝细胞质, 少数呈弱阳性表达分布于肝细胞核. 24 h BMP2 mRNA的表达开始增强; 48 h NF-κB多表达于肝细胞核且强度增加, 此阶段细胞质中BMP2 mRNA的表达已逐渐接近正常肝组织, 提示PH后残余肝组织在不同时间点出现NF-κB不同程度的激活, 通过比较PH后残余肝组织激活型NF-κB蛋白表达的动态变化与肝组织细胞质中BMP2 mRNA的表达动态变化, 可推测两者之间有一定的相关关系. BMP2 mRNA与NF-κB的表达率做相关性分析, 据此得出BMP2与NF-κB在肝再生初期即PH后12 h内呈负相关, 在肝再生后期即PH后12 h到48 h呈正相关. 在肝再生初期BMP2 mRNA的表达逐渐减少, 可能BMP2的减少促进肝再生, NF-κB的表达逐渐增强, 启动或增强相关基因的转录, 增强肝细胞的分化, 促进肝再生. 肝再生到一定程度即PH后12 h以后, BMP2 mRNA的表达开始逐渐增强, 可能BMP2开始逐渐抑制肝再生. 而NF-κB的表达继续增强且由胞质表达逐渐转为核内表达, 可能在肝再生后期NF-κB更多发挥着抑制肝细胞凋亡, 参与肝内炎症过程的作用.
目前关于BMP2和NF-κB对于肝再生的联合作用还没有明确的研究. NF-κB在肝再生过程中有可能是BMP2基因转录中的一种转录激活因子[9]. NF-κB是属于转录因子家族, 由5个亚基p65, c-Rel, RelB, p50和p52组成, 其中p50和p52早期两个高度同源的成员, 并且是最常见密切联系的成员. 通过凝胶电泳发现BMP2的nre 1基因结合了p50和p65的. 而在BMP2启动子中, 邻近nre 1位点, 有两个重叠sp1的位点被发现. 这可能的NF-κB的p50和p65和sp1的转录因子相互作用, 协调BMP2基因调控. 也可能在肝脏的中NF-κB的p50/p52存在的多余的调节BMP2表达的作用. 在肝脏NF-κB除了直接调节BMP2基因转录外. NF-κB还可能通过间接机制和其他转录因子调节BMP2基因表达.
以上是对BMP2信号传导的途径的初步研究, 但BMP2和NF-κB在肝脏再生过程中具体的调节机制及其信号传导途径尚待进一步研究.
近年来对BMPs 的作用进行了大量的研究, 目前在Medline中可检索到4900余条有关BMPs研究的文献, 其中大多数是关于BMPs与骨组织尤其是骨组织再生关系的研究. 然而, 除骨组织以外, BMPs还主要参与其他组织器官包括肝组织在内的发育与生长过程. 现代生物学发展领域的一个突出主题是相似的作用途径可能涉及多种系统, BMPs很有可能对肝脏发挥类似对骨组织的作用. 因肝脏类似于骨组织也具有强大再生能力, 其再生过程涉及基因表达, 生长因子产生及形态结构塑造等方面的变化.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
目前关于BMP2与肝脏的研究的重点是BMP2在肝脏中的作用及信号传导方式.
2006年, Xu et al应用免疫组织化学和免疫印迹分析BMP2蛋白在大鼠肝再生过程中变化趋势. 提示, 正常大鼠肝组织中有BMP2表达, BMP2可能是抑制肝细胞生长的因素, BMP2下调的表达方式可能在部分肝切除后肝再生过程中起重要作用.
本研究采用原位杂交的方法, 进一步从基因水平上证实BMP2对肝再生的影响, 属首次报道.
研究BMP2对肝再生的影响, 对于以后肝硬化, 肝脏肿瘤, 肝移植等肝脏方面的疾病的诊断、治疗、以及药物的研究都有很深的影响.
骨形态发生蛋白(BMP): 一种能在啮齿类动物异位区诱导新骨形成的蛋白. 后来发现除骨组织以外, BMPs还主要参与其他组织器官包括肝组织在内的发育与生长过程.
本文内容新颖, 结果有一定参考意义, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Urist MR. Bone: formation by autoinduction. 1965. Clin Orthop Relat Res. 2002;4-10. [PubMed] [DOI] |
| 2. | Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, Hewick RM, Wang EA. Novel regulators of bone formation: molecular clones and activities. Science. 1988;242:1528-1534. [PubMed] [DOI] |
| 3. | Xu CP, Ji WM, van den Brink GR, Peppelenbosch MP. Bone morphogenetic protein-2 is a negative regulator of hepatocyte proliferation downregulated in the regenerating liver. World J Gastroenterol. 2006;12:7621-7625. [PubMed] |
| 4. | Zhang W, Yatskievych TA, Baker RK, Antin PB. Regulation of Hex gene expression and initial stages of avian hepatogenesis by Bmp and Fgf signaling. Dev Biol. 2004;268:312-326. [PubMed] [DOI] |
| 5. | Ader T, Norel R, Levoci L, Rogler LE. Transcriptional profiling implicates TGFbeta/BMP and Notch signaling pathways in ductular differentiation of fetal murine hepatoblasts. Mech Dev. 2006;123:177-194. [PubMed] [DOI] |
| 6. | Knittel T, Fellmer P, Müller L, Ramadori G. Bone morphogenetic protein-6 is expressed in nonparenchymal liver cells and upregulated by transforming growth factor-beta 1. Exp Cell Res. 1997;232:263-269. [PubMed] [DOI] |
| 7. | Miller AF, Harvey SA, Thies RS, Olson MS. Bone morphogenetic protein-9. An autocrine/paracrine cytokine in the liver. J Biol Chem. 2000;275:17937-17945. [PubMed] [DOI] |
| 8. | Yang WJ, Zhang QY, Yu ZP, Song QT, Liang HP, Xu X, Zhu GB, Jiang FZ, Shi HQ. Effects of nuclear factor-kappaB on rat hepatocyte regeneration and apoptosis after 70% portal branch ligation. World J Gastroenterol. 2005;11:6775-6779. [PubMed] |
| 9. | Feng JQ, Xing L, Zhang JH, Zhao M, Horn D, Chan J, Boyce BF, Harris SE, Mundy GR, Chen D. NF-kappaB specifically activates BMP-2 gene expression in growth plate chondrocytes in vivo and in a chondrocyte cell line in vitro. J Biol Chem. 2003;278:29130-29135. [PubMed] [DOI] |