修回日期: 2008-06-13
接受日期: 2008-06-17
在线出版日期: 2008-07-28
目的: 探讨P-糖蛋白(P-glycoprotein, P-gp)在胃癌淋巴结转移灶与原发灶表达水平的差异及其与胃癌临床病理特征的关系.
方法: 应用免疫组化的方法检测19例伴有淋巴结转移的胃癌患者的淋巴结转移灶、胃癌原发灶和正常胃黏膜的P-gp表达.
结果: 淋巴结转移灶P-gp表达的阳性率高于原发灶(84.20% vs 52.63%, P<0.05); 淋巴结转移灶P-gp表达与患者性别、年龄、肿瘤分化程度和浸润深度无关; 胃癌原发灶P-gp的表达与胃癌组织分化程度和浸润深度有关(P<0.05), 与性别和年龄无关. P-gp表达阳性率在高、中分化者较低分化者高, 肿瘤浸润未达浆膜者高于已穿越浆膜者.
结论: 胃癌淋巴结转移灶的P-gp表达高于原发灶, 淋巴结转移灶与原发灶P-gp表达和胃癌临床病理特征的关系不同.
引文著录: 李勇莉, 李红军, 张敏, 高建凯, 高福莲. 胃癌淋巴结转移灶与原发灶P-糖蛋白的表达及意义. 世界华人消化杂志 2008; 16(21): 2404-2407
Revised: June 13, 2008
Accepted: June 17, 2008
Published online: July 28, 2008
AIM: To explore the different levels of P-glycoprotein (P-gp) expression in metastatic lymph nodes and primary lesions of gastric carcinoma and its relation with the biological behaviors of gastric cancer.
METHODS: Tissue specimens from 19 cases of gastric carcinoma with lymph node metastases were collected. The expression of P-gp was examined by immunohistochemistry in tissues of metastatic lymph nodes, primary lesions and normal gastric mucosa.
RESULTS: P-gp expression in metastatic lymph nodes was higher than that in the primary cancers (84.20% vs 52.63%, P < 0.05). The expression of P-gp in lymph node metastastic tissues had no significant association with the sex and age of patients, gastric carcinoma differentiation and infiltration, but P-gp expression in primary tumors was markedly associated with cancer differentiation degree and infiltration depth (P < 0.05). The positive rate of P-gp expression in patients without serosal invasion or with high and moderate differention was higher than that in those with serosal invasion or with low differentiation (P < 0.05).
CONCLUSION: P-gp expression in metastatic lymph nodes is higher than that in primary gastric cancers. The relation of P-gp expression with the biological behaviors is different between metastatic lymph nodes and primary lesions of gastric cancer.
- Citation: Li YL, Li HJ, Zhang M, Gao JK, Gao FL. Expression of P-glycoprotein and its significance in metastatic lymph nodes and primary lesions of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2404-2407
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2404.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2404
在胃癌化疗过程中, 多药耐药(multidrug resistance, MDR)严重影响患者的疗效和生存质量. MDR是指肿瘤细胞对一种抗肿瘤药物产生耐药性同时, 对结构和作用机制完全不同的其他抗肿瘤药物也出现耐药性. 多药耐药基因1(multidrug resistance gene1, mdr1)编码的P-糖蛋白(P-glycoprotein, P-gp)[1]过度表达是引起MDR的主要机制. 恶性肿瘤转移灶中肿瘤细胞MDR 的异质性是影响化疗效果的主要障碍[2-3], 淋巴结是胃癌重要的转移途径, 目前对胃癌P-gp表达水平的研究多限于原发灶, 较少涉及淋巴结转移灶与原发灶比较, 对比研究胃癌淋巴结转移灶和原发灶P-gp表达的差异, 可为胃癌的化疗提供理论依据. 本研究应用免疫组化的方法检测同一患者的淋巴结转移灶、胃癌原发灶及正常胃黏膜的P-gp表达, 共19例, 探讨胃癌发生和转移中P-gp表达的变化及其意义.
2006-02/2006-08新乡医学院第一附属医院手术治疗的胃癌患者中, 病理确诊为胃腺癌、均伴有淋巴结转移、手术标本的切缘组织为正常胃黏膜的部分, 共19例. 其中男性12例, 女性7例; 年龄35-84岁. 患者术前未接受放、化疗以及非甾体类抗炎药治疗. 一抗为兔抗人P-gp多克隆抗体(Mdr(H-241): sc-8313), 购自Santa Cruz公司; 即用型SABC免疫组化染色试剂盒和DAB显色试剂盒购自武汉Boster公司.
取手术标本的切缘组织、胃癌原发灶和转移淋巴结标本分别设为正常胃黏膜、胃癌原发和淋巴结转移三组, 经中性甲醛固定, 常规石蜡包埋、切片. 采用SABC法对组织切片进行P-gp免疫组织化学染色, SABC包含有辣根过氧化物酶, 底物选择DAB. 染色步骤严格按试剂盒说明书进行. 由两位病理医师双盲法对正常胃黏膜、胃癌原发灶及相应转移淋巴结切片进行观察. 每种切片随机取5个(×400)高倍视野, 每视野计数100个细胞. 以细胞膜及(或)细胞质呈棕黄色为P-gp阳性细胞, 阳性细胞数≥10%为P-gp表达阳性.
统计学处理 采用SPSS13.0统计软件进行处理. 阳性率的比较采用χ2检验, 检验水准α = 0.05.
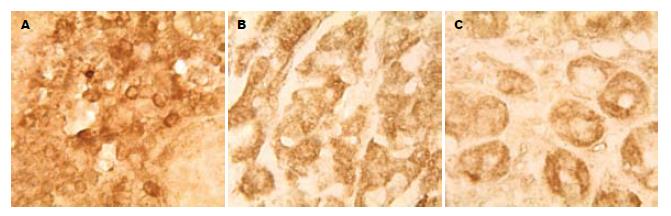
P-gp在胃癌淋巴结转移灶、原发灶及正常胃黏膜均有不同水平表达(图1), 表达强度由高到低依次为淋巴结转移灶、原发灶及正常胃黏膜(P<0.05, 表1).
| 临床病理特征 | 阳性 | 阴性 |
| 正常胃黏膜 | 4(21.10) | 15(78.90) |
| 胃癌原发灶 | 10(52.63) | 9(47.37) |
| 转移淋巴结 | 16(84.20) | 3(15.80) |
转移淋巴结P-gp表达与胃癌患者的性别、年龄以及肿瘤分化程度和浸润深度均无关(P>0.05, 表2).
| 临床病理特征 | n | 转移淋巴结 | P值 | 胃癌原发灶 | P值 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||||
| 性别 | |||||||
| 男 | 12 | 10(83.30) | 2(16.70) | 7(58.33) | 5(41.67) | 0.526 | 0.891 |
| 女 | 7 | 6(85.70) | 1(14.30) | 3(42.86) | 4(57.14) | ||
| 年龄 | |||||||
| ≤50岁 | 7 | 5(71.40) | 2(28.60) | 4(57.10) | 3(42.90) | 0.770 | 0.256 |
| >50岁 | 12 | 11(91.70) | 1(8.30) | 6(50.00) | 6(50.00) | ||
| 肿瘤分化程度 | |||||||
| 高、中分化 | 11 | 9(81.80) | 2(18.20) | 8(72.70) | 3(27.30) | 0.045 | 0.737 |
| 低分化 | 8 | 7(87.50) | 1(12.50) | 2(25.00) | 6(75.00) | ||
| 浸润深度 | |||||||
| 浆膜内 | 7 | 6(85.70) | 1(14.30) | 6(85.70) | 1(14.30) | 0.032 | 0.891 |
| 浆膜及浆膜外 | 12 | 10(83.30) | 2(16.70) | 4(33.30) | 8(66.70) | ||
胃癌原发灶P-gp的表达与肿瘤分化程度和浸润深度有关, 高、中分化胃癌的P-gp阳性率高于低分化胃癌; 肿瘤浸润未达浆膜者高于已穿越浆膜者(P<0.05, 表2); 而与性别和年龄无关.
胃癌是我国十大恶性肿瘤之一, 发病率和死亡率均居恶性肿瘤首位, 且呈上升趋势[4]. 化疗仍是胃癌治疗的主要手段, 在胃癌的原发MDR中有P-gp参与. P-gp是具有转运功能的跨膜糖蛋白, 其疏水区结合药物, 能量依赖性地将药物泵出细胞外, 使细胞内药物蓄积减少导致MDR[5]. 本研究结果显示, P-gp在正常胃黏膜、胃癌原发灶及相应淋巴结转移灶的表达率分别是21.10%、52.63%、84.20%. P-gp在正常胃黏膜和胃癌原发灶的表达率, 文献报告相差悬殊[6-7], 造成不同结果的原因可能与应用的检测方法及操作技术不同有关; 关于胃癌淋巴结转移灶的表达率未见报道. P-gp在正常胃黏膜、胃癌原发灶及相应淋巴结转移灶表达差异有统计学意义, 淋巴结转移灶中P-gp表达阳性率最高. 韩杰 et al对消化系肿瘤包括胃癌和大肠癌的淋巴结转移灶与原发灶的P-gp表达进行了研究, 在淋巴结转移灶与原发灶的P-gp表达与我们的结果一致[8-9]. 高福莲 et al[10]对胃上皮永生化细胞ges-1、来自胃腺癌原发灶和淋巴结转移灶的胃癌细胞系BGC823和SGC7901的P-gp表达研究显示, P-gp表达在胃上皮永生化细胞ges-1就存在, BGC823增强, SGC7901介于二者之间, 但SGC7901少数细胞P-gp表达极强; P-gp表达在胃上皮永生化细胞ges-1和来自胃腺癌原发灶BGC823的变化趋势与本研究的正常胃黏膜和胃癌原发灶的结果一致, 但来自胃腺癌原发灶和淋巴结转移灶的胃癌细胞BGC823和SGC7901的P-gp表达变化趋势方面与本研究胃癌原发灶和淋巴结转移灶的结果不同, 这种不同可能为高福莲 et al使用的是建系细胞, 在肿瘤细胞演进中, P-gp表达极强的肿瘤细胞可能生命力更强, 形成了高表达P-gp的转移灶, 本实验的淋巴结转移灶P-gp表达检测只是肿瘤转移灶生长的某个时段, 难反应肿瘤转移灶P-gp表达的发展过程.
胃癌淋巴结转移灶P-gp表达与临床病理特征的关系研究尚未见报道, 针对胃癌原发灶P-gp表达与临床病理特征关系的报道较多. 本实验结果表明, 胃癌原发灶P-gp表达与性别和年龄无关, 与肿瘤分化程度和浸润深度有关, 在肿瘤分化程度、浸润深度以及性别和年龄等方面与高福莲 et al[11]综述众多研究的如下结果一致: 原发灶mdr1表达和肿瘤分化程度、浸润程度关系不肯定性; 和患者性别、年龄无相关性. 高中分化胃癌的P-gp阳性率高于低分化胃癌, 与Choi et al[12]研究结果一致, 肿瘤浸润未达浆膜者高于已穿越浆膜者, 与刘忠民 et al[13]的研究结果一致.
恶性肿瘤尽管由一个发生恶性转化的细胞单克隆增殖而来, 但在其演进过程中可能出现基因或大分子的改变, 表现为有各自特性的"亚克隆", 对抗癌药敏感性等方面呈现异质性. 本研究P-gp表达在正常胃黏膜、胃癌原发灶和淋巴结转移灶有差异, 淋巴结转移灶中P-gp表达阳性率高于原发灶, 说明正常胃黏膜具有抵抗药物的特性, 肿瘤细胞只是增加了这种抗药性呈现原发耐药, 淋巴结转移灶的耐药性有异质性变化, 原发灶P-gp表达水平难反映淋巴结转移灶的P-gp参与的MDR, 检测淋巴结转移灶和胃癌原发灶P-gp表达对于指导临床制定合理的化疗方案有重要参考价值, P-gp表达主要对生物碱类、蒽环类和鬼臼类耐药, 对烷化剂较敏感, 临床上可根据肿瘤P-gp表达结果来选择化疗方案, 尽量避免使用与P-gp相关的药物以提高化疗效果; 化疗时应将转移灶与肿瘤原发灶区别对待, 尤其肿瘤切除术后的患者, 针对淋巴结转移灶化疗将为提高综合治疗效果具有重要的临床意义.
本研究显示胃癌原发灶P-gp表达与否和临床病理特征的关系与淋巴结转移灶P-gp表达与否与临床病理特征关系不同, 也是胃癌淋巴结转移灶发生异质性的佐证. 由于本研究涉及病例较少, 胃癌淋巴结转移灶和原发灶P-gp表达其能否成为预后指标尚需商榷, 有待于进一步扩大样本例数进行深入研究.
在我国胃癌发病率和死亡率均居恶性肿瘤首位, 且呈上升趋势. 多药耐药(MDR)严重影响胃癌患者的化疗效果和生存质量. mdr1编码的P-gp过度表达是引起MDR的主要机制. 恶性肿瘤转移灶中肿瘤细胞MDR的异质性是影响化疗效果的主要障碍.
房静远, 教授, 上海交通大学医学院附属仁济医院消化内科.
目前对胃癌P-gp表达的研究多限于原发灶以及原发灶与正常胃黏膜P-gp表达的比较, 较少涉及淋巴结转移灶. 针对胃癌原发灶P-gp表达与临床病理特征关系的报道较多, 胃癌淋巴结转移灶P-gp表达与临床病理特征的关系尚未见报道.
高福莲 et al针对胃癌组织P-gp表达与胃癌临床病理特征的关系的众多研究进行统计和分析, 得出胃癌的mdr1表达和胃癌对抗肿瘤药物敏感性及患者的生存期、生存率呈负相关; 和组织分化程度、肿瘤浸润程度、肿瘤分期及转移状况的关系不肯定性; 和肿瘤发生部位、大小、组织类型、患者年龄、性别无相关性.
本文分析了P-糖蛋白在胃癌淋巴结转移灶与原发灶表达水平的差异及其与胃癌临床病理特征的关系, 具有一定的新意和临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Haus-Cohen M, Assaraf YG, Binyamin L, Benhar I, Reiter Y. Disruption of P-glycoprotein anticancer drug efflux activity by a small recombinant single-chain Fv antibody fragment targeted to an extracellular epitope. Int J Cancer. 2004;109:750-758. [PubMed] [DOI] |
| 2. | Donnenberg VS, Donnenberg AD. Multiple drug resistance in cancer revisited: the cancer stem cell hypothesis. J Clin Pharmacol. 2005;45:872-877. [PubMed] [DOI] |
| 3. | Bähr O, Rieger J, Duffner F, Meyermann R, Weller M, Wick W. P-glycoprotein and multidrug resistance-associated protein mediate specific patterns of multidrug resistance in malignant glioma cell lines, but not in primary glioma cells. Brain Pathol. 2003;13:482-494. [PubMed] |
| 4. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化 情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 5. | Lacueva FJ, Calpena R, Medrano J, Teruel A, Mayol MJ, Graells ML, Camarasa MV, Perez-Vazquez MT, Ferragut JA. Changes in P-glycoprotein expression in gastric carcinoma with respect to distant gastric mucosa may be influenced by p53. Cancer. 2000;89:21-28. [PubMed] [DOI] |
| 7. | Lacueva J, Perez-Ramos M, Soto JL, Oliver I, Andrada E, Medrano J, Perez-Vazquez T, Arroyo A, Carrato A, Ferragut JA. Multidrug resistance-associated protein (MRP1) gene is strongly expressed in gastric carcinomas. Analysis by immunohistochemistry and real-time quantitative RT-PCR. Histopathology. 2005;46:389-395. [PubMed] [DOI] |
| 10. | 高 福莲, 岳 保红, 马 开颜, 乐 晓萍, 张 钦宪. 胃上皮永生细胞、胃腺癌细胞和胃腺癌淋巴结转移细胞多耐药基因1和 P-糖蛋白的表达. 郑州大学学报(医学版). 2006;41:514-517. |
| 12. | Choi JH, Lim HY, Joo HJ, Kim HS, Yi JW, Kim HC, Cho YK, Kim MW, Lee KB. Expression of multidrug resistance-associated protein1,P-glycoprotein, and thymidylate synthase in gastric cancer patients treated with 5-fluorouracil and doxorubicin- based adjuvant chemotherapy after curative resection. Br J Cancer. 2002;86:1578-1585. [PubMed] [DOI] |