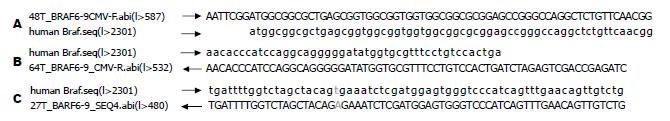修回日期: 2008-05-15
接受日期: 2008-05-27
在线出版日期: 2008-07-28
目的: 构建BRAF野生型和V600E突变型真核表达载体; 转染并筛选稳定表达BRAF的胰腺癌细胞株, 为探讨BRAF V600E突变在胰腺癌发生发展中的作用提供合适的细胞模型.
方法: 将BRAF野生型及V600E突变型cDNA克隆于真核表达载体pCMV-Myc中, 构建pCMV-Myc-BRAFW及pCMV-Myc-BRAFV600E重组质粒, 酶切鉴定、测序证实序列正确后, 利用脂质体将重组质粒转染胰腺癌细胞Panc-1, 经G418培养筛选获得抗性细胞克隆, 用RT-PCR和Western blot鉴定野生型和V600E突变型BRAF基因在Panc-1细胞中的表达.
结果: 酶切鉴定和序列分析证实, 重组克隆pCMV-Myc-BRAFW和pCMV-Myc-BRAFV600E序列正确, RT-PCR和Western blot结果显示G418筛选获得的转基因Panc-1细胞稳定表达BRAF和BRAF V600E.
结论: 成功构建了pCMV-Myc-BRAFW和pCMV-Myc-BRAFV600E真核表达载体, 建立了稳定表达BRAF和BRAF V600E的胰腺癌细胞株.
引文著录: 程张军, 石欣, 汤永辉, 高乃荣. 人BRAF野生型及V600E突变型真核表达载体的构建及表达. 世界华人消化杂志 2008; 16(21): 2395-2398
Revised: May 15, 2008
Accepted: May 27, 2008
Published online: July 28, 2008
AIM: To construct eukaryotic expression vectors for human wild-type and V600E mutant BRAF (v-raf murine sarcoma viral oncogene homolog B1) gene respectively, and to provide suitable cell models for evaluating the potential role of BRAF V600E in pancreatic carcinoma.
METHODS: Human full-length BRAF and BRAF V600E cDNA were subcloned to pCMV-Myc to construct recombinant eukaryotic expression vectors pCMV-Myc-BRAFW and pCMV-Myc-BRAFV600E. The recombinant plasmids were transfected into Panc-1 cells by lipofectamin method and the positive cell clones were screened with G418. The expression of human wild-type and V600E mutant BRAF gene in Panc-1 cells was tested by reverse transciptase-polymerase chain reaction (RT-PCR) and Western blot.
RESULTS: Enzyme digestion and sequencing analysis showed that the target gene was cloned into recombinant vectors successfully, and the expression of human wild-type and V600E BRAF gene was identified in the transfected Panc-1 cells by RT-PCR and Western blot.
CONCLUSION: The eukaryotic expression vectors containing human wild-type and V600E mutant BRAF gene are successfully constructed. The positive Panc-1 cell clones expressing human wild-type and V600E-mutant BRAF gene stably are obtained.
- Citation: Cheng ZJ, Shi X, Tang YH, Gao NR. Construction and expression of eukaryotic expression vector for human wild-type and V600E mutant BRAF gene. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2395-2398
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2395.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2395
在多种恶性肿瘤中, 存在BRAF(v-raf murine sarcoma viral oncogene homolog B1)突变, 其中约80%位于第1799核苷酸上, T突变为A(T1799A), 导致其编码的谷氨酸由缬氨酸取代(V600E), V600E突变能使BRAF激酶活性及NIH3T3细胞转化能力提高[1]. 但是BRAF基因突变在胰腺癌的发生和发展中的作用尚不清楚. 本研究拟构建野生型和V600E突变型人BRAF基因真核表达载体; 转染并筛选稳定表达BRAF V600E的胰腺癌细胞株, 为探讨BRAF V600E突变在胰腺癌发生和发展中的作用提供合适的细胞模型.
质粒、菌株、细胞株和抗体. 克隆质粒pUC m-T/BRAF-1(含BRAF基因1-508 bp片段)、pUCm-T/BRAF-2(含BRAF基因508-2301 bp片段)、pUCm-T/BRAF-3(含V600E突变型BRAF基因508-2301bp片段)由本课题组先期合成; 真核表达载体pCMV-Myc(美国Clonetech公司); 感受态大肠杆菌DH5alpha(TaKaRa公司); 胰腺癌细胞株Panc-1(美国ATCC公司); 鼠抗人c-Myc mAb、HRP标记羊抗鼠多克隆抗体(Santa Cruz公司). Pfu DNA Polymerase(华美生物工程公司); 限制性内切酶、T4 DNA Ligase(SibEnzyme公司); DNA胶回收试剂盒、PCR产物纯化试剂盒(Qiagen公司); 质粒小量抽提试剂盒(Omega公司); DMEM培养液(美国Gibco公司); G418、Lipofectamin2000转染试剂盒、TRIzol、逆转录试剂盒(美国Invitrogen公司); 蛋白质抽提试剂盒、蛋白质定量试剂盒(上海康成生物公司).
1.2.1 BRAF野生型及V600E突变型真核表达载体的构建: pCMV-Myc载体用EcoRⅠ和SalⅠ双酶切, 胶回收试剂盒回收3800 kb的载体DNA片段; EcoRⅠ/KpnⅠ双酶切pUCm-T/BRAF-1质粒, 胶回收试剂盒回收508 bp DNA片段; KpnⅠ/SalⅠ双酶切pUCm-T/BRAF-2质粒, 胶回收试剂盒回收1800 bp DNA片段; T4 DNA Ligase将3个片段14℃连接过夜, 连接产物转化感受态大肠杆菌DH5 alpha, 筛选阳性克隆, 抽质粒, 酶切鉴定、测序, 正确克隆定义为pCMV-Myc-BRAFW. 同样方法构建V600E突变型真核表达载体(所不同的是将pUCm-T/BRAF-2质粒换为pUCm-T/BRAF-3质粒), 正确克隆定义为pCMV-Myc-BRAFV600E.
1.2.2 G418浓度梯度试验: 胰酶消化Panc-1细胞成细胞悬液, 稀释至108 cell/L, 24孔板中取20个孔, 每孔加入100 µL的细胞悬液及无双抗的培养基900 µL. 将每孔中的G418浓度稀释至0、200、300、400、500、600、700、800、 900、1000 mg/L等10个级别. 每3-5 d换液, 培养10 d, 记录细胞全部死亡的最低浓度. 以细胞全部死亡的最低浓度加一个级别为筛选浓度.
1.2.3 转染Panc-1细胞: 接种Panc-1细胞2×104/孔于96孔板, pCMV-Myc-BRAFW、pCMV-Myc- BRAFV600E、pCMV-Myc每种质粒准备转染2个孔, 同时设立对照细胞2孔. 接种后24h观察细胞浓度达70%-90%, 按Lipofectamin2000操作手册进行转染实验, 转染后6 h换新鲜培养液, 转染24 h后将转染了质粒的细胞和对照细胞移到24孔板中, 培养过夜. 转染48 h后换含有G418的选择培养液, 继续培养细胞, 2-3 d更换选择培养液, 直至对照细胞全部死亡, 以维持量的G418(浓度减半)继续培养2 wk筛选得到阳性细胞克隆.
1.2.4 阳性细胞克隆的逆转录聚合酶链反应(RT-PCR)检测: 收集分别转染pCMV-Myc、pCMV-Myc-BRAFW和pCMV-Myc-BRAFV600E后筛选获得的Panc-1细胞各约5×106, TRIzol法抽提总RNA, 按试剂盒说明进行逆转录和PCR反应: BRAF上游引物: 5'-ACG GGA CTC GAG TGA TGA TTG G-3', 下游引物: 5'-TGA AGG CTT GTA ACT GCT GAG GTG-3', 预计扩增产物167 bp; 内参β-actin上游引物: 5'-CTG GAC GAA TGG AGA AAA-3', 下游引物: 5'-AAG GAA GGC TGG AAG AGT GC-3', 预计扩增产物564 bp. PCR反应体系50 µL, 反应条件: 94℃预变性2 min; 94℃ 45 s, 58℃ 45 s, 72℃ 45 s, 30个循环; 72℃延伸5 min. PCR产物进行10 g/L琼脂糖凝胶电泳.
1.2.5 阳性细胞克隆的Western blot分析: 收集分别转染pCMV-Myc、pCMV-Myc-BRAFW和pCMV-Myc-BRAFV600E后筛选获得的Panc-1细胞各约5×106, 按试剂盒说明进行蛋白质抽提和定量. 20 µg蛋白作100 g/L SDS-PAGE电泳, 转至Immunoblot-P转移膜, 用5%脱脂奶粉封闭, 分别与1:1000鼠抗c-Myc一抗和辣根过氧化物酶标记的羊抗鼠二抗孵育, 对反应好的膜进行化学发光, X光片曝光、显影、定影.
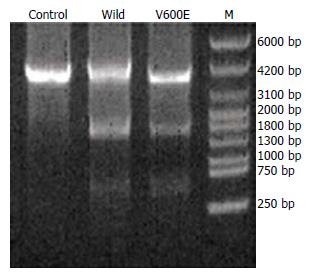
野生型和突变型重组载体在600、1700和3800 bp左右处均出现相应的条带(图1), 表明目的基因已成功连入pCMV-Myc表达载体.
通过对重组载体的DNA测序证实, 所插入的BRAF基因碱基序列与GenBank(登录号: NM004333)中公布的序列完全一致, 而V600E突变型也含有需要的T→A突变(图2).
以500 mg/L的G418浓度培养, Panc-1细胞在10 d时间细胞全部死亡, 600 mg/L应为Panc-1细胞合适的筛选浓度. 转染细胞经筛选, 2 wk后得到抗G418的阳性细胞克隆, 未转染的细胞则在G418培养液中逐渐死亡, 初步表明BRAF基因转染成功.
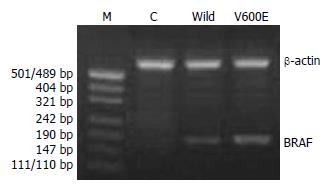
转染了野生型和突变型BRAF的Panc-1细胞在170 bp处均出现了目的条带, 而转染空载体的则未出现(图3).
转染了野生型和突变型BRAF的Panc-1均检出了目的蛋白的表达, 而转染空白对照载体的Panc-1细胞则未检出(图4).
BRAF基因编码一种丝/苏氨酸特异性激酶(serine/threonine-specific kinase), 是RAS-RAF-MEK- ERK-MAPK通路重要的转导因子, 参与调控细胞内多种生物学事件, 如细胞生长、分化和凋亡等[2]. 在绝大多数组织和细胞类型中, BRAF是MEK/ERK最为关键的激活因子[3-5]. BRAF V600E突变能模拟T598和S601两个位点的磷酸化作用, 使BRAF蛋白激活. Smalley et al报道, BRAF激活后, 相应激活MEK和ERK, ERK活性增加可促进细胞增殖和侵袭、改变整合素的表达、降低E-钙黏素表达以及增加基质金属蛋白酶(MMP)分泌[6]. Houben et al[7]的研究还发现, BRAF的突变状态与恶性黑色素瘤的预后有关, 存在BRAF突变者预后不良. 还有报道证实, BRAF突变与甲状腺乳头状癌淋巴结转移显著相关[8]. 由此可见, BRAF V600E突变对于肿瘤的发生、发展有关键性作用, 进一步研究BRAF突变的生物学意义有助于丰富对胰腺癌的分子机制的认识和发现新的胰腺癌临床干预措施.
pCMV-Myc是一种哺乳动物细胞表达载体, 属于氨苄青霉素抗性选择系统, 带有氨苄青霉素抗性基因Ampr, 在SV40启动子驱动下可在真核细胞中表达, 其编码产物能使氨苄青霉素类似物G418失活, 故用G418筛选可获得导入有表达载体的阳性细胞克隆; 在pCMV-Myc质粒的多克隆位点上游有一个PCMV启动子, 插入到多克隆位点的外源性基因在该启动子的驱动下可以得到有效表达; 另外该质粒还含有一个N端C-Myc尾, 非常方便用于免疫反应的检测以及作为诱饵蛋白检测酵母双杂交结果. 因此, 该载体非常方便用于筛选和鉴定.
本实验中, 我们将目的基因亚克隆到pCMV-Myc表达载体, 对重组质粒进行双酶切电泳鉴定, 结果显示BRAF野生型和V600E突变型重组载体在600, 1700和3800 bp左右处均出现相应的目的条带, 而空白对照载体则仅在3800bp左右处出现相应的条带, 表明目的基因已成功导入pCMV-Myc表达载体, 进一步测序证实, 本实验中克隆的人野生型BRAF cDNA序列是完全正确的, V600E突变型cDNA序列也含有必要的T→A突变. 证明本研究已正确构建了pCMV-Myc-BRAFW和pCMV-Myc-BRAFV600E真核表达载体.
我们在实验中通过RT-PCR反应鉴定外源性BRAF基因在转基因Panc-1细胞中的表达, 结果证实, 具有G418抗性的转染重组载体pCMV-Myc-BRAFW和pCMV-Myc-BRAFV600E的Panc-1细胞克隆中有人BRAF基因的mRNA水平的表达. 同时, 我们又对这些转基因细胞进行了Western blot检测, 结果显示转染了野生型和突变型BRAF基因的Panc-1均检出了目的蛋白c-Myc的表达, 说明这些细胞中能表达人BRAF蛋白.
本实验成功建立了稳定表达人野生型和V600E突变型BRAF基因的Panc-1细胞株, 这为我们进一步研究BRAF V600E突变的功能和在胰腺癌发生、发展中的作用奠定了良好的基础.
胰腺癌的早期表现不典型, 目前用于诊断的CT、MRI等影像学技术以及CA19-9、CEA等肿瘤标志物血清学检查, 其准确性和灵敏性尚难满足临床要求, 难以做到早期诊断. 因此, 寻找早期诊断方法已成为当前胰腺癌研究的重点和热点. 研究表明, BRAF突变状态与多种肿瘤的发生、发展及临床结局有关, 可能是一种新的恶性肿瘤相关基因、一个新的基因治疗靶点. 对BRAF突变与胰腺癌发生和发展的关系进行深入研究, 可望为发现一条新的胰腺癌诊断和治疗途径提供理论基础.
房林, 副教授, 同济大学附属上海市第十人民医院普外科; 谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科.
目前国内外对胰腺癌中BRAF基因突变情况研究较少, BRAF突变对胰腺癌发生、发展的作用尚未见报道.
K-ras及其下游的RAF-MEK-ERK-MAPK信号通路被认为与胰腺癌的发生显著相关. 最近的两项研究发现, 在胰腺癌临床标本和胰腺癌细胞株COLO357中均能检测到BRAF V600E突变, 且在同一肿瘤组织中, BRAF和K-ras突变具有互相排斥的性质, 这提示两者对与细胞生长有关的胞间信号转导系统的激活可能相互独立, 是启动肿瘤细胞增殖的两个独立因素.
CCP是我国学者自行合成的超分子铂类配合物, 已经申请专利. CCP是一种笼状结构, 以卡铂作为主体分子, 以柠檬酸作为客体分子, 即以柠檬酸的3个-COOH中的2个结合成分子内氢键, 生成超分子的CCP, 以第三个COOH增加分子的极性, 进而增加可溶性. 同时, 这种结构起到保护中心铂原子的作用. 整个分子将增加稳定性、溶解性、极性、特异性和增加对肿瘤的毒性. 本文是关于CCP的体外和动物体内的药效学研究.
本研究介绍了BRAF V600E突变体真核表达载体的构建和表达方法, 为进一步研究BRAF V600E突变的功能和在胰腺癌发生、发展中的作用奠定了良好的基础.
本文选题较新颖, 总体思路清晰, 表达准确, 有一定的实用价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Davies H, Bignell GR, Cox C, Stephens P, Edkins S, Clegg S, Teague J, Woffendin H, Garnett MJ, Bottomley W. Mutations of the BRAF gene in human cancer. Nature. 2002;417:949-954. [PubMed] [DOI] |
| 2. | Ikenoue T, Hikiba Y, Kanai F, Tanaka Y, Imamura J, Imamura T, Ohta M, Ijichi H, Tateishi K, Kawakami T. Functional analysis of mutations within the kinase activation segment of B-Raf in human colorectal tumors. Cancer Res. 2003;63:8132-8137. [PubMed] |
| 3. | Wojnowski L, Stancato LF, Larner AC, Rapp UR, Zimmer A. Overlapping and specific functions of Braf and Craf-1 proto-oncogenes during mouse embryogenesis. Mech Dev. 2000;91:97-104. [PubMed] [DOI] |
| 4. | Hüser M, Luckett J, Chiloeches A, Mercer K, Iwobi M, Giblett S, Sun XM, Brown J, Marais R, Pritchard C. MEK kinase activity is not necessary for Raf-1 function. EMBO J. 2001;20:1940-1951. [PubMed] [DOI] |
| 5. | Mikula M, Schreiber M, Husak Z, Kucerova L, Rüth J, Wieser R, Zatloukal K, Beug H, Wagner EF, Baccarini M. Embryonic lethality and fetal liver apoptosis in mice lacking the c-raf-1 gene. EMBO J. 2001;20:1952-1962. [PubMed] [DOI] |
| 6. | Smalley KS. A pivotal role for ERK in the oncogenic behaviour of malignant melanoma? Int J Cancer. 2003;104:527-532. [PubMed] [DOI] |
| 7. | Houben R, Becker JC, Kappel A, Terheyden P, Bröcker EB, Goetz R, Rapp UR. Constitutive activation of the Ras-Raf signaling pathway in metastatic melanoma is associated with poor prognosis. J Carcinog. 2004;3:6. [PubMed] [DOI] |
| 8. | Kim KH, Kang DW, Kim SH, Seong IO, Kang DY. Mutations of the BRAF gene in papillary thyroid carcinoma in a Korean population. Yonsei Med J. 2004;45:818-821. [PubMed] |