修回日期: 2008-06-03
接受日期: 2008-06-12
在线出版日期: 2008-07-28
目的: 研究姜黄素对缺氧条件下人肝癌细胞HepG2中缺氧诱导因子-1α(HIF-1α)表达的影响, 并探讨其可能机制.
方法: 0、1、2、5、10 μmol/L的姜黄素处理缺氧条件下的HepG2细胞6 h后, 用Western blot免疫印迹法和RT-PCR检测HIF-1α的蛋白及mRNA的表达; 0 μmol/L, 10 μmol/L姜黄素, 10 μmol/L姜黄素+10 μmol/L MG-132处理缺氧条件下的HepG2细胞6 h后, 用Western blot检测HIF-1α和VEGF的蛋白水平.
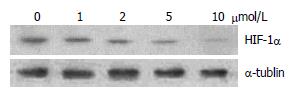
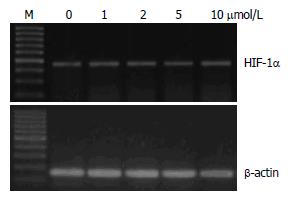
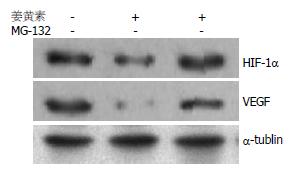
结果: HepG2细胞经1、2、5、10 μmol/L的姜黄素处理后, HIF-1α蛋白水平与对照组(0 μmol/L姜黄素处理)比较明显降低(F = 79.81, P<0.01), 且降低程度随着姜黄素处理浓度的增加而变大, 但各剂量组HIF-1α的mRNA水平与对照组比较无显著性差异; 蛋白酶体抑制剂MG-132可以逆转姜黄素所致的HepG2细胞内HIF-1α和VEGF蛋白表达抑制(F = 68.47, 83.79, 均P<0.01).
结论: 姜黄素通过蛋白酶体途径, 在转录后水平抑制缺氧HepG2细胞的HIF-1α表达.
引文著录: 侯伟, 覃华, 刘爽, 王颖, 刘南植, 赵秋, 田德安. 姜黄素对缺氧HepG2细胞中HIF-1α表达的影响及可能机制. 世界华人消化杂志 2008; 16(21): 2354-2358
Revised: June 3, 2008
Accepted: June 12, 2008
Published online: July 28, 2008
AIM: To study the effect of curcumin on hypoxia-inducible factor-1 alpha (HIF-1α) expression in HepG2 hepatocellular carcinoma cells under hypoxic conditions as well as the possible mechanism.
METHODS: HepG2 cells were treated with different concentrations (0, 1, 2, 5, 10 μmol/L) of curcumin under hypoxic conditions for 6 h. The protein and mRNA levels of HIF-1α were detected by Western blot and reverse transcription-polymerase chain reation (RT-PCR) respectively. Then HepG2 cells were treated with 0, 10 μmol/L curcumin, or 10 μmol/L curcumin plus 10 μmol/L MG-132 under hypoxic conditions for 6 h. The protein levels of HIF-1α and vascular endothelial growth factor (VEGF) were detected by Western blot.
RESULTS: After HepG2 cells were co-incubated with curcumin (1-10 μmol/L) for 6 h, the protein level of HIF-1α decreased significantly as compared with that in the control cells (0 μmol/L curcumin treatment ), in a dose-dependent manner (F = 79.81, P < 0.01), but the mRNA level of HIF-1α was not affected by curcumin. In the presence of MG-132, a proteasome inhibitor, the HIF-1α and VEGF protein levels decreased by curcunmin was restored to the level of control cells (F = 68.47, 83.79, both P < 0.01).
CONCLUSION: Curcumin suppresses HIF-1α expression at post-transcriptional level in HepG2 cells under hypoxia, probably via proteasome-dependent pathway.
- Citation: Hou W, Qin H, Liu S, Wang Y, Liu NZ, Zhao Q, Tian DA. Effect of curcumin on hypoxia-inducible factor-1 alpha expression in hepatocellular carcinoma cells HepG2 under hypoxia and its possible mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2354-2358
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2354.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2354
肿瘤的主要特征是肿瘤细胞的快速生长并伴缺氧微环境的形成[1]. 在缺氧条件下, 肿瘤细胞为了继续生长, 启动一系列缺氧适应性反应, 其中就包括缺氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)相关的基因诱导. HIF-1是维持肿瘤细胞氧平衡的重要转录因子, 在缺氧条件下转运入核, 与缺氧反应元件结合, 促进靶基因转录[2]. HIF-1由α和β亚基组成, 其中HIF-1α是受氧分子调节的主要功能亚基. 人体肿瘤组织中HIF-1α高水平表达, 表达程度与肿瘤的进展程度、转移和放/化疗抵抗力正相关[3-7]. 异源肿瘤模型也证实了HIF-1α高表达与肿瘤的生长和血管生成密切相关[8]. 所以HIF-1α已成为许多癌症研究的重点, HIF-1α抑制剂也被应用于癌症化疗. 姜黄素是天然黄酮类化合物, 具有抗肿瘤、抗炎、抗氧化、降血脂等多种药理作用[9-10], 美国国立肿瘤研究所已将其列为癌症化学预防药物, 进入一期临床试验. 姜黄素的抗癌机制复杂[11], 是否也作为一种HIF-1α抑制剂来发挥其抗癌效益, 目前的研究和报道并不多. 故本实验选取人肝癌HepG2细胞作为研究对象, 观察姜黄素对缺氧条件下HepG2细胞的HIF-1α及HIF-1α靶基因血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达影响, 以研究HIF-1α在姜黄素抗肝癌机制中的作用.
人肝癌HepG2细胞为同济医院肝病研究所自备, DMEM高糖培养基和胎牛血清(美国Gibco公司), 姜黄素和氯化钴(美国Sigma公司), 蛋白酶体抑制剂MG-132(美国Alexis公司), CO2恒温细胞培养箱(日本Sanyo公司), 鼠抗人HIF-1α抗体和鼠抗人VEGF抗体(美国Santa Cruz公司), 鼠抗α-tublin抗体和辣根过氧化物酶标记羊抗鼠二抗(美国Sigma公司), 蛋白定量试剂盒、电泳和转膜装置(美国Bio-rad公司), 增强化学发光剂(ECL)和显影暗盒(英国Amersham公司), 显影胶片(英国宝丽莱T667胶片), 莫洛尼鼠白血病病毒(M-MLV)逆转录酶试剂(美国Promega公司), Taq DNA聚合酶(美国MBI公司), β-actin和HIF-1α引物由北京奥科生物技术有限责任公司合成, PCR仪和图像分析(德国Biometra公司).
1.2.1 细胞培养: HepG2细胞中加入含50 mL/L胎牛血清的DMEM高糖培养基, 置于50 mL/L CO2、37℃、饱和湿度的常氧环境培养箱内培养, 待细胞贴壁融合至80%时更换新鲜无血清培养基, 继续培养24 h后, 细胞进入试验. 为了充分模拟缺氧微环境, 将培养箱调至50 mL/L CO2、950 mL/L N2、37℃、饱和湿度的缺氧条件, 并在细胞缺氧培养前5 min往培养基内添加终浓度300 μmol/L的氯化钴[12].
1.2.2 实验设计与分组: 细胞缺氧培养同时, 分别加入终浓度为0、1、2、5、10 μmol/L的姜黄素作用6 h; 细胞缺氧培养同时, 分别加入0 μmol/L姜黄素、10 μmol/L姜黄素、10 μmol/L姜黄素+10 μmol/L MG-132作用6 h. 作用完成后收集细胞, 提取细胞蛋白和mRNA. 以0 μmol/L姜黄素作用的HepG2细胞作为对照组.
1.2.3 Western blot免疫印迹法检测HIF-1α和VEGF的蛋白表达水平: 用细胞裂解液溶解细胞后提取全细胞蛋白并定量, 将点样蛋白浓度调成一致后电泳分离、转膜. 转样后的硝酸纤维素膜用50 g/L脱脂奶粉缓冲封闭液4℃封闭过夜, 加一抗HIF-1α(1:200)或一抗VEGF(1:200)室温振摇孵育2 h, 洗膜30 min后加二抗(1:8000)室温振摇孵育2 h, 再洗膜30 min除去未结合的二抗后, 暗盒显影. 免疫反应带用ELC试剂盒检测, 化学发光信号用自显影胶片记录. Biometra图像分析仪对条带积分吸光度进行定量分析. 内参选用α-tublin, 用HIF-1α/β-actin和VEGF/β-actin分别表示HIF-1α和VEGF的蛋白相对表达量. 每个实验组重复3次计算统计量.
1.2.4 RT-PCR检测HIF-1α的mRNA水平: 按照TRIzol说明书方法提取细胞mRNA, 测总RNA浓度和纯度. 在25 μL逆转录反应体系中, 以1 μg总RNA为模板, 以随机引物Random 9mers为引物, 用M-MLV逆转录酶将mRNA逆转录为cDNA. 取3 μL逆转录产物cDNA, 用Taq DNA聚合酶进行PCR反应, PCR反应体积25 μL. 以β-actin作为内参. 引物序列如下: HIF-1α: 上游引物5'-CAA AAC ACA CAG CGA AGC-3', 下游引物5'-TCA ACC CAG ACA TAT CCA CC-3', 扩增产物长度473 bp; β-actin: 上游引物5'-CAT CAC TAT CGG CAA TGA GC-3', 下游引物5'-GAC AGC ACT GTG TTG GCA TA-3', 扩增产物长度156 bp. 反应条件为: 94℃预变性5 min后, HIF-1α: 94℃变性45 s, 64℃退火1 min, 72℃延伸1 min; β-actin: 94℃变性1 min, 57℃退火45 s, 72℃延伸1 min. 30个循环后72℃维持5 min, PCR产物经15 g/L琼脂糖凝胶电泳, 凝胶成像系统进行半定量分析, 用HIF-1α/β-actin表示HIF-1α基因的相对表达量. 每个实验组重复3次计算统计量.
统计学处理 实验数据用mean±SD表示, 使用SPSS12.0软件进行组间方差分析.
1 μmol/L姜黄素处理使HepG2细胞缺氧6 h后的HIF-1α蛋白表达明显下降, 与对照组相比差异有统计学意义(P<0.05); 2、5、10 μmol/L姜黄素的处理使HepG2细胞内HIF-1α蛋白表达水平的下降更为明显, 各剂量组与对照组相比, 差异均有统计学意义(P<0.01), 且呈一定的剂量效应关系; 1-10 μmol/L各个剂量组姜黄素处理的HepG2细胞, 缺氧6 h后的HIF-1α mRNA表达水平与对照组相比, 差异无显著性(图1-2, 表1).
10 μmol/L姜黄素处理使HepG2细胞缺氧6 h后的HIF-1α蛋白和VEGF蛋白表达明显下降, 与对照组相比差异均有统计学意义(P<0.01); 10 μmol/L姜黄素与10 μmol/L MG-132共同处理后, 缺氧HepG2细胞内的HIF-1α蛋白和VEGF蛋白表达水平与姜黄素处理组相比均明显上升, 差异有统计学意义(P<0.01), 接近对照组水平(表2, 图3).
姜黄素是从姜科植物姜黄根茎中提取的酚性色素, 是姜黄最重要的生物活性成分, 因其对多种肿瘤的抑制作用, 被视为有极大开发前景的癌症预防及治疗药物[13-14]. 姜黄素的抗癌作用复杂, 研究发现他能通过正相调节谷胱甘肽转移酶[15]、抑制细胞色素P450[16]、减轻氧化应激[9]和炎症[17]、抑制肿瘤生长[18]、诱导细胞周期停滞与调亡[19]或抑制血管生成[20]等, 阻止肿瘤的起始和形成. 最近有研究发现姜黄素还能直接抑制体外血管内皮细胞增殖和体内毛细血管的形成[21-23]. 这证明姜黄素肿瘤的预防效能起码有部分是因为他对血管生成的直接抑制. 但是姜黄素拮抗肿瘤血管形成作用的分子基础和其作用靶分子还未阐明.
HIF-1是由HIF-1α和HIF-1β组成的异源二聚体, 是调节哺乳动物机体氧稳态平衡的重要转录因子, 广泛存在于各种实体肿瘤中, 与肿瘤缺氧诱导的血管发生有关[8,24]. HIF-1α是HIF-1的功能性亚基, 在常氧条件下不断通过泛素-蛋白酶体途径水解, 缺氧条件下则因降解受阻而在胞质内聚集, 转位入核与HIF-1β结合成HIF-1分子, 并与缺氧反应元件结合, 启动下游靶基因转录[25]. 杜静 et al[26]的实验观察到, 人肝癌细胞HepG2在缺氧条件下, HIF-1α和其调控基因VEGF等的表达较常氧条件下显著升高. 而我们的实验发现, 姜黄素能明显抑制缺氧HepG2细胞的HIF-1α蛋白表达. 这与Bae et al[27]的实验结果相似. 上述结果提示HIF-1α很可能是姜黄素抗肝癌作用的靶分子, 姜黄素通过抑制其表达或活性来调控多种促肿瘤生长相关基因表达, 从而抑制肝癌的发生和发展. 同时我们还发现, 姜黄素在下调HIF-1α蛋白水平的同时并没有改变HIF-1α的mRNA表达, 说明姜黄素对HepG2细胞内HIF-1α的抑制效应不是发生在转录水平, 而是在转录后水平使HIF-1α失稳, 影响其活性. 最近有报道称, 姜黄素可诱导细胞内p53的聚集, 从而间接抑制HIF-1α的稳定性, 促进泛素-蛋白酶体对HIF-1α蛋白的降解[28-29]. 为了验证上述观点, 我们引入蛋白酶体抑制剂MG-132, 发现MG-132可以逆转姜黄素对HIF-1α蛋白和VEGF蛋白的抑制作用. 结果提示姜黄素很可能是依赖蛋白酶体途径来降低HIF-1α蛋白的稳定性和活性. 但是姜黄素通过蛋白酶体途径使HIF-1α失稳的确切机制还需要进一步研究.
抗缺氧诱导的肿瘤血管生成是目前肿瘤治疗的研究热点之一[30]. 我们的实验发现姜黄素通过蛋白酶体途径, 在转录后水平促使缺氧HepG2细胞的HIF-1α降解失活, 继而下调HIF-1靶相基因VEGF的表达, 抑制肿瘤血管生成, 延缓肿瘤生长. 这提示天然黄酮姜黄素可能作为HIF-1α抑制剂, 成为未来安全有效的肝癌预防与治疗剂. 同时, 我们的研究也为开发和筛选新型临床抗肝癌药物提供了一定的理论依据.
缺氧诱导因子-1α (HIF-1α)是调节机体氧稳态平衡的重要转录因子, 与肿瘤缺氧诱导的血管发生有关. 中药姜黄系活血化瘀药, 辛温、无毒. 姜黄素是姜黄最重要的活性成分, 近来研究发现他能抑制实体肿瘤的血管生成.
姚希贤, 教授, 河北医科大学附属第二医院消化内科.
抑制肿瘤血管新生是当前抗肿瘤治疗的重要策略之一. 研究肿瘤血管生成抑制的靶点, 并针对性地研发安全、有效的抗肿瘤血管新生药物, 是肿瘤防治研究领域的热点.
本文观察了不同剂量姜黄素作用下, 人肝癌细胞HepG2在缺氧环境中HIF-1α表达的变化, 并探讨了可能的分子机制. 发现姜黄素是在转录后水平通过蛋白酶体途径使HIF-1α降解失活, 继而下调HIF-1靶相基因VEGF的表达, 抑制肿瘤血管生成.
本文研究姜黄素抑制肿瘤血管生成可能的作用靶分子, 为寻找新的抗癌治疗靶点和开发、筛选新型临床抗肝癌药物提供一定的理论依据.
本研究对照设计合理, 结论明确, 具有一定的创新性和良好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Vaupel P, Kallinowski F, Okunieff P. Blood flow, oxygen and nutrient supply, and metabolic microenvironment of human tumors: a review. Cancer Res. 1989;49:6449-6465. [PubMed] |
| 2. | Hägg M, Wennström S. Activation of hypoxia-induced transcription in normoxia. Exp Cell Res. 2005;306:180-191. [PubMed] [DOI] |
| 3. | Zhong H, De Marzo AM, Laughner E, Lim M, Hilton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 4. | Birner P, Schindl M, Obermair A, Plank C, Breitenecker G, Oberhuber G. Overexpression of hypoxia-inducible factor 1alpha is a marker for an unfavorable prognosis in early-stage invasive cervical cancer. Cancer Res. 2000;60:4693-4696. [PubMed] |
| 5. | 杜 琰萍, 施 瑞华, 肖 斌, 朱 宏, 凌 亭生, 张 国新, 郝 波. 食管鳞癌细胞系EC-109中缺氧诱导因子-1a的表达意义. 世界华人消化杂志. 2006;14:1247-1251. [DOI] |
| 6. | Zhao Q, Du J, Gu H, Teng X, Zhang Q, Qin H, Liu N. Effects of YC-1 on hypoxia-inducible factor 1-driven transcription activity, cell proliferative vitality, and apoptosis in hypoxic human pancreatic cancer cells. Pancreas. 2007;34:242-247. [PubMed] [DOI] |
| 8. | Ryan HE, Poloni M, McNulty W, Elson D, Gassmann M, Arbeit JM, Johnson RS. Hypoxia-inducible factor-1alpha is a positive factor in solid tumor growth. Cancer Res. 2000;60:4010-4015. [PubMed] |
| 9. | Ruby AJ, Kuttan G, Babu KD, Rajasekharan KN, Kuttan R. Anti-tumour and antioxidant activity of natural curcuminoids. Cancer Lett. 1995;94:79-83. [PubMed] [DOI] |
| 10. | Kawamori T, Lubet R, Steele VE, Kelloff GJ, Kaskey RB, Rao CV, Reddy BS. Chemopreventive effect of curcumin, a naturally occurring anti-inflammatory agent, during the promotion/progression stages of colon cancer. Cancer Res. 1999;59:597-601. [PubMed] |
| 11. | Aggarwal BB, Kumar A, Bharti AC. Anticancer potential of curcumin: preclinical and clinical studies. Anticancer Res. 2003;23:363-398. [PubMed] |
| 12. | Huang Y, Du KM, Xue ZH, Yan H, Li D, Liu W, Chen Z, Zhao Q, Tong JH, Zhu YS. Cobalt chloride and low oxygen tension trigger differentiation of acute myeloid leukemic cells: possible mediation of hypoxia-inducible factor-1alpha. Leukemia. 2003;17:2065-2073. [PubMed] [DOI] |
| 13. | Cheng AL, Hsu CH, Lin JK, Hsu MM, Ho YF, Shen TS, Ko JY, Lin JT, Lin BR, Ming-Shiang W. Phase I clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions. Anticancer Res. 2001;21:2895-2900. [PubMed] |
| 14. | Sharma RA, Euden SA, Platton SL, Cooke DN, Shafayat A, Hewitt HR, Marczylo TH, Morgan B, Hemingway D, Plummer SM. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance. Clin Cancer Res. 2004;10:6847-6854. [PubMed] [DOI] |
| 15. | Piper JT, Singhal SS, Salameh MS, Torman RT, Awasthi YC, Awasthi S. Mechanisms of anticarcinogenic properties of curcumin: the effect of curcumin on glutathione linked detoxification enzymes in rat liver. Int J Biochem Cell Biol. 1998;30:445-456. [PubMed] [DOI] |
| 16. | Thapliyal R, Maru GB. Inhibition of cytochrome P450 isozymes by curcumins in vitro and in vivo. Food Chem Toxicol. 2001;39:541-547. [PubMed] [DOI] |
| 17. | Plummer SM, Holloway KA, Manson MM, Munks RJ, Kaptein A, Farrow S, Howells L. Inhibition of cyclo-oxygenase 2 expression in colon cells by the chemopreventive agent curcumin involves inhibition of NF-kappaB activation via the NIK/IKK signalling complex. Oncogene. 1999;18:6013-6020. [PubMed] [DOI] |
| 18. | Han SS, Chung ST, Robertson DA, Ranjan D, Bondada S. Curcumin causes the growth arrest and apoptosis of B cell lymphoma by downregulation of egr-1, c-myc, bcl-XL, NF-kappa B, and p53. Clin Immunol. 1999;93:152-161. [PubMed] [DOI] |
| 19. | Moragoda L, Jaszewski R, Majumdar AP. Curcumin induced modulation of cell cycle and apoptosis in gastric and colon cancer cells. Anticancer Res. 2001;21:873-878. [PubMed] |
| 20. | Arbiser JL, Klauber N, Rohan R, van Leeuwen R, Huang MT, Fisher C, Flynn E, Byers HR. Curcumin is an in vivo inhibitor of angiogenesis. Mol Med. 1998;4:376-383. [PubMed] |
| 21. | Mohan R, Sivak J, Ashton P, Russo LA, Pham BQ, Kasahara N, Raizman MB, Fini ME. Curcuminoids inhibit the angiogenic response stimulated by fibroblast growth factor-2, including expression of matrix metalloproteinase gelatinase B. J Biol Chem. 2000;275:10405-10412. [PubMed] [DOI] |
| 22. | Shim JS, Kim JH, Cho HY, Yum YN, Kim SH, Park HJ, Shim BS, Choi SH, Kwon HJ. Irreversible inhibition of CD13/aminopeptidase N by the antiangiogenic agent curcumin. Chem Biol. 2003;10:695-704. [PubMed] [DOI] |
| 23. | Choi H, Chun YS, Kim SW, Kim MS, Park JW. Curcumin inhibits hypoxia-inducible factor-1 by degrading aryl hydrocarbon receptor nuclear translocator: a mechanism of tumor growth inhibition. Mol Pharmacol. 2006;70:1664-1671. [PubMed] [DOI] |
| 24. | Jeong JW, Bae MK, Ahn MY, Kim SH, Sohn TK, Bae MH, Yoo MA, Song EJ, Lee KJ, Kim KW. Regulation and destabilization of HIF-1alpha by ARD1-mediated acetylation. Cell. 2002;111:709-720. [PubMed] [DOI] |
| 25. | Michel G, Minet E, Mottet D, Remacle J, Michiels C. Site-directed mutagenesis studies of the hypoxia-inducible factor- 1alpha DNA-binding domain. Biochim Biophys Acta. 2002;1578:73-83. [PubMed] |
| 26. | 杜 静, 赵 秋, 谷 华, 滕 晓丽, 覃 华, 刘 南植, 梁 扩寰. 缺氧诱导因子-1α及其靶基因在人肝癌HepG2细胞中的表达和意义. 中华肝脏病杂志. 2006;14:607-609. |
| 27. | Bae MK, Kim SH, Jeong JW, Lee YM, Kim HS, Kim SR, Yun I, Bae SK, Kim KW. Curcumin inhibits hypoxia-induced angiogenesis via down-regulation of HIF-1. Oncol Rep. 2006;15:1557-1562. [PubMed] |
| 28. | Jana NR, Dikshit P, Goswami A, Nukina N. Inhibition of proteasomal function by curcumin induces apoptosis through mitochondrial pathway. J Biol Chem. 2004;279:11680-11685. [PubMed] [DOI] |