修回日期: 2008-05-07
接受日期: 2008-05-12
在线出版日期: 2008-07-18
目的: 观察一氧化氮(NO)供体左旋精氨酸(L-arginine, L-Arg)对小鼠离体结肠自主收缩活动的影响及其机制.
方法: 用张力换能器记录肌标本自主收缩的方法, 以离体结肠肌条收缩张力的变化为指标, 观察NO的作用及一氧化氮合酶(nitricoxide synthase, NOS)抑制剂L-NNA、可溶性鸟苷酸环化酶(soluble guanylyl cyclase, sGC)抑制剂ODQ、磷酸二酯酶抑制剂氨茶碱(aminophylline)、M-受体的阻断剂阿托品(atropine)和激动剂乙酰胆碱(acetylcholine, ACh)对NO作用的影响.
结果: NO抑制小鼠结肠平滑肌自主收缩活动, 抑制效应呈浓度依赖性, 1×10-3和1×10-5的L-Arg抑制百分率分别为55.7%±4.4%和38.0%±4.2%, 1×10-8 mol/L时对结肠自主收缩幅度的影响无显著性. L-NNA(1×10-5 mol/L)明显减弱L-Arg的抑制效应. ODQ(1×10-6 mol/L)减弱L-Arg的抑制效应. aminophylline(1×10-6 mol/L)使L-Arg的效应明显增强. atropine(1×10-6 mol/L)明显增强L-Arg的抑制效应. ACh(1×10-7 mol/L)减弱L-Arg的效应.
结论: L-Arg由NOS催化生成NO后经cGMP途径发挥对小鼠结肠自主收缩的抑制作用, M-受体途径也部分参与了NO的作用过程.
引文著录: 彭双勤, 龚红萍, 余上斌, 熊宗斌, 祝兰, 胡还忠. NO对小鼠结肠平滑肌自主收缩活动的影响及其机制. 世界华人消化杂志 2008; 16(20): 2239-2243
Revised: May 7, 2008
Accepted: May 12, 2008
Published online: July 18, 2008
AIM: To observe the effects and mechanism of L-arginine (L-Arg), the donor of nitric oxide (NO), on spontaneous contraction of rat colon smooth muscle in vitro.
METHODS: Effects of NO and influence of L-NNA, ODQ, aminophylline, atropine and acetylcholine on NO were recorded in terms of tension change in rat colon smooth muscle stripe in vitro using tension transducer.
RESULTS: L-Arg inhibited spontaneous contraction of rat colon in a dose-dependent manner at different concentrations ranging from 1 × 10-8 to 1 × 10-3 mol/L. The contraction amplitude was decreased by 38.0% ± 4.2% and 55.7% ± 4.4% respectively when 1 × 10-5 and 1 × 10-3 mol/L L-Arg were used. 1 × 10-8 mol/L L-Arg showed no significant effect on spontaneous activities of rat colon. Inhibitory effects of L-Arg on colon muscle stripe were decreased in presence of ODQ (1 × 10-6 mol/L) or in presence of acetylcholine(1 × 10-7 mol/L), but markedly elevated in presence of aminophylline(1 × 10-6mol/L) or in presence of atropine (1 × 10-6 mol/L).
CONCLUSION: L-Arg inhibits the spontaneous activities of mouse colon smooth muscle by the path of NO-sGC-cGMP and the pathway of M-receptor involved in this effect too.
- Citation: Peng SQ, Gong HP, Yu SB, Xiong ZB, Zhu L, Hu HZ. Effect of nitric oxide on spontaneous contraction of rat colon smooth muscle and its mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2239-2243
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2239.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2239
NO为小分子生物活性物质, 参与胃肠道许多生理和病理过程的调控[1]. 在啮齿类动物的胃肠道, NO是最主要的非肾上腺素能非胆碱能 (nonadrenergic noncholinergic neurons, NANC) 抑制性递质[2-3]. 有证据表明, NO对大鼠、小鼠消化道平滑肌的自主收缩活动有明显抑制作用[4-7]. 其作用机制尚不完全明确, NO对空肠平滑肌相位性收缩的抑制作用, 可能与α、β、M受体有关[5-6]. 有学者认为, 在心血管、消化道等系统, NO通过对其他神经递质如乙酰胆碱(acetylcholine, ACh)等的调制而间接发挥作用[8-10]. 免疫组织化学研究显示, 棕色田鼠胃肠道内一氧化氮合酶(nitricoxide synthase, NOS)分布密度在结肠内最高[11]. 光镜下观察大鼠肠道内NOS与乙酰胆碱酯酶(acetylcholine esterase, AChE)的分布, 结果NOS与AChE存在共染. 提示, NO与胆碱能神经在消化道功能调节上, 可能存在相互协调作用[12]. 有关NO对小鼠结肠平滑肌中的作用的报道甚少. 本文观察NO供体L-Arg对小鼠结肠自主收缩活动的影响, 并初步探讨NO的作用机制, 以期为消化道相关疾病的诊断和治疗研究提供理论依据.
健康成年昆明♂小白鼠35-40 g, 华中科技大学同济医学院动物中心提供. 适应性喂养1 wk. 实验前禁食24 h, 自由饮水. 颈椎脱臼处死, 迅速打开腹腔, 从距回盲部2 cm以内取近端结肠约1.5 cm, 置于950 mL/L O2+50 mL/L CO2饱和的Kreb's液中备用. 本实验所用L-NNA(Lω-nitro-L-arginine), ODQ, aminophylline等试剂购于Sigma公司. L-Arg购于中国科学院武汉分院(日本分装). Atropine, ACh购于武汉远大制药集团股份有限公司. NaCl, KCl, CaCl2, MgSO4, NaHCO3, KH2PO4, Glucose均为国产分析纯试剂. ODQ用二甲亚砜配置, 其他试剂用Kreb's液配置到所需的浓度.
在盛有950 mL/L O2+50 mL/L CO2饱和的Kreb's液的培养皿中, 清除结肠肠系膜, 制成0.5 cm长的标本. 将其置于37±0.5℃、盛有10 mL Kreb's液(950 mL/L O2+50 mL/L CO2饱和)的恒温浴槽中. 标本一端固定于恒温浴槽底部的通气钩上, 另一端连于5Gjz100型肌肉张力换能器(高碑市新航机电设备有限公司)的应变梁上, 换能器与生物信号采集处理系统(南京美易)连接, 记录和处理标本收缩活动张力的变化.
实验前给予标本0.5 g的前负荷, 平衡1 h左右, 每15 min更换Kreb's液一次, 使收缩活动基本稳定(张力的基线和幅度基本不变). 实验试剂用微量加样器直接加入恒温浴槽中, 每次加药的容积为100 μL. 药物作用稳定后, 用950 mL/L O2+50 mL/L CO2饱和的37±0.5℃ Kreb's液冲洗3次, 要求基础张力基本恢复到加药前的水平后再进行下一项实验. 显著不能恢复的标本弃之. 需加拮抗剂时, 在加入拮抗剂孵育15 min后再加入激动剂. 以张力变化幅度抑制百分率为统计指标. 幅度抑制百分率 = (加药前收缩幅度-加药后收缩幅度)/加药前收缩幅度×100%. 加药前收缩幅度: 标本收缩稳定后加药前10 min内的平均收缩幅度(药物孵育后给药为药物孵育稳定后给药前10 min内的平均收缩幅度); 加药后的收缩幅度: 收缩幅度稳定后10 min内的平均幅度; Kreb's液(mol/L): Na+ 137.4, K+ 5.9, Mg2+ 1.2, Cl- 134, HCO3- 15.5, H2PO3- 1.2, Glucose 11.5. 950mL/L O2+50 mL/L CO2饱和; pH = 7.4; 37℃±0.5℃.
统计学处理 统计数据用mean±SD, 用统计软件SPSS11.5进行数据处理, 用配对t检验比较加药前后的变化. P<0.05有统计学意义.
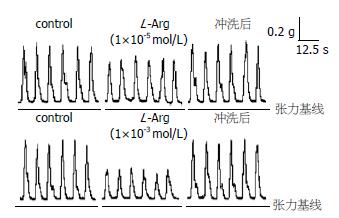
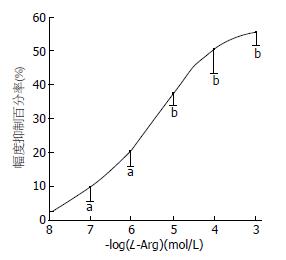
依次观察1×10-8-1×10-3 mol/L各浓度组L-Arg对小鼠结肠肌条自主收缩幅度的影响, 每组9例. L-Arg(1×10-8 mol/L)组没有明显效应. 在L-Arg(10-7-10-3 mol/L)组, 给药后1-3 min左右自主收缩幅度开始下降, 10-15 min左右较稳定, 之后有回升趋势, 冲洗后收缩幅度能基本恢复到加药前的水平(图1). 其中L-Arg(1×10-5mol/L)组的幅度抑制百分率为38.0%±4.2%, L-Arg(1×10-3 mol/L)组的抑制百分率达(55.7%±4.4%). 其抑制效应呈浓度依赖性(图2).
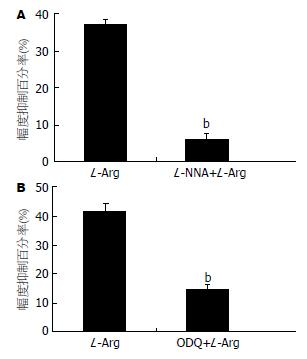
标本孵育稳定后, 先给予L-Arg(1×10-5 mol/L)作为对照, 幅度抑制百分率为36.9%±2.4%; 预先给予L-NNA(1×10-5 mol/L)孵育15 min, 再加入L-Arg(1×10-5 mol/L), 幅度抑制百分率为6.0%±1.8%, 与单独给予L-Arg组配对比较, 差异具有极显著性(n = 10, P<0.01, 图3A).
预先用sGC抑制剂ODQ(1×10-6 mol/L)孵育小鼠结肠标本15min后, 加入1×10-5 mol/L L-Arg, 幅度抑制百分率为13.9%±1.5%, 与同组标本单独L-Arg(1×10-5 mol/L)孵育后的抑制百分率(40.2%±3.8%)配对比较, 差别有显著意义(n = 10, P<0.01, 图3B).
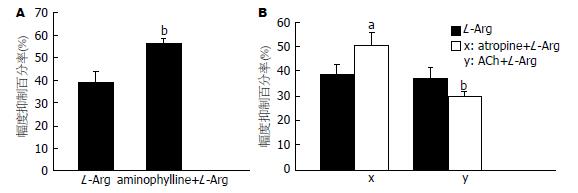
与同组标本单独经L-Arg(1×10-5 mol/L)作用后的抑制百分率(39.2%±4.1%)比较, 预先用aminophylline(1×10-6 mol/L)孵育后加L-Arg(1×10-5 mol/L), 幅度抑制百分率升高(图4A), 达56.2%±2.4%, 差异有统计学意义(P<0.01, n = 11).
标本自主收缩稳定后, 用atropine(1×10-6 mol/L)孵育标本15 min, 再加入1×10-5 mol/L L-Arg, 其幅度抑制百分率为50.1%±5.6%(P<0.01, n = 10), 与同组标本单独L-Arg(1×10-5mol/L)作用后的幅度抑制百分率(38.1%±4.7%)相比, 幅度抑制百分率增高, 其差别具有统计学意义(P<0.05, n = 10); 预先用ACh(1×10-7 mol/L)孵育后再加L-Arg(1×10-5 mol/L), L-Arg(1×10-5 mol/L)的幅度抑制百分率由37.4%±4.3%降低到29.7%±1.4%, 差异有显著统计学意义(P<0.01, n = 10, 图4B).
本实验观察了NO供体L-Arg对小鼠结肠自主收缩的作用, 主要表现为浓度依赖性抑制效应. 1×10-3 mol/L的L-Arg抑制百分率达(55.7±4.4)%, 1×10-7 mol/L的L-Arg抑制百分率为10.1%±4.6%, 1×10-8 mol/L的L-Arg抑制作用不明显. 在体内以L-Arg为底物, 由NOS催化而生成NO; 外源性L-Arg在消化道内以NO的形式对平滑肌收缩运动发挥抑制效应[4-6]. 本实验NOS抑制剂L-NNA(1×10-5 mol/L)几乎完全阻断L-Arg(1×10-5 mol/L)对结肠自主收缩幅度的抑制效应, 支持上述观点. ODQ(1×10-6mol/L)孵育后, L-Arg(1×10-5 mol/L)的幅度抑制百分率从38.0%±3.2%降到13.9%±1.5%, 证明sGC参与了NO的作用过程. 但ODQ并没有完全阻断NO的抑制效应, 提示NO除了通过NO-sGC-cGMP途径作用外, 还通过其他非cGMP依赖性途径发挥作用. cGMP的水解受cGMP-特异的磷酸二酯酶(PDE)催化, PDE抑制剂aminophylline(1×10-6 mol/L)孵育后, L-Arg(1×10-5 mol/L)的幅度抑制百分率升高, 达到56.2%±2.4%. 表明NO的抑制效果与cGMP的关系密切. El-Yazbi et al最新报道, 小鼠小肠平滑肌膜NO依赖于cGMP介导平滑肌的舒张[13]. NO弥散进入细胞后, 激活sGC, 使胞内的cGMP含量增高, 通过cGMP依赖性蛋白激酶, 导致Ca2+通道关闭及Ca2+依赖性K+的开放[13-15], 使肌肉收缩减弱.
atropine(1×10-6 mol/L)使L-Arg(1×10-5 mol/L)的幅度抑制百分率增高; ACh(1×10-7 mol/L)孵育后, L-Arg(1×10-5mol/L)的幅度抑制百分率由38.0%±3.2%降低到29.7%±1.4%. 结果提示, M-受体参与了NO抑制小鼠结肠收缩的部分作用过程. NO的这种抑制作用可能通过作用于突触前膜, 影响其他递质的释放从而抑制胃肠平滑肌运动[15-16]. 有报道认为, 在小鼠、豚鼠回肠内部, 抑制性神经递质NO可能有调节兴奋性递质ACh释放的作用[16-18]. 据此, 我们认为, NO可能一方面借助其疏水性穿过结肠平滑肌细胞膜, 直接通过NO-sGC-cGMP途径对结肠平滑肌运动起抑制作用, 另一方面, 可能作用于胆碱能神经末梢, 抑制胆碱能递质的释放, 影响结肠平滑肌的收缩. Knudsen et al的研究也表明, 兔肛门内括约肌受兴奋性胆碱能神经及抑制性NANC神经支配, NANC神经侧支释放NO, 通过突触前作用抑制胆碱能神经释放ACh, 对肛门内括约肌活动进行调节[18-19].
本研究结果表明, NO可抑制小鼠结肠平滑肌自主收缩幅度, 其作用机制除NO-sGC-cGMP途径外, 可能还与M受体途径有关.
临床上不少疾病(如肝病)易影响消化道平滑肌的运动功能, 导致腹胀或腹泻, 而胃肠道平滑肌运动方式特殊, 影响因素颇多, 其机制并不清楚. 本文观察NO供体L-Arg对小鼠结肠自主收缩活动的影响, 并初步探讨NO的作用机制, 以期为消化道相关疾病的诊断和治疗研究提供理论依据.
姚登福, 教授, 南通大学附属医院分子医学中心
NO对大鼠、小鼠消化道平滑肌的自主收缩活动有明显抑制作用, 其作用机制尚不完全明确.
有报道认为, 在小鼠、豚鼠回肠内部, 抑制性神经递质NO可能有调节兴奋性递质ACh释放的作用.
本文研究方法和技术有特色, 实验对照的设计合理, 统计学处理方法恰当, 科学性和可读性能反映我国胃肠病学基础研究水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Prasad P. The role of nitric oxide in gastrointestinal health and disease. Gastroenterology. 2004;127:1014. [PubMed] [DOI] |
| 2. | Menzies JR, Corbett AD. Nociceptin inhibits tonic nitric oxide release in the mouse isolated proximal colon. Eur J Pharmacol. 2000;388:183-186. [PubMed] [DOI] |
| 3. | Giaroni C, Knight GE, Ruan HZ, Glass R, Bardini M, Lecchini S, Frigo G, Burnstock G. P2 receptors in the murine gastrointestinal tract. Neuropharmacology. 2002;43:1313-1323. [PubMed] [DOI] |
| 4. | 王 晓敏, 胡 还忠, 余 承高, 马 立群, 汪 长东, 田 琴. 去甲肾上腺素对一氧化氮在小鼠十二指肠肌条收缩中作用的影响机制. 世界华人消化杂志. 2005;13:358-362. [DOI] |
| 5. | 汪 长东, 胡 还忠, 刘 子龙, 马 立群, 田 琴, 余 承高, 王 晓敏. 一氧化氮抑制大鼠空肠平滑肌收缩. 胃肠病学和肝病学杂志. 2004;13:588-591. |
| 8. | Allescher HD, Kurjak M, Huber A, Trudrung P, Schusdziarra V. Regulation of VIP release from rat enteric nerve terminals: evidence for a stimulatory effect of NO. Am J Physiol. 1996;271:G568-G574. [PubMed] [DOI] |
| 9. | Flavia Mulè F, Serio R. NANC inhibitory neurotransmission in mouse isolated stomach: involvement of nitric oxide, ATP and vasoactive intestinal polypeptide. Br J Pharmacol. 2003;140:431-437. [PubMed] [DOI] |
| 10. | Wiklund CU, Olgart C, Wiklund NP, Gustafsson LE. Modulation of cholinergic and substance P-like neurotransmission by nitric oxide in the guinea-pig ileum. Br J Pharmacol. 1993;110:833-839. [PubMed] |
| 12. | 吴 红金, 林 传友, 曹 福元, 胡 道松, 殷 光甫, 茹 立强. 大鼠肠道内NOS与AChE、VIP阳性神经元的分布关系研究. 中国组织化学与细胞化学杂志. 2000;9:187-190. |
| 13. | El-Yazbi AF, Cho WJ, Cena J, Schulz R, Daniel EE. Smooth muscle NOS, co-localized with caveolin-1, modulates contraction in mouse small intestine. J Cell Mol Med. 2008; Apr 8 [Epub ahead of print]. [PubMed] |
| 14. | Rapoport RM, Murad F. Agonist-induced endothelium-dependent relaxation in rat thoracic aorta may be mediated through cGMP. Circ Res. 1983;52:352-357. [PubMed] |
| 15. | Craven PA, DeRubertis FR. Restoration of the responsiveness of purified guanylate cyclase to nitrosoguanidine, nitric oxide, and related activators by heme and hemeproteins. Evidence for involvement of the paramagnetic nitrosyl-heme complex in enzyme activation. J Biol Chem. 1978;253:8433-8443. [PubMed] |
| 16. | Tamura K, Schemann M, Wood JD. Actions of nitric oxide-generating sodium nitroprusside in myenteric plexus of guinea pig small intestine. Am J Physiol. 1993;265:G887-G893. [PubMed] |
| 17. | Mang CF, Truempler S, Erbelding D, Kilbinger H. Modulation by NO of acetylcholine release in the ileum of wild-type and NOS gene knockout mice. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1132-G1138. [PubMed] |
| 18. | Yunker AM, Galligan JJ. Endogenous NO inhibits NANC but not cholinergic neurotransmission to circular muscle of guinea pig ileum. Am J Physiol. 1996;271:G904-G912. [PubMed] |
| 19. | Knudsen MA, Glavind EB, Tøttrup A. Transmitter interactions in rabbit internal anal sphincter. Am J Physiol. 1995;269:G232-G239. [PubMed] |