修回日期: 2008-01-04
接受日期: 2008-01-12
在线出版日期: 2008-01-18
目的: 探讨参附注射液对大鼠肝缺血再灌注损伤的保护作用及其机制.
方法: 24只Wistar大鼠随机分为IR组和SF组. SF组腹腔注射参附注射液, 10 mL/kg. IR组大鼠给予相同剂量的生理盐水. 两组均采用Pringle's法阻断肝门缺血15 min再灌注1 h、3 h, 测定血浆血栓素B2(thromboxane B2, TXB2)、6-酮-前列腺素F1α(6-keto-PGF1α)、肝组织NF-κB p65表达和肝组织匀浆GSH含量, 及观察肝组织形态学改变.
结果: 再灌注3 h SF组血浆TXB2低于IR组(118.7±19.1 vs 386.3±282.7, P>0.05), 6-keto-PGF1α高于IR组(1081.7±282.7 vs 960.0±209.9, P>0.05), 二者比值TXB2/6-keto-PGF1α低于IR组(0.11±0.03 vs 0.39±0.24, P<0.05); 再灌注1 h SF组NF-κB p65表达低于IR组(59.33%±11.06% vs 75.83%±11.46%, P<0.05); 而GSH稍高于IR组(47.59±19.07 vs 37.32±4.71, P>0.05). SF组肝实质细胞和线粒体损伤明显减轻.
结论: 参附注射液对肝缺血再灌注损伤有保护作用, 其机制与降低TXA2/PGI2比值, 抑制NF-κB活化有关.
引文著录: 彭松林, 黄勇, 顾玺, 赵阳, 戴朝六. 参附注射液对大鼠肝缺血再灌注NF-κB和PGI2/TXA2的影响. 世界华人消化杂志 2008; 16(2): 203-207
Revised: January 4, 2008
Accepted: January 12, 2008
Published online: January 18, 2008
AIM: To explore the protective effects of ginseng and prepared aconite (Shen Fu) injection on the TXA2/PGI2 and nucleus factorκB (NF-κB) in a rat model of hepatic ischemia-reperfusion (IR).
METHODS: Twenty-four male Wistar rats weighing 200-250 g were randomly divided into Shen Fu (SF) group treated with intraperitoneal SF injection (10 mL/kg) and IR group treated with 0.9% sodium chloride solution (10 mL/kg) as control group. Hepatic ischemia was induced by Pringle's maneuver for 15 minutes, and then reperfusion was performed for one or three hours. Venous blood samples were collected three hours after reperfusion for measurement of TXB2 and 6-keto-PGF1α. Liver tissue samples were collected one or three hours after reperfusion, for measurement of deoxidized glutathione (GSH) and morphological and immunochemical studies.
RESULTS: Plasma TXB2 was lower in the SF group than in the IR group after three-hour reperfusion (118.7 ± 19.1 vs 386.3 ± 282.7, P > 0.05), while 6-keto-PGF1α was higher in the SF group than in the IR group (1081.7 ± 282.7 vs 960.0 ± 209.9, P > 0.05). The ratio of TXB2 and 6-keto-PGF1α (0.11 ± 0.03 vs 0.39 ± 0.24, P < 0.05) was significantly lower in the SF group. Fifteen minutes after ischemia and one hour after reperfusion, NF-κB p65 was expressed in hepatocytes and Kuffer cells. The percentage of NF-κB p65 positive cells in the SF group was significantly lower (59.33% ± 11.06% vs 75.83% ± 11.46%, P < 0.05) and GSH was slightly higher (47.59 ± 19.07 vs 37.32 ±4.71, P > 0.05) than those in the IR group. Three-hour reperfusion fifteen minutes after ischemia caused important histologic alterations in the liver. Marked structural abnormalities were observed in the IR group, such as massive hepatocyte swelling, necrosis, mitochondria edema and vacuolar changes. In the SF group, hepatic tissue injury was significantly improved.
CONCLUSION: Shen Fu injection protects hepatic tissue from ischemia-reperfusion injury by decreasing the ratio of thromboxane A2 and prostacyclin and inhibiting the activation of NF-κB.
- Citation: Peng SL, Huang Y, Gu X, Zhao Y, Dai CL. Effect of ginseng and prepared aconite injection on TXA2/PGI2 and nuclear factor-κB in rat model of hepatic ischemia-reperfusion. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 203-207
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.203
近年研究发现核转录因子κB(nuclear factor-kappaB, NF-κB)在肝脏缺血再灌注损伤中起重要作用, 通过调控多种细胞因子介导缺血再灌注损伤. 而血栓素A2(thromboxane A2, TXA2)和前列环素(prostacyclin, PGI2)是一对互相拮抗的细胞因子, 在肝缺血再灌注时介导微循环障碍等方面有重要作用. 参附注射液由人参, 附子提取物组成, 其有效成分为人参皂甙和乌头类生物碱. 近年来一些研究表明参附注射液对缺血再灌注损伤有保护作用. 本文通过观察参附注射液对TXA2、PGI2和NF-κB的影响探讨参附注射液保护肝缺血再灌注损伤的机制.
Wistar大鼠24只, 购自中国医科大学附属第二医院实验动物中心. 参附注射液为雅安三九药业有限公司赠与, 药物批号031115. 测定6-keto-PGF1a和TXB2试剂盒购自北京解放军总医院科技开发中心放免所, 测定NF-κB p65所需的兔抗大鼠NF-κB p65 mAb、即用型SP免疫试剂盒和DAB显色试剂盒购自中国北京中山生物技术有限公司. GSH试剂盒购自南京建成生物工程研究所.
1.2.1 动物分组与给药: 24只大鼠随机分为肝缺血再灌注组(IR组, n = 12)和参附注射液加肝缺血再灌注组(SF组, n = 12). SF组给予参附注射液10 mL/kg, ip, 1 次/d, 连续给药6 d, 第6天于手术前30 min给药. IR组大鼠同样方法给予相同剂量的生理盐水. 两组均于第6天手术, 给药期间常规自由喂养, 给水.
1.2.2 动物模型及取材: 术前12 h禁食, 自由饮水. 10%水合氯醛3 mL/kg ip麻醉后, 剔除腹部体毛, 局部消毒, 取腹正中切口开腹, 开腹后离断肝周韧带, 包括镰状韧带、肝胃韧带, 冠状韧带, 消除肝脏侧枝循环. 用Pringle's法(无创伤微血管夹夹闭门静脉、肝动脉、胆总管)使肝缺血, 持续15 min后松开血管夹, 恢复肝脏血供, 然后关腹, 再灌注3 h再次开腹. 先取一次性5 mL无菌注射器吸取消炎痛-EDTANa2 0.2 mL, 自下腔静脉肝下段快速抽取静脉血3 mL, 即刻在空针内颠倒混匀, 3500 r/min、4 ℃离心15 min, 分离血浆-20 ℃保存, 待测血浆血栓素B2(thromboxane B2, TXB2)和6-酮-前列腺素F1a(6-keto-prostaglandin F1a, 6-keto-PGF1a). 快速取约1 cm×1 cm×0.5 cm大小肝组织, 置于40 g/L甲醛溶液中固定, 以用于作组织学和免疫组织化学检查, 待测NF-κB p65; 然后快速切取全肝组织, 置于液氮中冷冻后, 用锡箔纸包裹置于液氮中保存, 再转至-80 ℃冰箱中保存, 待测还原型谷胱甘肽(deoxidized glutathione, GSH).
1.2.3 检测指标: 采用放免法检测TXB2和6-keto-PGF1a, 按6-keto-PGF1a和TXB2试剂盒说明书操作进行. 采用免疫组织化学SP法测定肝组织NF-κB p65表达, 按试剂盒说明书进行操作. 免疫反应阳性细胞为细胞核或细胞质染成棕黄色或有棕黄色颗粒沉积, 用双盲法在每张切片中选取有代表性的区域, 在高倍镜(×400)下观察, 随机计数5个视野中阳性细胞数占总细胞的百分数取其均值. 肝组织中GSH水平的测定, 用电子天平称取冰冻肝脏组织100 mg, 先用比色法按考马斯亮兰试剂盒说明书操作, 测定肝组织匀浆的蛋白含量. 样品蛋白含量(g/L) = (测定管吸光度/标准管吸光度)×标准管浓度(g/L). 按GSH试剂盒说明书进行操作, 比色法测定 GSH含量: 组织匀浆中GSH(mg/gprot) = (测定管吸光度A-测定空白管吸光度A)/(标准管吸光度A-空白管吸光度A)×标准管浓度(0.5 mmol/L)×GSH分子质量(307)/组织蛋白含量(g/L). HE染色, 采用光学显微镜观察.
统计学处理 所有测定结果以mean±SD表示, 采用独立样本t检验应用SPSS11.0统计软件进行统计分析, P<0.05差异有统计学意义.
本实验显示肝脏缺血15 min, 再灌注3 h后SF组血浆TXB2浓度较IR组低(P>0.05), 而6-keto-PGF1a浓度升高(P>0.05), TXB2/6-keto-PGF1a比值显著降低(P<0.05, 表1).
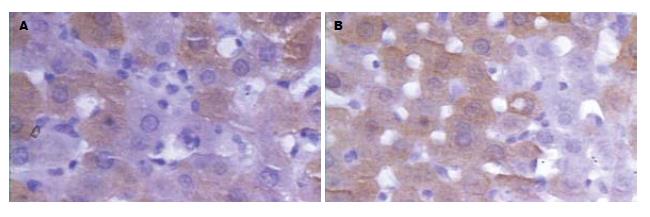
NF-κB p65阳性细胞为细胞核或细胞质染成棕黄色或有棕黄色颗粒沉积, 肝脏缺血再灌注后肝细胞深染, 枯否氏细胞亦可见表达. 肝缺血15 min再灌注1 h, SF组的阳性细胞百分数较IR组显著减低(P<0.05, 表2, 图1).
光镜下IR组肝细胞浊肿、大片坏死, 肝窦和微血管内明显淤血. SF组肝窦内淤血和组织损伤明显减轻, 可见小灶状坏死.
研究表明, 肝脏缺血再灌注损伤首先表现的是微循环障碍, 具有血管活性的细胞因子导致的微循环收缩是导致肝缺血再灌注损伤的一个重要因素. Kondo et al[1]报告, 在肝脏缺血期, 常温下缺血20 min就导致肝血窦直径和窦后小静脉直径在缺血末分别缩小25%和20%, 而且缺血后的肝功能障碍与这种微循环的收缩有关. TXA2和PGI2是花生四烯酸的两个产物, PGI2具有很强的扩血管作用, 同时通过升高cAMP加强渗透屏障. 内源性PGI2的反应性血管舒张作用维持比较短暂, 更为重要的是PGI2可能激活依赖Ca+激活的K+通道和依赖ATP激活的K+通道[2-3], 这些离子通道的开放可使细胞膜超极化、减少细胞内钙超载和起到持久舒张血管的作用[4-6]. 而TXA2是一种很强的缩血管物质, 增加微血管的通透性. 研究表明缺血再灌注后PGI2的释放下降[7]或TXA2的释放增加, 在再灌注损伤中起着重要作用[8]. 肝缺血再灌注时TXA2明显升高, 早期更趋明显, 晚期下降; PGI2的含量亦增高, 但增高的梯度远低于TXA2; TXA2/PGI2比值在肝缺血再灌注早期增高明显, 再灌注24 h接近正常[9]. 用TXA2合成酶抑制剂抑制TXA2的释放或用受体拮抗剂阻断TXA2效应[10], 用PGI2拟似剂[8]或通过提高内源性PGI2水平[7], 都可起到防护缺血再灌注损伤的作用. Xiao et al[2]报告, 当血栓素受体缺乏时也并不减轻心脏的缺血再灌注损伤, 而当PGI2受体缺乏时却明显加重心脏缺血再灌注损伤; 内源性PGI2水平下降比TXA2水平升高更易导致再灌注后的组织损伤. 因此, 改善PGI2与TXA2二者比例失衡是防护缺血再灌注损伤的一个重要机制.
NF-κB是1986年Sen et al[11]首次从B淋巴细胞核抽提物中检测到的一种核蛋白因子, 是细胞内最重要的核转录因子. 静息状态下, NF-κB多以p50和p65二聚体与其抑制蛋白IκB相结合而存在胞质, 呈无活性状态[12]. 外源性刺激如脂多糖、缺血再灌注和TNF-α等通过信号转导引起IκB降解, 导致NF-κB-IκB复合物解体, NF-κB活化, 借助于被暴露出来的核定位信号进入细胞核, 在核内与靶基因的特异序列结合并启动转录发挥其调控作用[12]. 目前研究表明NF-κB是缺血再灌注损伤过程中的一个关键环节, 主要通过与核内的特异序列结合调节IL-1、IL-6、TNF-α、iNOS和ICAM-1等多种相关炎症因子介导缺血再灌注损伤[13-14], 而且NF-κB与其特异调节基因序列的结合活性与肝脏缺血再灌注损伤程度有直接关系, 缺血再灌注1 h至2 h, NF-κB结合的活性较强, 缺血再灌注4 h NF-κB结合活性减弱[15]. 缺血再灌注后NF-κB活化上调了炎性介质表达从而增加中性粒细胞浸润导致肝脏炎症反应[16]. 通过抑制剂抑制其活化或抑制其与特异性调控序列结合可以明显改善肝脏缺血再灌注损伤[16-17]. 同时NF-κB是缺血再灌注时导致肝脏损伤的另一重要因素枯否氏细胞激活的关键因子, 肝缺血时间越长, 枯否氏细胞NF-κB激活越明显, 枯否氏细胞培养上清TNF-α含量越高[18]. 一些研究还证实NF-κB参与环氧合酶-2(cyclooxygenase 2, COX-2)和磷脂酶A2(phospholipase A2, PLA2)的调控[19-20], 而后二者调节花生四烯酸代谢和前列腺类物质的两个关键酶. 因此, NF-κB是防护缺血再灌注损伤的一个重要靶点.
本实验大鼠肝脏在缺血15 min再灌注3 h后出现明显的组织损伤, 肝细胞肿胀、坏死; 电镜下大量线粒体水肿和空泡变性. 给予参附注射液后再灌注1 h时NF-κB p65阳性细胞明显减少; 再灌注3 h时TXA2降低和PGI2升高从而PGI2与TXA2二者的比例升高, 同时在再灌注3 h组织损伤明显减轻. 提示参附注射液通过抑制NF-κB活化、改善PGI2与TXA2二者的比例失衡保护大鼠肝脏缺血再灌注损伤; 而PGI2与TXA2水平的改变是否是由于NF-κB调节COX-2和PLA2的结果及其机制有待进一步研究. 作为体内另一种重要的抗缺血再灌注损伤的因子, GSH可在多种氧化应激中对抗氧自由基的损害, 减轻组织损伤. 虽然SF组GSH水平稍高于IR组, 但本实验结果尚不能证实参附注射液的保护作用通过GSH途径.
近年研究发现一些中药对脏器的缺血再灌注损伤具有明显的保护作用, 参附注射液就是其中有代表性的药物之一. 与其他保护性药物相比, 他可多环节、多方面保护上述脏器的缺血再灌注损伤. 但是, 参附注射液对HIRI的作用及机制, 尤其是对NF-kB/IkB, 对花生四烯酸代谢所产生的多个细胞因子的作用尚不清楚.
王鲁, 副教授, 复旦大学附属中山医院肝外科, 复旦大学肝癌研究所
目前关于NF-kB、花生四烯酸代谢产物(包括前列腺素类和白介素类)及磷脂酶A2和环氧合酶在缺血再灌注损伤中的作用是缺血再灌注损伤研究的热点之一. 本文介绍了参附注射液对NF-kB的抑制作用和改善血栓素A2/前列环素的比例, 但对其代谢通路中关键酶环氧合酶的作用及调节机制有待进一步研究.
张汝鹏 et al的研究提示TXA2/PGI2在缺血再灌注损伤的作用不是单纯的TXA2升高或PGI2降低, 主要是TXA2/PGI2比值升高. 吴刚和徐均 et al的研究均表明NF-kB活化是导致缺血再灌注损伤的关键点之一, 抑制NF-kB活化可以减轻脏器缺血再灌注损伤.
本文的结果提示肝脏外科手术后应用参附注射液可以减轻肝脏的再灌注损伤.
本文缺乏新意, 建议讨论重点, 表明文章有何新发现, 与以往文章有何不同.
编辑: 李军亮 电编:何基才
| 1. | Kondo T, Todoroki T, Hirano T, Schildberg FW, Messmer K. Impact of ischemia-reperfusion injury on dimensional changes of hepatic microvessels. Res Exp Med (Berl). 1998;198:63-72. [PubMed] |
| 2. | Xiao CY, Hara A, Yuhki K, Fujino T, Ma H, Okada Y, Takahata O, Yamada T, Murata T, Narumiya S. Roles of prostaglandin I(2) and thromboxane A(2) in cardiac ischemia-reperfusion injury: a study using mice lacking their respective receptors. Circulation. 2001;104:2210-2215. [PubMed] |
| 3. | Schubert R, Serebryakov VN, Mewes H, Hopp HH. Iloprost dilates rat small arteries: role of K(ATP)- and K(Ca)-channel activation by cAMP-dependent protein kinase. Am J Physiol. 1997;272:H1147-H1156. [PubMed] |
| 4. | Node K, Kitakaze M, Kosaka H, Minamino T, Hori M. Bradykinin mediation of Ca(2+)-activated K+ channels regulates coronary blood flow in ischemic myocardium. Circulation. 1997;95:1560-1567. [PubMed] |
| 5. | Gross GJ, Auchampach JA. Blockade of ATP-sensitive potassium channels prevents myocardial preconditioning in dogs. Circ Res. 1992;70:223-233. [PubMed] |
| 6. | de Wit C, Bolz SS, Pohl U. Interaction of endothelial autacoids in microvascular control. Z Kardiol. 2000;89 Suppl 9:IX/113-116. [PubMed] |
| 7. | Myers SI, Horton JW, Hernandez R, Walker PB, Vaughan WG. Pentoxifylline protects splanchnic prostacyclin synthesis during mesenteric ischemia/reperfusion. Prostaglandins. 1994;47:137-150. [PubMed] |
| 8. | Jiang XW, Kambara K, Gotoh N, Nishigaki K, Fujiwara H. Effects of low-dose Beraprost sodium, a stable prostaglandin I2 analogue, on reperfusion injury to rabbit lungs. Am J Respir Crit Care Med. 1998;158:1669-1675. [PubMed] |
| 9. | 张 汝鹏, 王 殿昌, 邢 福成. 大鼠肝缺血再灌注损伤时血栓素A2和前列环素变化及川芎嗪的作用. 中国中西医结合外科杂志. 1997;3:393-395. |
| 10. | Shirabe K, Kin S, Shinagawa Y, Chen S, Payne WD, Sugimachi K. Inhibition of thromboxane A2 activity during warm ischemia of the liver. J Surg Res. 1996;61:103-107. [PubMed] |
| 11. | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences. Cell. 1986;46:705-716. [PubMed] |
| 12. | Arenzana-Seisdedos F, Turpin P, Rodriguez M, Thomas D, Hay RT, Virelizier JL, Dargemont C. Nuclear localization of I kappa B alpha promotes active transport of NF-kappa B from the nucleus to the cytoplasm. J Cell Sci. 1997;110:369-378. [PubMed] |
| 13. | Schmidt KN, Traenckner EB, Meier B, Baeuerle PA. Induction of oxidative stress by okadaic acid is required for activation of transcription factor NF-kappa B. J Biol Chem. 1995;270:27136-27142. [PubMed] |
| 15. | Xu J, Yang Z, Zeng J. Role of NF-kappa B in liver ischemia reperfusion injury of rats. J Huazhong Univ Sci Technolog Med Sci. 2003;23:158-160. [PubMed] |
| 18. | Serracino-Inglott F, Habib NA, Mathie RT. Hepatic ischemia-reperfusion injury. Am J Surg. 2001;181:160-166. [PubMed] |
| 19. | Lappas M, Permezel M, Georgiou HM, Rice GE. Regulation of phospholipase isozymes by nuclear factor-kappaB in human gestational tissues in vitro. J Clin Endocrinol Metab. 2004;89:2365-2372. [PubMed] |
| 20. | Lin CC, Hsiao LD, Chien CS, Lee CW, Hsieh JT, Yang CM. Tumor necrosis factor-alpha-induced cyclooxygenase-2 expression in human tracheal smooth muscle cells: involvement of p42/p44 and p38 mitogen-activated protein kinases and nuclear factor-kappaB. Cell Signal. 2004;16:597-607. [PubMed] |