修回日期: 2008-01-08
接受日期: 2008-01-13
在线出版日期: 2008-01-18
目的: 研究结直肠癌中的PTEN、ERK2及p27kip1蛋白的表达及相互关系, 初步探讨他们在结直肠癌发生发展中的生物学意义.
方法: 用免疫组织化学染色快捷法, 检测40例结直肠癌组织、18例结直肠腺瘤、13例结直肠正常黏膜中PTEN蛋白、p27kip1和ERK2蛋白的表达, 比较PTEN蛋白表达与临床病理指标的关系, 及其与p27kip1、ERK2蛋白表达的相关性.
结果: 结直肠癌癌组织PTEN, ERK2和p27kip1蛋白表达的阳性率与腺瘤及正常组织间比较差异有显著性(57.5% vs 72.2%, 100%; 70.0% vs 61.1%, 23.1%; 62.5% vs 77.8%, 100%; P<0.05); PTEN蛋白表达强度与ERK2蛋白表达强度之间呈负相关(r = -0.452, P<0.05), 与p27蛋白表达强度呈正相关(r = 0.379, P<0.05); PTEN, p27kip1蛋白与结直肠癌分化程度、淋巴结转移及Dukes分期相关(P<0.05); ERK2蛋白随结直肠癌淋巴结转移、Dukes分期的进展而增高.
结论: 抑癌基因PTEN的表达与结直肠癌生物学行为密切相关; 在结直肠癌发生、发展过程中, 可能由于PTEN蛋白的低表达或失表达抑制p27kip1蛋白表达及Ras/Raf/MEK/ERK信号通路的异常激活, 使细胞发生癌变, 并促进癌变细胞的浸润、转移.
引文著录: 张沛怡, 苏连明, 杜明, 胡立华, 李庆华. 结直肠癌PTEN基因表达及与ERK2、p27kip1的相关性. 世界华人消化杂志 2008; 16(2): 156-162
Revised: January 8, 2008
Accepted: January 13, 2008
Published online: January 18, 2008
AIM: To study the expression of phosphatase and tensin homology deleted on chromosome ten (PTEN), ERK2 and p27kip1 protein in colorectal cancer, and its correlation with the progression of colorectal cancer.
METHODS: Expressions of PTEN, p27kip1 and ERK2 proteins were detected by immunohistochemistry in 40 samples of colorectal cancer tissue, 18 samples of colorectal adenoma tissue and 13 samples of normal colorectal tissue. PTEN protein expression was compared with the clinico-pathologic parameters related to p27kip1 and ERK2.
RESULTS: The positive expression rate of PTEN was significantly lower in colorectal cancer tissue (57.5%) than in colorectal adenoma tissue (72.2%) and normal tissue (100%) (P < 0.05). The expression of PTEN was related with the loss of tumor differentiation, lymph node metastasis and Duke's stage (P < 0.05). The positive expression rate of ERK2 was higher in colorectal cancer tissue (70.0%) than in colorectal adenoma tissue (61.1%) and normal tissues (23.1%) (P < 0.05). The expression of ERK2 increased with lymph node metastasis and Duke's stage. The positive expression rate of p27kip1 was lower in colorectal cancer tissue (62.5%) than in colorectal adenoma tissue (77.8%) and normal tissue (100%)(P < 0.05), and the expression level of p27kip1 was related to lymph node metastasis and Duke's stage (P < 0.05). PTEN was negatively correlated with ERK2 (r = -0.452, P < 0.05). The expression of PTEN was positively related with the expression of p27kip1 in colorectal cancer(r = 0.379, P < 0.05).
CONCLUSION: The expression level of PTEN protein is closely related to the biological behavior of colorectal cancer. Decreased or deleted PTEN protein expression may be able to inhibit the over-activation of p27kip1 and Ras/Raf/MEK/ERK signaling pathways, resulting in carcinogenesis, invasion and metastasis.
- Citation: Zhang PY, Su LM, Du M, Hu LH, Li QH. Expression of PTEN and its correlation with ERK2 and p27kip1 in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 156-162
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/156.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.156
肿瘤的发生、发展是一个复杂的生物学过程, 有多种基因的共同参与作用, 而细胞周期失控和Ras/Raf/MEK/ERK信号通路的异常激活与肿瘤发生发展密切相关. PTEN(又称MMAC1/TEP1)基因作为第一个被发现的具有双重特异性磷酸酶活性的肿瘤抑制基因, 在细胞的生长发育、凋亡、迁移、信号传递等方面起着重要的调控作用, 而且在肿瘤发生发展及转移中均起抑制作用[1]. 细胞外信号调节激酶(ERK)级联是细胞内重要的信号转导途径, 他将细胞外刺激传递至细胞核, 参与细胞的生长、发育、分化等一系列生理过程, 其异常表达在细胞的恶性转化和肿瘤的发生发展中起重要作用[2]. p27kip1是细胞周期G1期重要的调控因子, p27kip1是G1期向S期转换的负向调空因子, p27kip1异常表达与肿瘤的发生、发展密切相关, 并认为他是一种肿瘤标志物及预后因子[3]. PTEN及ERK2、p27kip1蛋白表达在结直肠癌的关系, 国内未见报道. 本文应用免疫组化快捷法检测PTEN及ERK2、p27kip1蛋白表达状况, 探讨他们在结直肠癌发生、发展中的作用及临床意义.
实验组: 标本均为2006-01/2007-06在黑龙江省医院普外科接受手术治疗的原发性结直肠癌患者石蜡切片, 共40例. 术前均未做化、放疗, 有完整的临床资料. 40例大肠癌患者男28例, 女12例. 年龄37-81(平均年龄63.8)岁. 肿瘤直径为手术切除标本中所测得的肿瘤最大直径; 肿瘤部位: 回盲部3例, 升结肠10例, 横结肠3例, 降结肠4例, 乙状结肠4例, 直肠16例; 淋巴结转移24例, 无淋巴结转移16例; Dukes分期A期7例、B期9例、C期14例、D期10例; 按照WHO大肠腺癌分化程度标准高分化12例, 中分化组19例, 低分化9例. 18例结肠腺瘤及13例正常结肠黏膜标本取自2007-01/2007-06黑龙江省医院消化内科内镜结肠镜下高频电凝电切术的息肉标本, 均经病理证实. 鼠抗人ERK2(浓缩型)mAb购自北京博奥森生物技术公司, 鼠抗人PTEN(即用型)mAb、鼠抗人p27kip1(即用型)mAb、快捷法通用型二抗、氨基联苯胺(DAB)显色试剂盒均购自福州迈新生物技术开发公司.
取上述存档的石蜡包埋组织块, 制成4 μm厚的连续组织切片. 每份标本行常规HE染色对照.
1.2.1 免疫组化染色: 采用快捷法, 按试剂盒说明书进行. 甲醛溶液固定的石蜡组织切片经二甲苯脱蜡和梯度酒精(分别为1000 mL/L, 900 mL/L, 700 mL/L)脱水后, PTEN、ERK2抗原修复用pH6.0柠檬酸缓冲液微波处理15 min, p27kip1抗原修复用EDTA液(10 mL:490 mL)微波处理20 min, 室温下自然降温, PBS冲洗3次, 每次3 min(3 min×3)后加入一抗, 于室温下孵育60 min, PBS冲洗后(3 min×3), 滴加二抗, 室温下孵育15 min, PBS冲洗后(3 min×3). 用DAB显色5-10 min, 充分水洗. 苏木素复染、脱水、透明、中性树胶封片.
1.2.2 结果判定: 免疫组化染色评分判定: 根据以下3个方面判定[4]: (1)染色密度评分: 0, 无染色; 1, 弱染色; 2, 中染色; 3, 强染色; (2)阳性细胞百分比评分: 0, 0%; 1, <10%; 2, 10%-50%; 3, 51%-90%; 4, >90%; (3)染色方式评分: 0, 无染色; 1, 散在染色; 2, 局灶染色; 3, 弥漫染色. 每例标本染色积分 = (1)×(2)×(3). 阴性为0分, 阳性为1-36分.
统计学处理 百分率比较用χ2检验和Fisher's精确检验, 相关分析采用Spearman等级相关分析, 所有统计处理均在SPSS10.0统计软件包中完成. 检验标准P<0.05有统计学意义.
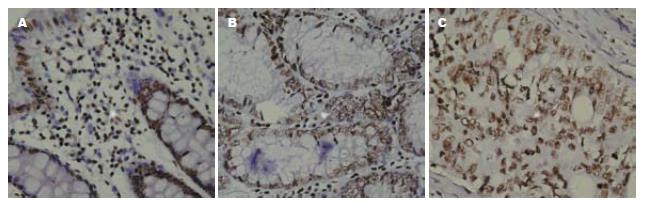
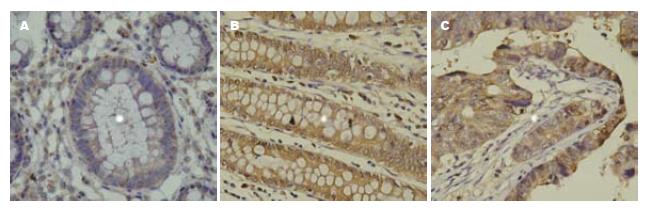
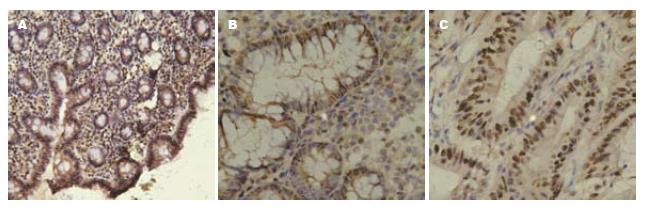
PTEN表达主要定位胞核中, 呈棕黄色, 胞质中偶有少量表达(图1). PTEN在正常黏膜、腺瘤、结直肠癌组织中阳性率分别为100%(13/13)、72.2%(13/18)、57.5%(23/40), 组间比较有显著性差异(χ2 = 8.40, P<0.05, 表1),即PTEN在结直肠癌组织中表达减低. ERK2表达定位于胞质中, 呈棕黄色, 胞核中无表达(图2), ERK2在正常黏膜、腺瘤、结直肠癌组织中阳性率分别为23.1%(3/13)、61.1%(11/18)、70.0%(28/40), 组间比较有显著性差异(χ2 = 8.98, P<0.05, 表1),即ERK2在结直肠癌组织中表达升高. p27kip1表达主要定位胞核中, 呈棕黄色, 胞质中亦有少量表达(图3), p27kip1在正常黏膜、腺瘤、结直肠癌组织中阳性率分别为100%(13/13)、77.8%(14/18)、62.5%(25/40), 组间比较有显著性差异(χ2 = 7.29, P<0.05, 表1), 即p27kip1在结直肠癌组织中表达减低.
| 组织类型 | n | PTEN | ERK2 | p27kip1 | |||
| - | +(%) | - | +(%) | - | +(%) | ||
| 正常肠黏膜 | 13 | 0 | 13(100) | 10 | 3(23.1) | 0 | 13(100) |
| 结肠腺瘤 | 18 | 5 | 13(72.2) | 7 | 11(61.1) | 4 | 14(77.8) |
| 结直肠癌 | 40 | 17 | 23(57.5) | 12 | 28(70.0) | 15 | 25(62.5) |
本组40例结直肠癌的PTEN、ERK2及p27kip1蛋白表达随组织病理分化程度,侵袭转移性高低不同而表现不同的阳性率. PTEN、p27kip1蛋白表达与患者性别、年龄、肿瘤大小、肿瘤位置间差异均无显著性, 与Dukes分期、分化程度、淋巴结转移相关(P<0.05). ERK2蛋白表达与患者性别、年龄、肿瘤大小、肿瘤位置及肿瘤分化程度间差异均无显著性, 与Dukes分期、淋巴结转移相关(P<0.05, 表2).
| 临床病理学特征 | n | PTEN | χ2P | ERK2 | χ2P | p27kip1 | χ2P | ||||
| - | +(%) | - | +(%) | - | +(%) | ||||||
| 性别 | 男 | 28 13 | 15(53.6) | 0.59 | 10 | 18(64.3) | 0.69 | 9 | 19(67.9) | 0.51 | |
| 女 | 12 | 4 | 8(66.7) | >0.05 | 2 10(83.3) | >0.05 | 6 | 6(50.0) | >0.05 | ||
| 年龄 | ≥60 | 22 | 12 | 10(44.5) | 2.90 | 9 | 13(59.1) | 2.77 | 8 | 14(63.6) | 2.69 |
| <60 | 18 | 5 | 13(72.2) | >0.05 | 3 | 15(83.3) | >0.05 | 7 | 11(61.1) | >0.05 | |
| 肿瘤大小 | ≥5 cm | 23 | 8 | 15(65.2) | 1.31 | 6 | 17(73.9) | 0.39 | 9 | 14(60.9) | 0.06 |
| <5 cm | 17 | 9 | 8(42.1) | >0.05 | 6 | 11(64.7) | >0.05 | 6 | 11(64.7) | >0.05 | |
| 肿瘤位置 | 右半结肠 | 15 | 6 | 9(60.0) | 2.79 | 6 | 9(60.0) | 3.94 | 7 | 8(53.3) | 3.48 |
| 左半结肠 | 9 | 2 | 7(77.8) | 4 | 5(55.6) | 1 | 8(88.9) | ||||
| 直肠 | 16 | 9 | 7(43.8) | >0.05 | 2 | 14(87.5) | >0.05 | 7 | 9(56.3) | >0.05 | |
| Dukes分期 | A | 7 | 1 | 6(85.7) | 9.55 | 5 | 1(14.3) | 13.95 | 1 | 6(85.7) | 10.69 |
| B | 9 | 2 | 7(77.8) | 3 | 6(66.7) | 2 | 7(77.8) | ||||
| C | 14 | 6 | 8(57.1) | 3 | 12(85.7) | 4 | 10(71.4) | ||||
| D | 10 | 8 | 2(20.0) | <0.05 | 1 | 9(90.0) | <0.05 | 8 | 2(20.0) | <0.05 | |
| 肿瘤分化程度 | 高分化 | 12 | 3 | 9(75.0) | 6.34 | 2 | 10(83.3) | 2.60 | 2 | 10(83.3) | 8.74 |
| 中分化 | 19 | 7 | 12(63.2) | 8 | 11(57.9) | 6 | 13(68.4) | ||||
| 低分化 | 9 | 7 | 2(22.2) | <0.05 | 2 | 7(77.8) | >0.05 | 7 | 2(22.2) | <0.05 | |
| 淋巴结转移 | 无转移 | 16 | 3 | 13(81.2) | 6.16 | 9 | 7(43.8) | 6.79 | 3 | 13(81.2) | 4.00 |
| 有转移 | 24 | 14 | 10(41.7) | <0.05 | 3 | 21(87.5) | <0.05 | 12 | 12(50.0) | <0.05 | |
统计学分析表明, 结直肠癌组织PTEN蛋白表达与ERK2蛋白表达呈负相关(r = -0.452, P<0.05), PTEN蛋白表达随着结直肠癌淋巴结转移及Dukes分期的进展降低, 而ERK2蛋白表达则增高, 反之亦然(表3).
| PTEN | ERK2 | p27kip1 | 合计 | ||
| - | + | - | + | ||
| - | 1 | 16 | 10 | 7 | 17 |
| + | 11 | 12 | 5 | 18 | 23 |
| 合计 | 12 | 28 | 15 | 15 | 40 |
统计学分析表明, 结直肠癌组织PTEN蛋白表达与p27kip1蛋白表达呈正相关(r = 0.379, P<0.05), PTEN蛋白表达与p27kip1蛋白表达都随着结直肠癌分化程度、淋巴结转移及Dukes分期的进展降低, PTEN与p27kip1蛋白表达呈同向趋势(表3).
目前研究认为, 结直肠癌的发生、发展是多因素、多阶段、多因子的复杂过程, 在此过程中癌基因的激活与抑癌基因的丢失或表达失调是其重要特征. 抑癌基因PTEN是1997年Steck et al 3个研究小组分别发现并命名的第1个具有磷酸酯酶活性的抑癌基因. 该基因定位于染色体10q23.3上, 其主要结构功能区位于N端, 是由403个氨基酸组成的一条多肽链, 具有与细胞张力蛋白和辅助蛋白同源的序列, 其编码的蛋白具有蛋白性磷酸酯酶活性和脂性磷酸酯酶活性, 参与细胞生长调节, 并在肿瘤细胞浸润、血管发生及肿瘤转移中起一定作用[5]. 大多数研究表明, 在人类许多恶性肿瘤细胞中存在PTEN的杂合性丢失(LOH), 并与肿瘤进展有关[6]. 本研究结果显示, 正常黏膜、腺瘤组PTEN阳性率显著高于结直癌组织中的阳性率(P<0.05), 提示PTEN蛋白的表达异常可能参与结直肠黏膜恶性转化过程. 结合本组结直肠癌临床病理学资料分析发现, PTEN蛋白表达与结直肠癌许多病理参数都有很强的相关性. 同时本组研究显示PTEN蛋白的表达与癌组织分化程度、淋巴结转移及Dukes分期密切相关(P<0.05), 以上结果表明在高侵袭性、高转移性的结直肠癌PTEN的表达明显降低甚至无表达, 由此提示PTEN表达的下调可能是肿瘤的侵袭程度和转移增加的原因, 对结直肠癌的发展起促进作用, 在一定程度上反映了结直肠癌细胞的侵袭和转移能力等生物学行为特征.
细胞外信号调节激酶(extracellular signal regulated kinase, ERK)是丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)中一条主要的和经典的并且与人类癌症关系最为密切的途径, 定位于1号染色体. 1990年, Boulton
et al[7]分离鉴定了一种蛋白激酶的C-DNA序列, 并证实多种细胞外信号均可激活该蛋白激酶, 因此将其命名为细胞外信号调节激酶1(ERK1), 分子量为44 kDa. 1991年, Boulton et al[8]又鉴定了大鼠ERK亚家族的一个主要成员ERK2, 分子量为42 kDa. 实验证实ERK1和ERK2的氨基酸序列有90%相同, 且在体外作用底物相同, 提示二者有功能上的重叠[9]. ERK信号级联是迄今为止研究最为透彻的一条信号转导通路, 是一种保守的丝/苏氨酸蛋白激酶, 广泛存在人类的多种细胞. 许多生长因子、细胞素、激素及介导有丝分裂、分化的信号均可激活ERK, 使其发生磷酸化而活化, 进而调节细胞周期、分化, 并且具有抵抗细胞调亡的作用, 能将多种细胞外信号通过磷酸化的活化方式逐级传递至细胞核, 最终对细胞的增殖、分化和调亡产生影响[10]. 本实验研究发现, ERK2蛋白表达在结直肠癌中最高, 其次为结直肠腺瘤, 正常黏膜组织中最低(P<0.05), 提示ERK2与结直肠癌的发生有关. 本实验数据表明ERK2蛋白表达与结直肠癌的Dukes分期, 淋巴结转移均显著有关(P<0.05), 提示ERK2过量表达与肿瘤分期、侵袭性密切相关.
p27kip1是Polyak et al[11]于1994年发现的新的CKI基因(细胞周期蛋白依赖性激酶抑制剂, cyclin-dependent kinase inhibitors), CKI定位于12p12-12p13.1交界处, 包含两个有编码功能的外显子和一个无功能的外显子及一个内含子, p27kip1 cDNA具有编码198个氨基酸组成的蛋白质. p27kip1蛋白是高度保守的蛋白分子, 研究发现p27kip1蛋白具有多种生物学功能, 他可直接抑制Cyclin-CDK(细胞周期素-细胞周期蛋白依赖性激酶)复合物的生物学活性从而阻止细胞通过G1/S期转换的"关卡", 同时还可以作为细胞外刺激信号的潜在媒介来调控细胞周期. p27kip1对靶分子的作用发生于细胞核内, p27kip1在胞浆内的异常定位可导致p27kip1失活及降解增加[12-13]. 本实验研究发现, p27kip1在正常结直肠黏膜中的表达率为100.0%(10/10), 在结肠腺瘤中为77.8%(14/18); 而在结直肠癌中表达率为62.5%(25/40)(P<0.05); 显示p27kip1蛋白表达下降与结直肠癌的发生有关, 提示p27kip1在结直肠癌的发生中可能起重要作用. 本实验研究亦发现p27kip1蛋白表达与结直肠癌的分化程度、Dukes分期. 淋巴结转移均显著有关(P<0.05). p27kip1蛋白水平在低分化、有淋巴结转移时降低, 提示p27kip1蛋白表达率降低的结直肠癌更易发生淋巴结及远处转移和肌层浸润, p27kip1蛋白表达与肿瘤的恶性程度负相关.
结直肠癌组织中PTEN与ERK2蛋白表达的相关性及意义: 文献报道PTEN可负调控多种细胞信号传导通路[14-15], 从而调节正常细胞的生长发育及抑制肿瘤的发生发展, 然而目前对其研究多集中在: (1)通过使PIP3去磷酸化负调控PIP3/Akt途径调节细胞的增殖与凋亡平衡; (2)通过对局灶黏附激酶(FAK)的去磷酸化, 负调控FAK-P130通路. 但关于PTEN蛋白对ERK所介导的信号级联的调节尚有分歧, Tamura et al[15]认为PTEN蛋白可阻断整合素、表皮生长因子(EGF)和血小板源性生长因子(PDGF)介导的ERK通路的活化, 从而抑制细胞的增殖和迁移. 但Davies et al[16]发现, 在表皮生长因子(EGF)刺激的胶质瘤细胞系U251中表达的PTEN蛋白并不能抑制ERK磷酸化. 本实验结果显示: 在正常黏膜->增生->息肉->腺瘤->不典型增生->结肠癌的发生过程中, PTEN阳性表达率呈递减趋势, 而ERK2蛋白表达呈升高趋势; PTEN与ERK2之间表达呈负相关关系, 提示ERK2的上调和PTEN的下调在结直肠癌的发生、发展和转移过程中起着重要的作用. 可能是由于PTEN低表达不能有效抑制ERK信号通路的异常激活, 使细胞异常增殖并恶性转化. 因此, 联合检测PTEN和ERK2的表达对评估结直肠癌的发生发展具有重要意义, 可作为判断结直肠癌病理生物学行为和预后的参考指标. 同时, 我们推测, 通过磷酸酶激活剂或酪氨酸酶抑制剂, 阻断ERK信号通路的异常激活, 抑制细胞异常增殖及肿瘤转移, 将可能成为未来治疗结直肠癌的方向.
结直肠癌组织中PTEN与p27kip1蛋白表达的相关性及意义: 本文研究显示, PTEN与p27kip1均对细胞增殖起负性调控作用, 推测两者在肿瘤发生中具有相关性, p27kip1可能是PTEN所调控的重要的下游分子, PTEN通过使p27kip1去磷酸化, 从而降低其在细胞中的分解代谢水平. 因此, 当PTEN表达缺失时p27kip1也表达下降. Gottschalk et al[17]用腺病毒PTEN转染神经胶质瘤细胞后, p27kip1表达明显增高. 进一步用p27kip1反义寡核氨酸阻断p27kip1蛋白产物后, PTEN对细胞增殖的抑制作用明显降低. 说明p27kip1是PTEN发挥抑癌作用的关键调节因子. 但根据Kurose et al[18]报道, 人卵巢癌中PTEN表达与p27kip1表达并无相关性, 提示, 在体内外, 不同组织的PTEN基因调控机制和下游通路等可能存在着差异. 本实验研究结果发现, 结直肠癌中PTEN表达与p27kip1表达呈正相关, 因此, 检测结直肠癌组织中PTEN, p27kip1两者表达状况有助于估计预后, 从而在术后进行生物免疫治疗、介入治疗的综合治疗, 以提高患者的生存率与生存质量, 同时为肿瘤的诊断、判断生物学行为及预后提供更可靠的依据. 本研究显示, PTEN表达与ERK2、p27kip1蛋白表达之间存在明显相关性, 由此提示, PTEN对结直肠癌作用可能是通过ERK2、p27kip1来影响结直肠癌的发生、发展.
PTEN基因作为第一个被发现的具有双重特异性磷酸酶活性的肿瘤抑制基因, 在细胞的生长发育、凋亡、迁移、信号传递等方面起着重要的调控作用, 而且在肿瘤发生发展及转移中均起抑制作用. PTEN作为继p53之后发现的在人类肿瘤中突变率最高的基因, 自1997年发现起就受到众多研究者的关注, 成为研究的热点.
王晓艳, 副教授, 中南大学湘雅三医院消化内科; 向德兵, 讲师, 中国人民解放军第三军医大学大坪医院肿瘤中心
已经证实PTEN基因的表达水平与多数消化系统肿瘤的发生、发展及预后存在相关性, 但其精确作用点、作用机制以及他在消化系统肿瘤发生中的重要性等, 均有待于进一步阐明.
研究发现PTEN在多种肿瘤如胃癌、前列腺癌、乳腺癌等表达下调, 并可负调控多种细胞信号传导通路, 抑制肿瘤细胞生长.
本文检测了抑癌基因PTEN在结肠癌中的表达, 观察其与结肠癌临床病理因素的关系及与p27、ERK2蛋白表达的相关性, 探讨PTEN基因在结肠癌发生发展过程中的作用.
PTEN的抑癌功能及调节细胞信号转导通路的功能可被引入肿瘤的基因治疗, 从而使人工调节PTEN水平及干涉其作用通路成为治疗肿瘤的新的有效方法.
PTEN: 与细胞骨架蛋白Tensin同源, 在第10号染色体有缺失的磷酸酯酶, 亦称在多个进展期肿瘤中均有突变的基因1或称能被TGF-β1(转移生长因子β1-transforming growth factor β1)调节并在上皮细胞富含的磷酸酶.
本文设计基本合理, 结果可靠, 有一定的新颖性, 具有一定临床应用价值.
编辑: 程剑侠 电编:郭海丽
| 2. | Webb CP, Van Aelst L, Wigler MH, Woude GF. Signaling pathways in Ras-mediated tumorigenicity and metastasis. Proc Natl Acad Sci USA. 1998;95:8773-8778. [PubMed] |
| 3. | Palmqvist R, Stenling R, Oberg A, Landberg G. Prognostic significance of p27(Kip1) expression in colorectal cancer: a clinico-pathological characterization. J Pathol. 1999;188:18-23. [PubMed] |
| 4. | Dong M, Nio Y, Sato Y, Tamura K, Song MM, Tian YL, Dong YT. Comparative study of p53 expression in primary invasive ductal carcinoma of the pancreas between Chinese and Japanese. Pancreas. 1998;17:229-237. [PubMed] |
| 5. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] |
| 6. | Rasheed BK, Stenzel TT, McLendon RE, Parsons R, Friedman AH, Friedman HS, Bigner DD, Bigner SH. PTEN gene mutations are seen in high-grade but not in low-grade gliomas. Cancer Res. 1997;57:4187-4190. [PubMed] |
| 7. | Boulton TG, Yancopoulos GD, Gregory JS, Slaughter C, Moomaw C, Hsu J, Cobb MH. An insulin-stimulated protein kinase similar to yeast kinases involved in cell cycle control. Science. 1990;249:64-67. [PubMed] |
| 8. | Boulton TG, Nye SH, Robbins DJ, Ip NY, Radziejewska E, Morgenbesser SD, DePinho RA, Panayotatos N, Cobb MH, Yancopoulos GD. ERKs: a family of protein-serine/threonine kinases that are activated and tyrosine phosphorylated in response to insulin and NGF. Cell. 1991;65:663-675. [PubMed] |
| 9. | Whitmarsh AJ, Davis RJ. Transcription factor AP-1 regulation by mitogen-activated protein kinase signal transduction pathways. J Mol Med. 1996;74:589-607. [PubMed] |
| 10. | Zhan Y, Kim S, Izumi Y, Izumiya Y, Nakao T, Miyazaki H, Iwao H. Role of JNK, p38, and ERK in platelet-derived growth factor-induced vascular proliferation, migration, and gene expression. Arterioscler Thromb Vasc Biol. 2003;23:795-801. [PubMed] |
| 11. | Polyak K, Lee MH, Erdjument-Bromage H, Koff A, Roberts JM, Tempst P, Massague J. Cloning of p27Kip1, a cyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals. Cell. 1994;78:59-66. [PubMed] |
| 12. | Liang J, Zubovitz J, Petrocelli T, Kotchetkov R, Connor MK, Han K, Lee JH, Ciarallo S, Catzavelos C, Beniston R. PKB/Akt phosphorylates p27, impairs nuclear import of p27 and opposes p27-mediated G1 arrest. Nat Med. 2002;8:1153-1160. [PubMed] |
| 13. | Tsuzuki H, Fujieda S, Sunaga H, Narita N, Tokuriki M, Saito H. Expression of p27 and apoptosis in oral leukoplakia. Anticancer Res. 2003;23:1265-1270. [PubMed] |
| 14. | Wu H, Goel V, Haluska FG. PTEN signaling pathways in melanoma. Oncogene. 2003;22:3113-3122. [PubMed] |
| 15. | Tamura M, Gu J, Matsumoto K, Aota S, Parsons R, Yamada KM. Inhibition of cell migration, spreading, and focal adhesions by tumor suppressor PTEN. Science. 1998;280:1614-1617. [PubMed] |
| 16. | Davies MA, Lu Y, Sano T, Fang X, Tang P, LaPushin R, Koul D, Bookstein R, Stokoe D, Yung WK. Adenoviral transgene expression of MMAC/PTEN in human glioma cells inhibits Akt activation and induces anoikis. Cancer Res. 1998;58:5285-5290. [PubMed] |
| 17. | Gottschalk AR, Basila D, Wong M, Dean NM, Brandts CH, Stokoe D, Haas-Kogan DA. p27Kip1 is required for PTEN-induced G1 growth arrest. Cancer Res. 2001;61:2105-2111. [PubMed] |
| 18. | Kurose K, Zhou XP, Araki T, Cannistra SA, Maher ER, Eng C. Frequent loss of PTEN expression is linked to elevated phosphorylated Akt levels, but not associated with p27 and cyclin D1 expression, in primary epithelial ovarian carcinomas. Am J Pathol. 2001;158:2097-2106. [PubMed] |