修回日期: 2008-04-19
接受日期: 2008-04-28
在线出版日期: 2008-07-08
目的: 研究白藜芦醇对饮食诱导的非乙醇性脂肪性肝炎(NASH)小鼠肝脏COX-2表达的影响.
方法: ♂小鼠30只随机分为正常对照组(NC组, n = 10)、高脂喂养组(HF组, n = 10)和高脂喂养白藜芦醇治疗组(HR组, n = 10). NC组给予标准基础饲料, HF组和HR组给予高脂饲料喂养. HR组小鼠高脂喂养8 wk后, 每日给予400 mg/kg白藜芦醇灌胃治疗. HR组和HF组均继续高脂饲料喂养16 wk. 实验结束后处死小鼠并取肝脏组织, 分别用RT-PCR法及免疫印迹法检测肝脏COX-2 mRNA和蛋白的表达.
结果: HF组小鼠出现明显的脂肪性肝炎, HR组小鼠的脂肪性肝炎明显减轻. NC组小鼠肝组织无COX-2 mRNA和蛋白的表达, HF组小鼠肝组织有高水平的COX-2 mRNA和蛋白的表达, 分别为1.48%±0.23%和27.9%±4.6%, HR组COX-2 mRNA和蛋白的表达水平较HF组明显降低, 分别为0.76%±0.18%和11.2%±3.5%, 两组间差异有统计学意义(P<0.01), 但未降至正常.
结论: COX-2在NASH中发挥着重要作用, 白藜芦醇至少部分是通过下调肝脏COX-2的表达达到改善NASH的作用.
引文著录: 肖虎, 张皎月, 郑涓. 白藜芦醇下调小鼠非乙醇性脂肪性肝炎环氧合酶2的表达. 世界华人消化杂志 2008; 16(19): 2092-2096
Revised: April 19, 2008
Accepted: April 28, 2008
Published online: July 8, 2008
AIM: To investigate the effect of resveratrol on gene expression of cyclooxygenase (COX)-2 in mice with diet-induced nonalcoholic steatoheptatitis (NASH).
METHODS: Thirty male C57BL/6J mice were assigned randomly to three groups: normal control group, high fat group (HF group) and high fat resveratrol treatment group (HR group). The mice in normal control group (n = 10) were fed with standard diet. The mice in HF group (n = 10) and in HR group (n = 10) were fed with high fat diet. After 8-week high fat diet, the mice in HR group were fed with resveratrol 400 mg/(kg•d) for 16 wk. Hepatic COX-2 expression was determined using RT-PCR and Western blot.
RESULTS: Steatoheptatitis was discernable in HF group and was markedly alleviated in HR group. COX-2 were not expressed in normal mouse liver. The mRNA expression and protein expression of COX-2 were significantly lower in HR group than those in HF group(0.76% ± 0.18% vs 1.48% ± 0.23%, 11.2% ± 3.5% vs 27.9% ± 4.6%, both P < 0.01), but not returned to normal level.
CONCLUSION: COX-2 may play an important role in NASH pathogenesis. Resveratrol improves NASH at least partly by downregulating expression of COX-2 in the liver.
- Citation: Xiao H, Zhang JY, Zheng J. Resveratrol down-regulates hepatic cyclooxygenase-2 expression in mice with nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2092-2096
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2092.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2092
非乙醇性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一种无过量饮酒史肝实质细胞脂肪变性和脂肪沉积为特征的临床病理综合征, 疾病谱随病程的进展表现为单纯脂肪肝、脂肪性肝炎(nonalcoholic steatohepatitis, NASH)、脂肪性肝纤维化和肝硬化[1-3]. 流行病学研究发现[4], 在美国和其他西方发达国家中20%-30%的成年人具有NAFLD, 这其中又有10%的人达到NASH的诊断标准, 成为严重的公共卫生问题. 在我国随着生活水平的改善和提高, NAFLD和NASH的发病人数也在增加[5]. NAFLD的发病机制并不十分清楚, 但是炎症过程与NAFLD的发生发展有密切关系, NASH时肝脏COX-2表达增加[6-8]. 白藜芦醇是一种多酚类植物抗毒素[9], 具有抗氧化、抗炎等多种作用. 我们观察白藜芦醇是否可以改善饮食诱导的NASH, 并初步探讨其机制, 尤其是对NASH肝组织COX-2表达的影响.
♂4 wk龄SPF级C57BL/6J小鼠30只, 体质量11-13 g, 购于北京维通利华实验动物技术有限公司. 小鼠正常基础饲料购自湖北省实验动物中心, 其脂肪、蛋白质、碳水化合物热卡含量分别为0.10、0.21、0.69. 高脂饮食脂肪(主要是熟猪油)、蛋白质、碳水化合物热卡含量分别为0.59、0.20、0.21. 小鼠随机分为2组, 高脂喂养组20只和正常对照组(NC)10只. NC组给予标准基础饲料, HF组给予高脂饲料喂养. 动物饲养于华中科技大学同济医学院实验动物中心清洁级环境, 明暗周期为12 h, 室温22-26℃, 相对湿度50%-80%, 自由摄食、饮水. 两组小鼠喂养8 wk后, 高脂喂养组分为单纯高脂组(HF, 10只)和白藜芦醇干预组(HR, 10只), 每日给予400 mg/kg白藜芦醇灌胃治疗, NC组和HF组(10只)均给予相同体积生理盐水灌胃. HR组和HF组均继续高脂饲料喂养16 wk.
实验结束时小鼠禁食12 h, 眼眶取血法采血, 分离血清, 采用日本日立7600-020全自动生化分析仪, 测定血清总胆固醇(TC)、三酰甘油(TG); 酶法测定FBG; ELISA法测定胰岛素(Fins). 次日称体质量, 戊巴比妥钠ip麻醉, 迅速取出肝脏称质量后, 一部分用生理盐水清洗后置于-80℃冰箱冻存; 一部分置于40 g/L甲醛液固定, 留待行病理检查. 另取少量剪成小块, 置110℃烘至恒定质量, 精确称取干燥后的肝脏, 磨成细粉, 加氯仿:甲醇(2:1, V/V), 再按上述测定血清脂质的方法测脂质含量.
1.2.1 肝组织COX-2 mRNA表达的测定: 按RNA抽提纯化操作方法提取肝组织总RNA. 提取的RNA通过紫外光分光光度计测定260和280 nm吸光度值, 计算RNA纯度和浓度. 将RNA逆转录成cDNA, 再进行PCR扩增引物为Primer5.0软件自行设计. 使用GAPDH作为内参照. 引物序列: COX-2正义链5'-CTTAGCACAACAGA-3, 反义链5'-CGGAAGTGAGA-3; GAPDH正义链5'-TCCCTCAAGATTGTCAGCAA-3, 反义链5'-AGATCCACAACGGATACATT-3. 目的片段长度COX-2为253 bp; GAPDH为308 bp. 反应条件: 94℃预变性5 min; 94℃变性30 s, 退火30 s, 72℃延伸60 s, 循环28-38次; 最后72℃延伸10 min. 各基因退火温度和循环次数分别为: COX-2 55℃, 36个循环; GAPDH 55℃, 28个循环. 扩增产物进行琼脂糖凝胶电泳, 紫外灯下拍照, 使用GAS凝胶图像处理系统分析吸光度值, 以GAPDH为内参照, 计算待测基因mRNA相对表达量.
1.2.2 肝脏COX-2蛋白表达的测定: 取-80℃保存的各组动物肝组织100 mg, 提取细胞膜蛋白, 经SDS-聚丙酰胺凝胶电泳, 采用兔抗小鼠的COX-2多克隆抗体(购自美国CST生物工程公司), 测定小鼠肝脏的COX-2蛋白水平, 一抗稀释度为1:1000, β-actin表达水平作为内对照, 利用图像分析系统扫描确定X光片上杂交条带的相对光密度值.
统计学处理 应用SPSS13.0软件进行统计分析, 数据采用mean±SD表示. 组间比较采用单因素方差分析, 多组间两两比较采用q检验, P<0.05为有统计学意义.
与NC组相比, HF组FBG、TG、TC明显升高, 同时Fins升高, 白藜芦醇治疗后, FBG、TG降至正常, TC略有下降, 但未降至正常(表1).
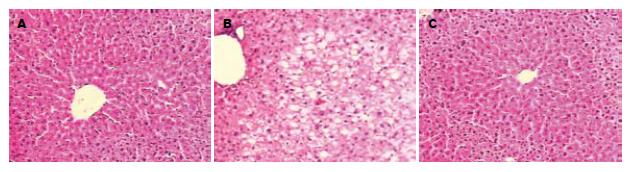
大体形态观察, 正常组大鼠肝脏外观呈红褐色, 表面光滑; HF组大鼠肝脏体积明显增大, 呈黄褐色, 被膜紧张, 边缘饱满, 质地稍韧, 切面有油腻感, 严重者表面有细颗粒状隆起; HR组小鼠肝脏轻度肿大, 呈较浅淡的红褐色, 被膜较光滑, 边缘较锐利, 切面较光洁, 质地较正常组略差. HE染色光镜下观察, 正常组肝小叶结构完整, 肝细胞呈多边形, 围绕中央静脉呈放射状, 肝窦清晰可见, 肝索排列整齐, 未见异常; HF组小鼠肝组织弥漫性脂肪变, 小叶结构不清, 界限消失, 肝索排列紊乱, 小叶内和汇管区不同程度的炎症细胞浸润和坏死; HR组小鼠仍可见索条状排列的肝细胞, 脂变程度较模型组明显减轻, 且仅有轻微的炎性细胞浸润, 未见坏死灶(图1).
与NC组相比, HF组体质量明显增加(P<0.01), 白藜芦醇治疗后体质量降至正常. HF组小鼠肝组织内TG较正常对造组明显升高, HR组肝组织TG明显下降但未降至正常水平(表2).
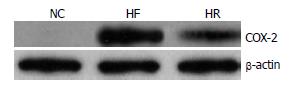
正常对照组未见COX-2 mRNA和蛋白表达, HF组和HR组COX-2 mRNA表达分别为1.48%±0.23%和0.76%±0.18%, 蛋白表达分别为27.9%±4.6%和11.2%±3.5%, 后两组与NC组比较差异有统计学意义(P<0.01), HF和HR组之间差异亦有统计学意义(P<0.01, 图2).
在脂肪肝的动物模型中, 主要有先天性、转基因动物和化学物质诱导以及高脂饲料诱导这4种实验性动物模型[10]. 用高脂饲料诱导的脂肪肝动物模型, 因其病理特征与人类相似, 且价格低廉、方法简单而广泛使用, 是诱导非乙醇性脂肪肝的常用方法[2]. ♂C57BL/6J小鼠对NASH营养性肝损伤模型有显著易感性, 发生的病变最接近类似于人的组织学特征[11-12]. 本实验中C57BL/6J小鼠经过高脂喂养总共24 wk, 出现了明显的高血糖, 高脂血症, 肝脏内TG沉积增加, 肝脏大体观可见肝脏肿大, 颜色呈黄褐色, 严重者表面呈细颗粒状, 显微镜下观察肝组织弥漫性脂肪变, 小叶结构不清, 界限消失, 肝索排列紊乱, 小叶内和汇管区不同程度的炎症细胞浸润和坏死, 提示NASH诱导成功.
NASH是肝硬化和肝细胞癌的原因之一, 肝细胞TG的沉积产生脂肪浸润, 导致氧化应激和炎症等[13-14]. COX是一种双功能酶, 具有环氧合酶和过氧化氢酶活性, 是花生四烯酸分解为前列腺素的(prostaglandins, PGs)限速酶, 在人体内COX包括结构型COX-1和诱导型COX-2, 以及近几年新近发现的COX-3[15]. 在COX的3种同工酶中, COX-2是经剌激迅速产生的诱导型酶, 正常情况下, COX-l呈原生性表达, 几乎分布于体内所有正常组织, COX-2在多数组织不表达或低表达, 而在炎症、肿瘤等病理状态其表达上调, 是有力的炎症介导因子[16-17], 和炎症的程度以及纤维化的进展有高度相关[18-19]. 高表达的COX-2使炎症介质PGE和TXB2等生成增加, 促进炎症细胞浸润, 同时还可通过调节NF-κB释放多种炎症介质, 如TNF-α, IL-8, ICAM-l, E选择素(E-selectin)等[20-21], 这些炎症介质又可进一步激活COX-2的表达, 形成一种正反馈环路, 扩大炎症反应, 延长炎症过程. Yu et al[7]发现, 正常饮食的小鼠肝脏没有COX-2的表达, 而高脂饮食诱导的小鼠NASH肝组织COX-2的表达增加, 国内许树长 et al[6]和刘晓珺 et al[8]也有相同的发现. 本实验中正常对照组大鼠肝组织结构正常, RT-PCR检测无COX-2 mRNA表达, 经过24 wk高脂喂养的大鼠肝组织有明显COX-2 mRNA和蛋白的强表达, 表明COX-2在高脂饮食诱导的NASH中活动增强, 在脂肪性肝炎发生机制中具有重要作用.
目前认为, NASH小鼠肝组织COX-2的高表达是由于长期过量摄入高脂食物, 使脂肪大量贮积在肝细胞, 诱发脂质过氧化损伤, 导致库普弗细胞激活并释放炎性细胞因子和COX-2. Enomoto et al[22]和Mohammed et al[23]研究发现库普弗细胞等炎症浸润细胞是COX-2 mRNA的主要来源, 在炎症细胞浸润的肝组织中, COX-2表达明显升高, 而正常对照组库普弗细胞只表达COX-1. COX-2的产物前列腺素E2(PGE2)与肝细胞膜上的EP2/EP4受体结合后, 激活腺苷酸环化酶, 使肝细胞内的cAMP增多, 进一步引起TG在肝细胞内堆积, 进而导致脂肪肝及脂肪性肝炎的形成. 因此针对COX-2靶点的治疗措施将有助于NASH的改善.
白藜芦醇是一种多酚、非黄酮类植物抗毒素, 富含白藜芦醇的植物主要有葡萄、花生及中药虎杖等, 尤其在新鲜的葡萄皮中含量最高. 研究表明他具有抗炎、抗氧化、抗肿瘤、抗心血管疾病、诱导细胞凋亡、延长寿命等活性[9,24-27]. 白藜芦醇的抗炎作用包括抑制炎症因子的合成和释放, 抑制某些活化的免疫细胞和抑制COX-1和COX-2等[24]. 既往的实验证明, 在急慢性结肠炎和β淀粉素处理的神经胶质瘤细胞中, 白藜芦醇均可以抑制COX-2蛋白的表达水平, 具有明显的抗炎作用[28-29]. 还有实验证明白藜芦醇可以使佛波醇诱导的小鼠皮肤COX-2的表达减少[30], 并且是通过抑制IKK的活性起作用. Das et al[24]的实验表明, 白藜芦醇主要是通过抑制转录因子NF-κB和AP1的活性来下调COX-2表达. 我们的研究表明, 白藜芦醇可以明显改善NASH小鼠肝脏组织的炎症反应和脂肪变性, 降低血清TG和FBG, 同时肝脏COX-2的表达水平明显下降, 因此肝脏脂肪变性和炎症的改善至少部分与白藜芦醇下调肝脏局部的COX-2的表达有关. 由于NAFLD发病率在全球迅速增加, 而白藜芦醇在NASH的治疗中具有明显的作用, 值得进一步研究.
随着非乙醇性脂肪肝(NAFLD)呈流行趋势, NASH患病率也增加. 其发病机制并不十分清楚, 但炎症过程与其发生发展有密切的关系, NASH时肝脏COX-2表达增加. 白藜芦醇是一种多酚类植物抗毒素, 具有抗氧化、抗炎等多种作用, 可能对NASH具有有益的作用.
陈耀凯, 副教授, 中国人民解放军第三军医大学西南医院全军感染病研究所
Yu et al发现, 正常饮食的小鼠肝脏没有COX-2的表达, 而高脂饮食诱导的小鼠NASH肝组织COX-2的表达增加, 国内许树长 et al和刘晓珺 et al也有相同的发现.
本文首次报道了白藜芦醇对NASH具有改善作用, 部分与下调肝脏COX-2的表达有关.
本文有助于了解NASH的发病机制并为白藜芦醇治疗NASH提供理论基础.
本研究分组合理, 统计方法得当, 结果可信, 文笔流畅, 具有较好的学术价值.
编辑: 潘伯荣 电编:郭海丽
| 1. | Deng XQ, Chen LL, Li NX. The expression of SIRT1 in nonalcoholic fatty liver disease induced by high-fat diet in rats. Liver Int. 2007;27:708-215. [PubMed] [DOI] |
| 2. | Anstee QM, Goldin RD. Mouse models in non-alcoholic fatty liver disease and steatohepatitis research. Int J Exp Pathol. 2006;87:1-16. [PubMed] [DOI] |
| 3. | Mishra P, Younossi ZM. Current treatment strategies for non-alcoholic fatty liver disease (NAFLD). Curr Drug Discov Technol. 2007;4:133-140. [PubMed] [DOI] |
| 4. | Ma X, Li Z. Pathogenesis of nonalcoholic steatohepatitis (NASH). Chin J Dig Dis. 2006;7:7-11. [PubMed] [DOI] |
| 5. | Zhou YJ, Li YY, Nie YQ, Ma JX, Lu LG, Shi SL, Chen MH, Hu PJ. Prevalence of fatty liver disease and its risk factors in the population of South China. World J Gastroenterol. 2007;13:6419-6424. [PubMed] [DOI] |
| 7. | Yu J, Ip E, Dela Pena A, Hou JY, Sesha J, Pera N, Hall P, Kirsch R, Leclercq I, Farrell GC. COX-2 induction in mice with experimental nutritional steatohepatitis: Role as pro-inflammatory mediator. Hepatology. 2006;43:826-836. [PubMed] [DOI] |
| 9. | Baur JA, Sinclair DA. Therapeutic potential of resveratrol: the in vivo evidence. Nat Rev Drug Discov. 2006;5:493-506. [PubMed] [DOI] |
| 11. | Kirsch R, Clarkson V, Shephard EG, Marais DA, Jaffer MA, Woodburne VE, Kirsch RE, Hall Pde L. Rodent nutritional model of non-alcoholic steatohepatitis: species, strain and sex difference studies. J Gastroenterol Hepatol. 2003;18:1272-1282. [PubMed] [DOI] |
| 12. | Savransky V, Bevans S, Nanayakkara A, Li J, Smith PL, Torbenson MS, Polotsky VY. Chronic intermittent hypoxia causes hepatitis in a mouse model of diet-induced fatty liver. Am J Physiol Gastrointest Liver Physiol. 2007;293:G871-G877. [PubMed] [DOI] |
| 13. | Marra F, Gastaldelli A, Svegliati Baroni G, Tell G, Tiribelli C. Molecular basis and mechanisms of progression of non-alcoholic steatohepatitis. Trends Mol Med. 2008;14:72-81. [PubMed] [DOI] |
| 14. | Albano E, Mottaran E, Occhino G, Reale E, Vidali M. Review article: role of oxidative stress in the progression of non-alcoholic steatosis. Aliment Pharmacol Ther. 2005;22 Suppl 2:71-73. [PubMed] [DOI] |
| 15. | Chandrasekharan NV, Dai H, Roos KL, Evanson NK, Tomsik J, Elton TS, Simmons DL. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. Proc Natl Acad Sci U S A. 2002;99:13926-13931. [PubMed] [DOI] |
| 16. | Gilroy DW, Colville-Nash PR. New insights into the role of COX 2 in inflammation. J Mol Med. 2000;78:121-129. [PubMed] [DOI] |
| 17. | Mann JR, Backlund MG, DuBois RN. Mechanisms of disease: Inflammatory mediators and cancer prevention. Nat Clin Pract Oncol. 2005;2:202-210. [PubMed] [DOI] |
| 18. | Kondo M, Yamamoto H, Nagano H, Okami J, Ito Y, Shimizu J, Eguchi H, Miyamoto A, Dono K, Umeshita K. Increased expression of COX-2 in nontumor liver tissue is associated with shorter disease-free survival in patients with hepatocellular carcinoma. Clin Cancer Res. 1999;5:4005-4012. [PubMed] |
| 19. | Cheng J, Imanishi H, Iijima H, Shimomura S, Yamamoto T, Amuro Y, Kubota A, Hada T. Expression of cyclooxygenase 2 and cytosolic phospholipase A(2) in the liver tissue of patients with chronic hepatitis and liver cirrhosis. Hepatol Res. 2002;23:185-195. [PubMed] [DOI] |
| 20. | Weinberg JB. Nitric oxide synthase 2 and cyclooxygenase 2 interactions in inflammation. Immunol Res. 2000;22:319-341. [PubMed] [DOI] |
| 21. | Leclercq IA, Farrell GC, Sempoux C, dela Pena A, Horsmans Y. Curcumin inhibits NF-kappaB activation and reduces the severity of experimental steatohepatitis in mice. J Hepatol. 2004;41:926-934. [PubMed] [DOI] |
| 22. | Enomoto N, Ikejima K, Yamashina S, Enomoto A, Nishiura T, Nishimura T, Brenner DA, Schemmer P, Bradford BU, Rivera CA. Kupffer cell-derived prostaglandin E(2) is involved in alcohol-induced fat accumulation in rat liver. Am J Physiol Gastrointest Liver Physiol. 2000;279:G100-G106. [PubMed] |
| 23. | Mohammed NA, Abd El-Aleem SA, El-Hafiz HA, McMahon RF. Distribution of constitutive (COX-1) and inducible (COX-2) cyclooxygenase in postviral human liver cirrhosis: a possible role for COX-2 in the pathogenesis of liver cirrhosis. J Clin Pathol. 2004;57:350-354. [PubMed] [DOI] |
| 24. | Das S, Das DK. Anti-inflammatory responses of resveratrol. Inflamm Allergy Drug Targets. 2007;6:168-173. [PubMed] [DOI] |
| 25. | Cucciolla V, Borriello A, Oliva A, Galletti P, Zappia V, Della Ragione F. Resveratrol: from basic science to the clinic. Cell Cycle. 2007;6:2495-2510. [PubMed] |
| 26. | Stewart JR, Artime MC, O'Brian CA. Resveratrol: a candidate nutritional substance for prostate cancer prevention. J Nutr. 2003;133:2440S-2443S. [PubMed] |
| 27. | Baur JA, Pearson KJ, Price NL, Jamieson HA, Lerin C, Kalra A, Prabhu VV, Allard JS, Lopez-Lluch G, Lewis K. Resveratrol improves health and survival of mice on a high-calorie diet. Nature. 2006;444:337-342. [PubMed] [DOI] |
| 28. | Martin AR, Villegas I, Sanchez-Hidalgo M, de la Lastra CA. The effects of resveratrol, a phytoalexin derived from red wines, on chronic inflammation induced in an experimentally induced colitis model. Br J Pharmacol. 2006;147:873-885. [PubMed] [DOI] |
| 29. | Kim YA, Lim SY, Rhee SH, Park KY, Kim CH, Choi BT, Lee SJ, Park YM, Choi YH. Resveratrol inhibits inducible nitric oxide synthase and cyclooxygenase-2 expression in beta-amyloid-treated C6 glioma cells. Int J Mol Med. 2006;17:1069-1075. [PubMed] |
| 30. | Kundu JK, Shin YK, Kim SH, Surh YJ. Resveratrol inhibits phorbol ester-induced expression of COX-2 and activation of NF-kappaB in mouse skin by blocking IkappaB kinase activity. Carcinogenesis. 2006;27:1465-1474. [PubMed] [DOI] |