修回日期: 2008-04-16
接受日期: 2008-05-13
在线出版日期: 2008-06-28
目的: 探讨HBV组蛋白甲基转移酶SMYD3在肝癌细胞中的表达与HBV感染状态相关性.
方法: 选取HBV阴性和HBV阳性的肝癌细胞株HepG2、HepG2.2.15, 利用实时逆转录聚合酶链反应(real time RT-PCR)方法检测SMYD3 mRNA表达水平, Western blot检测细胞中SMYD3蛋白表达差异.
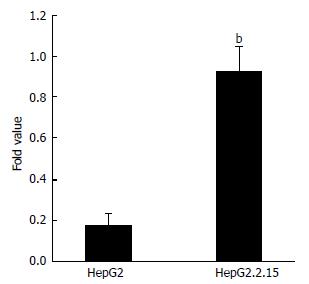
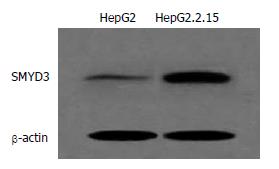
结果: SMYD3 mRNA及蛋白在HepG2.2.15的表达水平显著高于HepG2(0.92±0.12 vs 0.18±0.05, 0.28±0.03 vs 0.54±0.05, 均P<0.01), 有统计学差异.
结论: HBV可能通过上调SMYD3途径促进肝癌的恶性生物学行为.
引文著录: 何军, 马兆龙, 陈立波, 王国斌. 组蛋白甲基转移酶SMYD3在不同HBV表达水平肝癌细胞中的差异表达. 世界华人消化杂志 2008; 16(18): 2036-2039
Revised: April 16, 2008
Accepted: May 13, 2008
Published online: June 28, 2008
AIM: To evaluate correlation between histone methyltransferase SMYD3 expression in hepatoma and HBV infection.
METHODS: SMYD3 mRNA expressions and SMYD3 protein expression levels in HBV-negative HepG2 and HBV-positive hepatoma cell line HepG2.2.15 were determined using real time PCR and Western blot, respectively.
RESULTS: SMYD3 mRNA and protein levels were significantly higher in HepG2.2.15 than those in HepG2 (0.92 ± 0.12 vs 0.18 ± 0.05, 0.28 ± 0.03 vs 0.54 ± 0.05, both P < 0.01).
CONCLUSION: HBV may promote hepatoma cell malignancy through its SMYD3 up-regulating pathways.
- Citation: He J, Ma ZL, Chen LB, Wang GB. SMYD3 expression differences in hepatoma cell lines with different HBV expression levels. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 2036-2039
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/2036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.2036
SMYD3是最近发现的具有催化组蛋白H3-K4甲基化位点发生甲基化活性的甲基转移酶, 通过组蛋白甲基化、活化癌基因表达等在肝癌等恶性肿瘤中发挥重要的调控作用[1-2]. 乙型肝炎病毒(hepatitis B virus, HBV)是我国肝细胞癌发生的重要原因. 研究表明, HBV可以通过破坏正常细胞凋亡, 抑制抑癌基因p53活性, 破坏DNA损伤修复, 诱导抑癌基因启动子甲基化导致抑癌基因沉默等途径发挥诱癌、促癌作用, 但关于HBV和肝癌发生、进展的关系还没完全阐明; HBV是否通过影响SMYD3等组蛋白甲基化酶表达、改变组蛋白甲基化状态来调控肝癌发生与进展还未见报道. 我们通过检测不同HBV表达水平肝癌细胞株中SMYD3的表达差异, 初步探讨HBV是否可能通过上调SMYD3途径参与肝癌发生、发展的调控.
HepG2, HepG2.2.15细胞由我院中心实验室保存; Anti-SMYD3(羊抗人), Anti-HBX(小鼠抗人)购自美国Abcam公司; RNA提取试剂盒TRIzol Reagant为Invitrogen公司产品, 逆转录试剂盒购自Gibco公司, 荧光定量PCR试剂盒购自Roche公司, 引物由上海Invitrogen公司合成.
1.2.1 HepG2细胞和HepG2.2.15细胞培养: 分别在含100 mL/L胎牛血清的RIMP 1640培养基和DMEM高糖培养基、50 mL/L CO2、37℃饱和湿度条件下培养, 每2-3天用2.5 g/L胰酶消化传代.
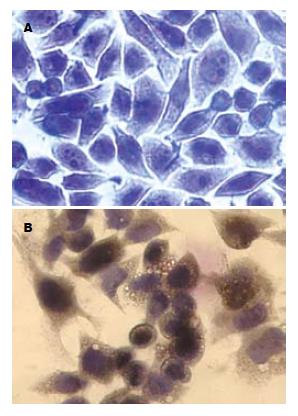
1.2.2 HepG2和HepG2.2.15细胞中HBV检测: 在6孔细胞培养板中放置无菌盖玻片, 并以细胞密度2×104/L, 2 mL/孔接种于培养板. HepG2细胞和HepG2.2.15细胞各3孔. 当细胞在盖玻片上的密度达到90%时用PBS冲洗, 40 g/L多聚甲醛固定, Anti-HBcAg以1:200比例稀释点滴细胞4℃过夜. 加SABC及DAB染色, 操作按照说明书进行.
1.2.3 肝癌细胞中SMYD3的mRNA的检测: 采用TRIzol一步法提取细胞总RNA. 逆转录后得到cDNA后行real time RT-PCR, SMYD3引物正义: 5'-TGAATGTGACTGTTTCCGTTGC-3', 反义5'-ATTGCTGCTTATGATCGCCTGG-3', 产物为172 bp; 内参照β-actin引物正义: 5'-GAACGGTGAAGGTGACAG-3', 反义5'-TAGAGAGAAGTGGGGTGG-3', 产物为168 bp; 反应参数设置95℃ 2 min; 94℃ 30 s; 57℃ 30 s; 72℃ 30 s, 循环45次; 72℃ 5min.在延伸过程中收集荧光信号, 计算样品的Ct值, 用2-△△Ct法计算SMYD3 mRNA的表达量.
1.2.4 肝癌细胞中SMYD3蛋白表达的检测: 细胞培养融合80%, 收集细胞提取总蛋白. 将定量后的蛋白质样品每孔20 μg点样于SDS聚丙烯酰胺凝胶小孔, 100 V电泳1 h, 300 mA下转膜1.5 h, 将转好的硝酸纤维素膜用封闭液室温振荡封闭2 h, 然后加入1:200 SMYD3一抗, 37℃孵育2 h, TBS缓冲液漂洗15 min, 共3次, 再加入1:5000辣根过氧化酶标记的二抗, 37℃孵育1 h, TBS缓冲液漂洗15 min, 共3次, 增强化学发光剂(Amersham公司)显影, 胶片曝光, 结果用UVP扫描仪扫描成像.
统计学处理 各组实验分别重复3次, 计算平均值, 再进行SPSS One-way ANOVA(SNK method)方差分析, 以P<0.05为具有统计学意义.
通过SABC法检测细胞中的HBcAg表达, 表明HepG2、HepG2.2.15分别是HBV阴性和HBV阳性细胞(图1).
Real-time RT-PCR结果显示; HepG2.2.15细胞组的SMYD3 mRNA表达量明显高于HepG2细胞组(0.92±0.12 vs 0.18±0.05 P<0.01), 具有显著统计学差异(图2).
Western blot结果灰度值相对量显示: HepG2.215细胞组中的SMYD3也呈高表达状态, 显著高于HepG2细胞组(0.28±0.03 vs 0.54±0.05, P<0.01, 图3).
HBV感染是原发性肝癌的首要病因. 国内外对HBV在肝癌发生进展中的作用进行了大量的研究, 尤其是HBX基因与肝癌的关系. 目前认为HBx蛋白致癌作用主要有以下5方面: (1)HBx可上调HepG2细胞端粒酶活性,使较多的细胞进入S期[3]. 这些都表明X基因通过上调细胞端粒酶活性而抑制宿主细胞凋亡,是诱导肝细胞癌变的一条可能途径. (2)HBx可通过蛋白质-蛋白质作用阻断p53的功能. 同时, HBx对p53的转录亦有强烈的抑制作用. Park et al[4]报道, HBx可抑制p53的活性, 减少细胞周期蛋白激酶抑制剂P21Waf1/cip1蛋白表达, 延长细胞从G1期向S期的转换, 增加肝细胞基因突变的可能性. HBx能和参与核酸外切修复的ERCC竞争p53结合位点, 抑制p53对损伤核酸的外切修复作用, 增加重要基因的变异频率. HBX还可下调p53对抑癌基因PTEN的转录激活作用, 使PTEN的表达水平下降, 增加细胞恶性转化的危险性[5]. (3)HBV X破坏DNA损伤的修复, 单纯HBx在肝细胞的表达并不足以引起HCC, 环境因素与HBx的协同作用是HCC形成的主要机制. HBx并不显著增加DNA的变异率(mutation frequency, MF), 但他可使环境致癌因素如黄曲霉毒素B1、UV射线和二乙基亚硝基胺(DEN)引起的DNA损伤产生累积, 即HBx抑制了损伤DNA的修复. (4)HBx诱导肿瘤细胞的侵袭依赖于MT1-MMP和COX2活性, 一方面HBX使膜型基质金属蛋白酶-1(MTl-MMP)和环氧合酶-2(COX-2)表达上调[6-7]降解细胞周围细胞外基质(ECM)促进了肝癌细胞的侵袭和转移; 另一方面HBX促进肿瘤新生血管形成通过多环节促进了肝细胞HIF-1α的转录表达,增加了肝细胞HIF-1α蛋白质的稳定性并增强了HIF-1α对VEGF的激活作用[8]. (5)HBx激活DNA甲基化转移酶1活性使E-cadherin启动子区甲基化[9], E-cadherin表达被抑制导致细胞间的黏附作用减弱, 从而促使肿瘤细胞的转移, 从而增强肿瘤的转移和侵袭能力. 有研究报道[10], 在癌旁组织和慢性乙型肝炎中, 抑癌基因p16INK4A基因启动子甲基化与HBx蛋白高表达有关, HBx蛋白可能通过诱导p16INK4A基因启动子甲基化而使该抑癌基因失活, 这也反映了HBx在通过表观遗传方面影响抑癌基因的表达从而促进肝癌的发生. 而对HBV是否通过组蛋白甲基化参与肝癌恶性生物学行为的调控还未见报道.
组蛋白甲基化是基因表观遗传学调控的重要方式. SMYD3是具有组蛋白甲基转移酶活性的蛋白质, 通过将组蛋白H3上第4个赖氨酸甲基化改变染色质的构象, 激活相关的癌基因转录, 促进肿瘤细胞的增殖、集落形成, 抑制肿瘤细胞的凋亡[2]. Hamamoto et al[11]研究表明SMYD3在大部分的乳腺癌组中高表达, SMYD3可以调控原癌基因WNT10B的表达促进乳腺癌的发生. 我们研究曾发现, SMYD3在多个肝癌细胞株及肝癌组织中大量表达; 利用RNA干扰技术下调SMYD3表达后, HepG2细胞的增殖受到抑制并出现较为明显的凋亡[12]. 动物实验也表明SMYD3 shRNA质粒注射到裸鼠的瘤体内可以减缓瘤体的增长速度. SMYD3不仅通过癌基因活化促进肝癌的恶性表型, 还可能通过使抑癌基因RIZ1启动子CpG岛去甲基化、下调RIZ1的抑癌活性来参与肝癌的调控[13]. 但对SMYD3是否参与HBV致癌/促癌作用还需要进一步研究.
我们初步探讨了不同HBV表达水平肝癌细胞株中SMYD3表达的差异, 发现与HBV阴性的HepG2细胞相比, SMYD3mRNA和蛋白在HBV阳性的HepG2.2.15中的表达均显著增加, 提示我们肝癌细胞中SMYD3的表达可能受到HBV调控, HBV也可能通过SMYD3途径发挥致癌/促癌作用. 我们的相关研究发现抑制SMYD3表达可以下调肝癌细胞中癌基因c-myc表达[14], 而c-myc是HBV致癌的重要途径[15], 提示我们SMYD3可能在HBV癌基因激活途径中发挥重要的桥梁作用.
HBV如何调控肝癌细胞中SMYD3表达还有待于进一步阐明. 已有的研究表明, HBV可以通过多种方式参与肝癌发生的调控, 其中细胞信号途径如RAS-RAF-p38MAPK、SAPK/JNK、ERK等, 以及蛋白酶途径等是HBV致癌作用的重要环节[16]. 对肝癌细胞HBV检测表明HepG2.2.15细胞中HBV主要表达于细胞质, 我们通过基因转染发现HBX基因转染后SMYD3基因和HBX共同位于肝癌细胞质(另文发表), 提示我们肝癌细胞中HBV可能通过这些信号途径上调 SMYD3的表达和活性. SMYD3启动子上含有E2F-1结合元件是影响SMYD3活性的重要原因[17]; 而在HepG2细胞中HBV增加E2F-1的活性[18], 提示我们HBV通过增加E2F-1活性与SMYD3启动子上的E2F-1结合元件相作用, 从而调控肝癌细胞中SMYD3的表达, 是HBV阳性肝癌细胞中SMYD3表达、活性增加的重要原因.
HBV作为肝癌发生首要促进因素已被科学界公认. HBx蛋白作为一种HBV功能蛋白通过多种作用机制促使肝癌的发生和发展. SMYD3是一种组蛋白转移酶, 通过组蛋白修饰在肝癌、大肠癌等多种肿瘤的发生和进展中起着重要的调控作用. 但关于HBV是否通过SMYD3途径参与肝癌发生尚缺乏研究.
沈柏用, 副教授, 上海市交通大学医学院瑞金医院肝胆胰外科中心.
目前关于HBV研究的热点主要集中在HBX蛋白在乙肝相关性肝癌的作用和致病机制. 至于HBx和组蛋白转移酶SMYD3联系在一起的表观遗传学途径报道甚少.
本文首次将HBV中的HBx和组蛋白转移酶SMYD3结合到一起, 证实两者之间的相互关系, 从而为HBV从表观遗传学方面研究其促癌作用提供新的依据.
本实验结果为研究HBV提出一个新的方向, HBV可能在表观遗传学途径通过调控SMYD3表达参与肝癌的发生与进展.
SMYD3: 催化组蛋白H3-K4甲基化的组蛋白甲基化转移酶. SMYD3在肝癌等肿瘤中大量表达, 促进肿瘤细胞异常增殖.
本文选题符合该领域的研究热点, 设计科学合理, 统计处理恰当, 结论可靠, 具有一定的学术价值.
编辑: 潘伯荣 电编:吴鹏朕
| 1. | Tarn C, Zou L, Hullinger RL, Andrisani OM. Hepatitis B virus X protein activates the p38 mitogen-activated protein kinase pathway in dedifferentiated hepatocytes. J Virol. 2002;76:9763-9772. [PubMed] [DOI] |
| 2. | Hamamoto R, Furukawa Y, Morita M, Iimura Y, Silva FP, Li M, Yagyu R, Nakamura Y. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells. Nat Cell Biol. 2004;6:731-740. [PubMed] [DOI] |
| 4. | Park US, Park SK, Lee YI, Park JG, Lee YI. Hepatitis B virus-X protein upregulates the expression of p21waf1/cip1 and prolongs G1-->S transition via a p53-independent pathway in human hepatoma cells. Oncogene. 2000;19:3384-3394. [PubMed] [DOI] |
| 5. | Chung TW, Lee YC, Ko JH, Kim CH. Hepatitis B Virus X protein modulates the expression of PTEN by inhibiting the function of p53, a transcriptional activator in liver cells. Cancer Res. 2003;63:3453-3458. [PubMed] |
| 6. | Ou DP, Tao YM, Tang FQ, Yang LY. The hepatitis B virus X protein promotes hepatocellular carcinoma metastasis by upregulation of matrix metalloproteinases. Int J Cancer. 2007;120:1208-1214. [PubMed] [DOI] |
| 7. | Lara-Pezzi E, Gómez-Gaviro MV, Gálvez BG, Mira E, Iñiguez MA, Fresno M, Martínez-A C, Arroyo AG, López-Cabrera M. The hepatitis B virus X protein promotes tumor cell invasion by inducing membrane-type matrix metalloproteinase-1 and cyclooxygenase-2 expression. J Clin Invest. 2002;110:1831-1838. [PubMed] [DOI] |
| 8. | Yoo YG, Oh SH, Park ES, Cho H, Lee N, Park H, Kim DK, Yu DY, Seong JK, Lee MO. Hepatitis B virus X protein enhances transcriptional activity of hypoxia-inducible factor-1alpha through activation of mitogen-activated protein kinase pathway. J Biol Chem. 2003;278:39076-39084. [PubMed] [DOI] |
| 9. | Liu J, Lian Z, Han S, Waye MM, Wang H, Wu MC, Wu K, Ding J, Arbuthnot P, Kew M. Downregulation of E-cadherin by hepatitis B virus X antigen in hepatocellullar carcinoma. Oncogene. 2006;25:1008-1017. [PubMed] [DOI] |
| 10. | 朱 荣, 李 百周, 凌 玉琴, 张 慧萍, 李 华, 刘 晔, 胡 锡琪, 朱 虹光. 慢性乙型肝炎病毒感染与p16INK4A基因启动子甲基化 关系的研究. 中华肿瘤杂志. 2007;29:166-170. |
| 11. | Hamamoto R, Silva FP, Tsuge M, Nishidate T, Katagiri T, Nakamura Y, Furukawa Y. Enhanced SMYD3 expression is essential for the growth of breast cancer cells. Cancer Sci. 2006;97:113-118. [PubMed] [DOI] |
| 13. | Chen LB, Xu JY, Yang Z, Wang GB. Silencing SMYD3 in hepatoma demethylates RIZI promoter induces apoptosis and inhibits cell proliferation and migration. World J Gastroenterol. 2007;13:5718-5724. [PubMed] |
| 14. | 刘 鑫, 陈 立波, 叶 进, 江 军, 何 军, 徐 鋆耀, 钱 伟. shRNA干扰SMYD3对肝癌细胞c-Myc表达及凋亡的影响. 世界华人消化杂志. 2008;13:1373-1377. [DOI] |
| 15. | Balsano C, Avantaggiati ML, Natoli G, De Marzio E, Will H, Perricaudet M, Levrero M. Full-length and truncated versions of the hepatitis B virus (HBV) X protein (pX) transactivate the cmyc protooncogene at the transcriptional level. Biochem Biophys Res Commun. 1991;176:985-992. [PubMed] [DOI] |
| 16. | Tarn C, Lee S, Hu Y, Ashendel C, Andrisani OM. Hepatitis B virus X protein differentially activates RAS-RAF-MAPK and JNK pathways in X-transforming versus non-transforming AML12 hepatocytes. J Biol Chem. 2001;276:34671-34680. [PubMed] [DOI] |
| 17. | Tsuge M, Hamamoto R, Silva FP, Ohnishi Y, Chayama K, Kamatani N, Furukawa Y, Nakamura Y. A variable number of tandem repeats polymorphism in an E2F-1 binding element in the 5' flanking region of SMYD3 is a risk factor for human cancers. Nat Genet. 2005;37:1104-1107. [PubMed] [DOI] |
| 18. | Choi BH, Choi M, Jeon HY, Rho HM. Hepatitis B viral X protein overcomes inhibition of E2F1 activity by pRb on the human Rb gene promoter. DNA Cell Biol. 2001;20:75-80. [PubMed] [DOI] |