修回日期: 2008-04-19
接受日期: 2008-05-16
在线出版日期: 2008-06-28
作为肿瘤间质组成的一部分, 肿瘤内血管生成不仅为原发肿瘤生长所必需, 也是肿瘤细胞向远处播散的必备条件之一. 超微结构和免疫组化的观察发现, 不同人类肿瘤组织中的血管密度和数量与肿瘤的侵袭转移潜能密切相关. 最近许多研究证实了血管生成与胃癌侵袭性之间的联系, 同时也有许多研究证实抑制血管生成能显著抑制肿瘤的生长及转移, 在胃癌的治疗实验中已初步显示出良好的应用前景.
引文著录: 付彦超, 张庆瑜. 胃癌血管生成及抗血管生成治疗的研究进展. 世界华人消化杂志 2008; 16(18): 2012-2018
Revised: April 19, 2008
Accepted: May 16, 2008
Published online: June 28, 2008
As a component of tumor stroma, tumor angiogenesis is not only essential to primary tumor growth but also one of the requisites to disseminate. Ultrastructural organization and immunohistochemisty have shown that density and quantity of blood vessels has a close association with the potentiality of tumor invasion and metastasis. Some recent studies confirm correlation between angiogenesis and invasion of gastric tumor, and some other studies prove that antiangiogenesis can significantly inhibit tumor growth and metastasis, which has demonstrated a promising application perspective for gastric carcinoma treatment.
- Citation: Fu YC, Zhang QY. Advances in gastroma angiogenesis and antiangiogenesis treatment for gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 2012-2018
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/2012.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.2012
肿瘤的血管生成受到来自宿主细胞和肿瘤细胞本身产生分泌的血管生成刺激因子和抑制因子的调节. 这些血管新生是促血管生成因子和血管生成抑制因子间失衡的结果, 肿瘤细胞自身在产生血管生长促进剂的同时, 还可产生血管生长抑制剂, 二者之间量的比例变化与原位肿瘤的转移、病灶的血管增生程度密切相关. 同时研究发现应用抗血管生成的外源性抑制剂抑制肿瘤的血管生成, 可以达到治疗肿瘤的目的. 现就胃癌血管生成及抗血管生成治疗的最新研究进展作一综述.
人表皮生长因子VEGF(vessel endothelium growth factor, VEGF)基因定位于6p21.3, 全长121 kbp, 由8个外显子和7个内含子组成, 编码34-45 kDa的同源二聚体蛋白, 两亚基通过二硫键相连. 已知有4种异构体: VEGF206、VEGFI89、VEGFI65、VEGFI2l, 其中VEGFI65、VEGFI21为可扩散形式, VEGF206、VEGFI89则是与细胞外基质相结合的形式. VEGF通过与其相应受体结合来发挥效应其机制包括: (1)增加血管内皮通透性; (2)促进内皮细胞有丝分裂; (3)诱导血管内皮细胞表达基质蛋白酶, 降解基质和血管基膜, 促进内皮细胞迁移. Raica et al[1]应用免疫组化法测定80例胃癌患者中有52例VEGF阳性(70%)同时证实VEGF与肿瘤血管的生成密切相关, 且与肿瘤的TNM分期和分级有关. Lazar et al[2]则对高表达VEGF的胃癌组织进行了MVD(micro vascular density)检测,结果显示MVD与VEGF之间存在明显正相关性. Kolev et al[3]在对169名不同分期, 不同分级的胃癌患者的癌组织进行检测, 发现VEGF与侵袭深度, 淋巴结转移, 脉管侵入之间相互关联, 而且VEGF阳性患者生存率明显低于VEGF阴性患者, 说明VEGF是影响肿瘤MVD的一个重要因子, 可以作为患者预后的一个评价指标.
成纤维细胞生长因子(fibroblast growth factor, FGF)分为酸性成纤维细胞生长因子(aFGF)和碱性成纤维细胞生长因子(bFGF), 其中bFGF研究较多, 他是一种单链多肽, 肿瘤细胞分泌bFGF, 通过自分泌或旁分泌方式作用于癌细胞和血管内皮细胞, 促进其分裂, 引起肿瘤血管生成. 已知bFGF受体(fibroblast growth factor receptor, FGFR)有4种(FGFR1、FGFR2、FGFR3、FGFR4), 各种受体的mRNA在胃癌组织中的表达上调. Chaffer et al[4]在多种肿瘤中经研究证实了FGF通过与其受体结合诱导血管发生, 促进肿瘤的发生发展.
缺氧诱导因子-1(hypoxia inducing factor, HIF-1)在胃癌组织中高表达, 他通过诱导VEGF促进肿瘤血管的发生促进肿瘤细胞的侵袭转移, 并影响患者预后. Ma et al[5]经研究证实了HIF-1和VEGF在胃癌组织中的高表达呈正相关, 而且HIF-1和VEGF阳性组的肿瘤组织MVD明显高于阴性组, 脉管侵袭与淋巴结转移也明显高于阴性组[6-7]. Lee et al[8]对其作用机制作了研究, 发现AKT-HIF-1alpha-VEGF途径在肿瘤发生和血管生成中发挥了重要作用.
血管生成因子(angiogenin, ANG)分为Ang-1和Ang-2, 通过自分泌或旁分泌的方式作用于血管内皮细胞, 他们的共同受体是Tie2, 通过与受体结合对肿瘤血管的生成起重要的调节作用. Wang et al[9-10]通过免疫组化法和对肿瘤组织的MVD检测证实了Ang-1, Ang-2和Tie2 mRNA在肿瘤中高表达(P<0.001)且与MVD呈明显正相关(P<0.001). 而Zhang et al[11]则研究认为Ang-1对肿瘤血管的生成起正性调节作用, 而Ang-2对抗Ang-1的作用. Chen et al[12]研究发现在人类胃腺癌组织中ANG与VEGF的表达呈正相关, 从而得出ANG可能是VEGF发挥其诱导血管生成作用的靶点.
白介素-8(interleukin-8, IL-8), 为一单链蛋白, 分子质量约8 kDa, 分子中有4个半胱氨酸残基, 形成两个二硫键. Kitadai et al早在1999年应用基因转染和免疫组化方法观察发现, 裸鼠中人胃癌组织的MVD和IL-8呈显著正相关, 提供了IL-8促进胃癌血管生成的直接证据. 而最近Tanaka et al[13]应用裸鼠进行研究发现白介素-10可以抑制肿瘤血管的生成, 从而有效地抑制了胃癌细胞的腹腔转移并提高了患鼠的生存率.
胸苷磷酸化酶(thymidine phosphorylase, TP)催化胸腺嘧啶转化为胸苷, 调节体内胸苷水平, 是一种血小板源性细胞生长因子(PD-CGF), 且是通过二硫键连接的二聚体. 胃癌细胞、基质细胞表达胸苷磷酸化酶, 而正常胃黏膜不表达. Han et al[14]研究发现TP在胃癌细胞阳性而基质细胞阴性的组织中与MVD呈正相关, 在促进肿瘤的发生和侵袭转移方面起了重要作用. Jang et al[15]同样证实TP在胃癌细胞阳性而基质细胞阴性组织中促进肿瘤的脉管侵袭, 淋巴结转移, 以及对患者的预后产生明显影响.
血管紧张素Ⅱ是肾素-血管紧张素系统的效应器, 通过与血管紧张素Ⅱ受体1(angiotensin Ⅱ type1 receptors, AT1R)结合促进肿瘤生长和血管的生成. Huang et al[16]通过研究胃癌细胞系MKN-28, 发现AT1R高表达且与MMP2和MMP9呈正相关, 证实了AT1R通过调节MMP2和MMP9促进肿瘤血管的生成的作用机制.
此外, 肝细胞生长因子(hepatocyte growth factor, HGF)、转化生长因子(transforming growth factor, TGF), 肿瘤坏死因子-a(tumor necrosis factor, TNF-a)、前列腺素E1、E2, 胎盘生长因子等也参与胃癌血管生成, 促进胃癌生长、浸润和转移.
环氧合酶-2(cyclooxygenase-2 COX-2)是前列腺素合成的关键酶, 通过几个不同途径调节肿瘤血管生成, 在肿瘤形成过程中起着重要作用. Tang et al[17]应用免疫组化法检测53例胃癌组织和40例正常胃黏膜组织, 结果发现与正常组织相比, 癌组织中COX-2高表达且与MVD和肿瘤TNM分期存在明显相关, 而高MVD患者生存率明显缩短. 同时研究发现COX-2与VEGF和OPN在促进肿瘤血管生成中有协同效应[18-19]. Lei et al[20]则进一步发现COX-2是通过活化Id1进而激活VEGF的机制发挥其促血管生成作用的.
基质金属蛋白酶类(MMPs)是一类含锌离子的蛋白水解酶, 根据底物不同可分为: (1)基质降解酶类如基质降解酶1、2、3, 以及基质溶解因子; (2)胶原酶; (3)明胶酶A、B. MMPs能降解血管基底膜和细胞外基质, 破坏血管结构, 使内皮细胞易脱落、迁移, 形成新生血管. Zheng et al[21-22]通过免疫染色发现MMP2和MMP9的表达与肿瘤大小, 侵袭深度, 淋巴结转移, MVD和肿瘤分期都存在明显相关性, 同时还发现VEGF与二者呈正相关, 而PTEN与二者呈负相关. Jin et al[23]的研究证实了MMP3同样能够通过降解细胞外基质促进肿瘤细胞的生长和血管生成.
类肝素酶(heparanase, HPA)通过调节COX-2促进肿瘤生长和血管发生, Ohtawa et al[24]早前研究发现HPA和COX-2与瘤内血管密度密切相关, 此后通过免疫组化法进行检测, 研究发现HPA和COX-2之间存在显著相关性(P<0.0001)从而说明HPA可能通过影响COX-2的表达发挥其促增生作用.
诱生型一氧化氮合酶(inducible nitric oxide synthase, iNOS), 主要分布在巨噬细胞中, 其活性不依赖Ca2+, 是产生大量NO的主要酶. Chen et al[25]研究发现iNOS和COX-2均高表达且呈正相关性, 与瘤组织MVD有明显的关联性, 通过诱导肿瘤血管生成来促进肿瘤生长, 浆膜转移, 淋巴结转移等过程.
E-钙黏素(E-cadherin)属亲同性CAM, 其作用依赖于Ca2+. 钙黏素的作用主要有以下几个方面: (1)介导细胞连接. (2)参与细胞分化. (3)抑制细胞迁移, E-cadherin是保持上皮细胞相互黏合的主要CAM, 是黏合带的主要构成成分. Zhou et al[26]应用免疫组化法测定胃癌组织中E-cadherin的表达情况, 并通过测定MVD证明他与血管生成的联系, 结果发现E-cadherin高表达的肿瘤组织的MVD相应增高, 从而证实了E-cadherin的促血管生成作用.
选择素(selectin)属亲异性CAM, 其作用依赖于Ca2+. 主要参与白细胞与脉管内皮细胞之间的识别与黏合. 已知选择素有3种: L选择素、E选择素及P选择素. Mayer et al早在1998年就证实了E选择素和P选择素与肿瘤血管的生成之间的联系, Jiang et al[27]应用穿心莲内酯抑制E选择素的表达, 研究发现E选择素被抑制后胃癌细胞的黏附作用明显降低, 从而有效的降低了胃癌细胞的转移侵袭能力.
血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)属于免疫球蛋白超家族, 其配体是整合素, 主要分布在血管内皮细胞表面, 分子质量为10 kDa. Ding et al[28]研究发现, 胃癌患者血管细胞黏附分子的表达显著高于胃良性病变组织, VCAM-1表达与瘤组织MVD呈显著相关性, 表明VCAM-1参与胃癌组织血管的形成.
整合素(integrin)大多为亲异性细胞黏附分子, 其作用依赖于Ca2+. 介导细胞与细胞间的相互作用及细胞与细胞外基质间的相互作用. 整合素是由α(120-185 kDa)和β(90-110 kDa)两个亚单位形成的异二聚体. α亚单位与整合素活性的调节有关. β3亚单位的整合素主要存在于血小板表面, 介导血小板的聚集, 并参与血栓形成, α6β4整合素以层黏连蛋白为配体, 参与形成半桥粒. Li et al[29]研究发现Integrin-β3在胃癌组织中高表达且与瘤组织的MVD呈正相关, 证实了Integrin-β3与肿瘤血管生成有关. Tsuchiya et al[30]研究发现Integrin-α6同样与肿瘤血管的生成相关.
抑癌基因p53定位于17p13.1, 由11个外显子组成, 编码393个氨基酸的蛋白质, 分子质量为53 kDa. Miyamoto et al[31]经研究发现, 血管生成在某些程度上受肿瘤抑制基因p53的调节. 实验通过MVC检测肿瘤血管生成情况, 结果证实突变的p53可通过上调血管生成刺激因子(如VEGF, FGF等)刺激肿瘤血管生成.
PTEN(phosphatase and tensin homolog deleted on chromosome ten)作为抑癌基因在细胞分化、增殖和凋亡过程中起着重要作用, 并参与细胞的黏附和运动, 他可通过使三磷酸肌醇(PIP3)去磷酸化而抑制PIP3/Akt(PKB)信号传导途径来调节细胞的增殖与凋亡[32]. He et al[33]研究发现肿瘤的MVD在PTEN阴性组明显高于PTEN阳性组, 同时发现PTEN降低或失活伴随VEGF和MMP-9的过表达, 从而证实PTEN通过影响VEGF和MMP-9调节肿瘤血管的生成.
Racl是Rho家族成员, 他在胃癌组织中高表达, Xue et al[34]通过应用Racl特异siRNA转染胃癌细胞, 结果发现转染后Racl的mRNA和蛋白水平明显降低, 同时伴随VEGF和HIF-1的表达下调, 从而证实了血管生成刺激因子VEGF和HIF-1通过调节Racl影响肿瘤血管的生成.
ZNRD1(zinc ribbon domain-containing 1 protein, ZNRD1)是一种转录伴随基因, 且其在人类胃癌细胞中表达下调. Hong et al[35]通过构建ZNRD1 siRNA的表达型载体转染正常胃上皮细胞(GES-1), 结果发现细胞增殖明显加快. 同时他们ZNRD1基因转染(SGC7901), 结果SGC7901细胞生长明显减慢, 同时发现肿瘤MVD降低, 其机制是抑制VEGF的表达. 从而证实了ZNRD与肿瘤血管的生成相关.
Zhao et al[36]在探索Plexin A1在胃癌的表达及其与胃癌血管发生和增殖的关系得研究中, 对50例胃癌样本与20例正常黏膜组织进行比较, 用免疫组化法检测, 发现Plexin A1在癌组织中高表达, 与MVD呈正相关. 从而证实Plexin A1是胃癌发生发展中的一个重要因子, 他可能通过调节肿瘤血管生成促进肿瘤增殖. 同时研究发现Plexin A1表达水平与VEGF表达水平不相关.
骨桥蛋白(osteopontin, OPN)在多种类型肿瘤的发生, 侵袭和转移过程中都具有重要作用. Tang et al[37]经研究证实了OPN在胃癌组织中高表达且伴随MVD增高. 此后他们进一步应用siRNA干扰OPN的表达, 结果显示肿瘤的增殖, 迁移均减弱, MVD降低, 从而证实了OPN与肿瘤血管的发生有关.
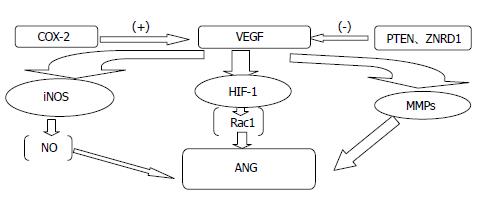
以上研究表明肿瘤的血管生成是一个多因素、级联、整体、动态的过程. 他受多种因子的调节, 这些血管的新生是促血管生成因子和血管生成抑制因子间失衡的结果. 我们将他们之间的联系用简单的图示表示(图1).
各因子之间的作用也不是孤立的, 而是相互协调共同作用, 其中VEGF、COX-2、HIF-1、 iNOS、MMPs、ANG这些因子在肿瘤血管的生成中发挥了至关重要的作用, 许多因子都是通过调节这些因子来发挥作用, 如HPA通过调节COX-2的表达影响血管生成, 血管紧张素Ⅱ则通过与其受体AT1R结合进而影响MMPs的表达来发挥作用. 而ANG与血管的生成直接相关因此成为各因子调节的最终靶点. 而CAM类因子位于细胞表面参与细胞间黏附及信号传递, 其异常表达不仅对肿瘤的侵袭力产生明显影响, 同时也可以通过调节细胞内其他因子的表达来影响肿瘤血管的生成. 当然还有好多因子的具体作用机制还没有完全明确, 但随着研究的进展我们对胃癌血管生成相关因子会有更清晰的认识, 同时也为胃癌的抗血管治疗提供更多更可靠的依据.
肿瘤血管生成是一个受多种不同层次调节的过程, 很显然, 针对肿瘤血管生成的治疗措施可以成为一种新颖的抗癌途径. 近年来, 由于人们的对实体瘤内皮细胞增殖动力学研究的不断深入, 针对肿瘤血管的治疗措施也迅速发展起来. 抗血管生成药物可能的作用机制包括: (1)阻断血管生成因子及其平受体的作用; (2)阻断细胞外基质反应或降解; (3)抑制内皮细胞增殖或促进其凋亡; (4)抗血管生成基因治疗. 以下为这几方面的研究进展.
VEGF是肿瘤血管生成的重要促进因子, 最近有很多研究针对这一因子进行胃癌的抗血管肿瘤治疗. Zhu et al[38]研究表明食子儿茶精类药物EGCG(epigallocatechin-3-gallate)对SGC-7901细胞的影响, 并对VEGF表达水平和肿瘤增殖与侵袭能力进行检测. 发现EGCG抑制了VEGF的表达, 瘤组织的MVD明显减低, 肿瘤的增殖和侵袭被明显抑制. 说明EGCG通过抑制VEGF发挥对肿瘤的治疗效果. Chen et al[39]和陈金联 et al[40]则研究N-去硫酸肝素对胃癌转移和血管发生的影响, 结果证实N-去硫酸肝素的应用明显抑制了VEGF的mRNA和蛋白水平的表达, 瘤组织的MVD明显减低. 有研究证实成纤维细胞生长因子(FGF)同样可以被末端脱硫肝素抑制[41]. 说明末端脱硫肝素对肿瘤血管生成的抑制作用是对多因子作用的结果. 缺氧诱导因子(HIF)在肿瘤血管的发生中同样有重要作用, Lang et al[42]研究发现雷怕霉素[抗真菌抗生素]通过抑制HIF阻遏了瘤组织内血管的发生, 对肿瘤的治疗在体内体外都有明显效果. COX-2促进肿瘤血管的生成已经得到许多研究的证实, Wu et al[43]联合应用舒林酸(非甾体抗炎药)和塞来考昔(抗关节炎药), COX-2抑制剂对胃癌进行治疗, 瘤组织MVD被抑制, 证实了非甾体抗炎药的抗癌作用. 当然这方面的研究很多在此不再列举.
基质金属蛋白酶降解血管基底膜和细胞外基质, 促进血管的新生. 我们知道MMP-2和MMP-9在肿瘤血管的发生中起重要作用, Stetler-Stevenson[44]研究发现金属蛋白酶组织抑制因子-2(tissue inhibitor of metalloproteinase TIMP-2)对肿瘤血管的发生具有明显的抑制作用, 从而为胃癌的抗血管治疗提供了新的治疗靶点. Miyagi et al[45]则证实TIMP-1同样能够阻遏肿瘤血管的生成, 对胃癌的侵袭转移产生明显的抑制作用. 这些研究预示了TIMP家族在胃癌抗血管治疗中的良好应用前景.
一些抗血管生成的抑制剂通过抑制内皮细胞增殖或促进其凋亡阻遏肿瘤血管的发生, 抑制肿瘤的生长与转移. Hu et al[46]研究发现ATF-Fc依赖uPAR和Fc片段对血管内皮细胞有明显的细胞毒性效应, 抗肿瘤血管生成. Song et al[47]研究发现血管生成抑制剂NM-3通过调节survivin、Bcl-2、Bax和P53促进血管内皮细胞凋亡, 抑制肿瘤血管的生成, 对胃癌的生长和侵袭转移有明显的抑制效果. 此外还有一些针对内皮细胞增殖和凋亡的抗血管生成抑制剂的研究, 都对瘤细胞的增长和侵袭转移产生了明显的抑制效果[48-49].
抗血管生成基因治疗策略是对肿瘤血管调控因子及其作用环节进行干预, 其机制包括从基因水平抑制血管生成促进因子的表达及释放, 或促进抗血管生成因子的表达及释放, 或诱导血管内皮细胞凋亡. 抑癌基因p53的突变可以引起肿瘤血管的发生. Zhang et al[50]研究发现CPT21是一种半合成水溶性喜树碱类似物, 他通过上调P53、phospho-P53、 P21、BAX等来抑制肿瘤的血管发生及转移对胃癌的治疗有明显效果. 内皮他丁表达的上调能够明显抑制肿瘤血管的生成, Wu et al[51]研究发现在胃癌细胞系SGC7901中上调内皮他丁可以使瘤组织的MVD明显减低(P<0.05). Zhang et al[52]研究病毒基因疗法治疗胃癌, 他们用腺病毒作载体将内皮他丁的基因转到胃癌细胞中, 内皮他丁基因整合入宿主细胞指导内皮他丁的生物合成, 结果使肿瘤自身血管的生成受到明显抑制.
胃癌血管生成是胃癌发生、发展的前提, 对胃癌血管生成机制更深入的研究, 有助于胃癌的早期诊断、临床预后判断及抗胃癌血管生成的探索. 抗血管生成治疗胃癌是一个新领域, 血管生成抑制剂不仅能抑制肿瘤血管生成, 而且可促进肿瘤细胞凋亡, 他具有毒副作用小、可持续给药、不易产生耐药等优点. 但与血管生成相关的因子众多, 如何从中选取关键因子从而达到更有效的抗血管治疗目的成为我们亟待解决的问题. 综上研究成果我们发现VEGF、COX-2、HIF-1、iNOS、MMPs、ANG在肿瘤血管生成中发挥了关键作用, 因此在抗肿瘤血管生成的研究中针对这些因子会更有效. 同时联合基因治疗和药物治疗不仅能提高疗效还能降低药物使用剂量从而减少耐药和毒副作用, 必将成为以后研究的热点. 近年来, 胃癌血管生成抑制剂方面的研究越来越多, 部分已经进临床试验研究阶段, 因此可以预见随着研究的进展抗血管治疗在胃癌生长及其侵袭转移的治疗中将显示出更广阔的应用前景.
肿瘤组织中的血管密度和数量与肿瘤的侵袭转移潜能密切相关, 而肿瘤血管新生是促血管生成因子和血管生成抑制因子间失衡的结果, 针对血管生成相关因子的抗血管生成治疗策略成为抗肿瘤治疗中的新方法.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 程斌, 副教授, 华中科技大学同济医学院附属同济医院消化内科.
目前研究多是通过引入外源性血管生成抑制剂来抑制血管的新生从而达到抑瘤目的, 还有研究通过引入对血管生成起负性调节作用的抑癌基因从基因水平治疗肿瘤. 但与血管生成相关的因子众多, 如何从中选取关键因子从而达到更有效的抗血管治疗目的成为我们亟待解决的问题.
本文不仅将近几年与胃癌血管生成相关的因子作了汇总, 还对他们之间的关系进行了概括总结, 并筛选出了血管生成中的几个关键因子.
本文筛选出的血管生成中的关键因子对今后抗血管生成治疗的研究有重要意义. 同时联合基因和药物治疗也是今后研究的一个重要方向.
1 血管生成: 当一个肿瘤灶长到直径1-2 mm大小时, 单靠弥散已不能满足氧气和营养物质的供应及代谢产物排泄, 必须依赖新生的血管来维持继续增长的需求, 此时肿瘤细胞(可能所有组织都如此)能分泌一些物质来促进新生血管的形成, 这个过程称为血管生成.
2 抗血管生成治疗: 肿瘤抗血管生成治疗是指针对肿瘤新生血管的靶向治疗. 肿瘤的生长、转移均需要肿瘤血管生成, 20世纪70年代 Folkman就提出通过抑制肿瘤新生血管治疗肿瘤的目的, 直到近2年才在临床实现.
本文信息量较大引用文献较新, 但全文逻辑性欠佳各因子间的关系交待欠清晰. 总体而言, 具有一定参考价值.
编辑: 李军亮 电编:郭海丽
| 1. | Raica M, Mogoanta L, Cimpean AM, Alexa A, Ioanovici S, Margaritescu C, Lazar D, Izvernariu D. Immunohistochemical expression of vascular endothelial growth factor (VEGF) in intestinal type gastric carcinoma. Rom J Morphol Embryol. 2008;49:37-42. [PubMed] |
| 2. | Lazar D, Taban S, Raica M, Sporea I, Cornianu M, Goldis A, Vernic C. Immunohistochemical evaluation of the tumor neoangiogenesis as a prognostic factor for gastric cancers. Rom J Morphol Embryol. 2008;49:137-148. [PubMed] |
| 3. | Kolev Y, Uetake H, Iida S, Ishikawa T, Kawano T, Sugihara K. Prognostic significance of VEGF expression in correlation with COX-2, microvessel density, and clinicopathological characteristics in human gastric carcinoma. Ann Surg Oncol. 2007;14:2738-2747. [PubMed] |
| 4. | Chaffer CL, Dopheide B, Savagner P, Thompson EW, Williams ED. Aberrant fibroblast growth factor receptor signaling in bladder and other cancers. Differentiation. 2007;75:831-842. [PubMed] [DOI] |
| 5. | Ma J, Zhang L, Ru GQ, Zhao ZS, Xu WJ. Upregulation of hypoxia inducible factor 1alpha mRNA is associated with elevated vascular endothelial growth factor expression and excessive angiogenesis and predicts a poor prognosis in gastric carcinoma. World J Gastroenterol. 2007;13:1680-1686. [PubMed] |
| 6. | Cabuk D, Basaran G, Celikel C, Dane F, Yumuk PF, Iyikesici MS, Ekenel M, Turhal NS. Vascular endothelial growth factor, hypoxia-inducible factor 1 alpha and CD34 expressions in early-stage gastric tumors: relationship with pathological factors and prognostic impact on survival. Oncology. 2007;72:111-117. [PubMed] [DOI] |
| 7. | Mizokami K, Kakeji Y, Oda S, Irie K, Yonemura T, Konishi F, Maehara Y. Clinicopathologic significance of hypoxia-inducible factor 1alpha overexpression in gastric carcinomas. J Surg Oncol. 2006;94:149-154. [PubMed] [DOI] |
| 8. | Lee BL, Kim WH, Jung J, Cho SJ, Park JW, Kim J, Chung HY, Chang MS, Nam SY. A hypoxia-independent up-regulation of hypoxia-inducible factor-1 by AKT contributes to angiogenesis in human gastric cancer. Carcinogenesis. 2008;29:44-51. [PubMed] [DOI] |
| 9. | Wang J, Wu KC, Zhang DX, Fan DM. Antisense angiopoietin-1 inhibits tumorigenesis and angiogenesis of gastric cancer. World J Gastroenterol. 2006;12:2450-2454. [PubMed] |
| 10. | Moon WS, Park HS, Yu KH, Jang KY, Kang MJ, Park H, Tarnawski AS. Expression of angiopoietin 1, 2 and their common receptor Tie2 in human gastric carcinoma: implication for angiogenesis. J Korean Med Sci. 2006;21:272-278. [PubMed] |
| 11. | Zhang ZZ, Zhang S, Lin JY, Huang PS, Chen YP. Correlation between the expression of angiopoietins and their receptor and angiogenesis in gastric cancers. Zhonghua Zhongliu Zazhi. 2006;28:280-284. [PubMed] |
| 12. | Chen Y, Zhang S, Chen YP, Lin JY. Increased expression of angiogenin in gastric carcinoma in correlation with tumor angiogenesis and proliferation. World J Gastroenterol. 2006;12:5135-5139. [PubMed] |
| 13. | Tanaka F, Tominaga K, Shiota M, Ochi M, Kuwamura H, Tanigawa T, Watanabe T, Fujiwara Y, Oshitani N, Higuchi K. Interleukin-10 gene transfer to peritoneal mesothelial cells suppresses peritoneal dissemination of gastric cancer cells due to a persistently high concentration in the peritoneal cavity. Cancer Gene Ther. 2008;15:51-59. [PubMed] [DOI] |
| 14. | Han HS, Hwang TS. Angiogenesis in gastric cancer: importance of the thymidine phosphorylase expression of cancer cells as an angiogenic factor. Oncol Rep. 2007;17:61-65. [PubMed] |
| 15. | Jang JS, Lee WS, Lee JS, Kim HW, Ko GH, Ha WS. The expression of thymidine phosphorylase in cancer-infiltrating inflammatory cells in stomach cancer. J Korean Med Sci. 2007;22 Suppl:S109-S114. [PubMed] |
| 16. | Huang W, Yu LF, Zhong J, Qiao MM, Jiang FX, Du F, Tian XL, Wu YL. Angiotensin II type 1 receptor expression in human gastric cancer and induces MMP2 and MMP9 expression in MKN-28 cells. Dig Dis Sci. 2008;53:163-168. [PubMed] [DOI] |
| 17. | Tang H, Wang J, Bai F, Zhai H, Gao J, Hong L, Xie H, Zhang F, Lan M, Yao W. Positive correlation of osteopontin, cyclooxygenase-2 and vascular endothelial growth factor in gastric cancer. Cancer Invest. 2008;26:60-67. [PubMed] [DOI] |
| 18. | Mao XY, Wang XG, Lv XJ, Xu L, Han CB. COX-2 expression in gastric cancer and its relationship with angiogenesis using tissue microarray. World J Gastroenterol. 2007;13:3466-3471. [PubMed] |
| 19. | Zhao HC, Qin R, Chen XX, Sheng X, Wu JF, Wang DB, Chen GH. Microvessel density is a prognostic marker of human gastric cancer. World J Gastroenterol. 2006;12:7598-7603. [PubMed] |
| 20. | Lei T, Han S, Guo XY, Ding R, Li Y, Xie HH, Bai FH, Wu KC, Ding J. The potential role of Id1 in COX-2 mediated angiogenesis in gastric cancer. Zhonghua Yixue Zazhi. 2007;87:1570-1575. [PubMed] |
| 21. | Zheng H, Takahashi H, Murai Y, Cui Z, Nomoto K, Niwa H, Tsuneyama K, Takano Y. Expressions of MMP-2, MMP-9 and VEGF are closely linked to growth, invasion, metastasis and angiogenesis of gastric carcinoma. Anticancer Res. 2006;26:3579-3583. [PubMed] |
| 22. | Zheng HC, Takahashi H, Murai Y, Cui ZG, Nomoto K, Miwa S, Tsuneyama K, Takano Y. Upregulated EMMPRIN/CD147 might contribute to growth and angiogenesis of gastric carcinoma: a good marker for local invasion and prognosis. Br J Cancer. 2006;95:1371-1378. [PubMed] [DOI] |
| 23. | Jin X, Yagi M, Akiyama N, Hirosaki T, Higashi S, Lin CY, Dickson RB, Kitamura H, Miyazaki K. Matriptase activates stromelysin (MMP-3) and promotes tumor growth and angiogenesis. Cancer Sci. 2006;97:1327-1334. [PubMed] [DOI] |
| 24. | Ohtawa Y, Naomoto Y, Shirakawa Y, Takaoka M, Murata T, Sonoda R, Sakurama K, Yamatsuji T, Gunduz M, Tsujigiwa H. The close relationship between heparanase and cyclooxygenase-2 expressions in signet-ring cell carcinoma of the stomach. Hum Pathol. 2006;37:1145-1152. [PubMed] [DOI] |
| 25. | Chen CN, Hsieh FJ, Cheng YM, Chang KJ, Lee PH. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in angiogenesis and clinical outcome of human gastric cancer. J Surg Oncol. 2006;94:226-233. [PubMed] [DOI] |
| 26. | Zhou Y, Ran J, Tang C, Wu J, Honghua L, Xingwen L, Ning C, Qiao L. Effect of celecoxib on E-cadherin, VEGF, Microvessel density and apoptosis in gastric cancer. Cancer Biol Ther. 2007;6:269-275. [PubMed] [DOI] |
| 27. | Jiang CG, Li JB, Liu FR, Wu T, Yu M, Xu HM. Andrographolide inhibits the adhesion of gastric cancer cells to endothelial cells by blocking E-selectin expression. Anticancer Res. 2007;27:2439-2447. [PubMed] |
| 28. | Ding YB, Chen GY, Xia JG, Zang XW, Yang HY, Yang L. Association of VCAM-1 overexpression with oncogenesis, tumor angiogenesis and metastasis of gastric carcinoma. World J Gastroenterol. 2003;9:1409-1414. [PubMed] |
| 29. | Li SG, Ye ZY, Zhao ZS, Tao HQ, Wang YY, Niu CY. Correlation of integrin beta3 mRNA and vascular endothelial growth factor protein expression profiles with the clinicopathological features and prognosis of gastric carcinoma. World J Gastroenterol. 2008;14:421-427. [PubMed] [DOI] |
| 30. | Tsuchiya T, Okaji Y, Tsuno NH, Sakurai D, Tsuchiya N, Kawai K, Yazawa K, Asakage M, Yamada J, Yoneyama S. Targeting Id1 and Id3 inhibits peritoneal metastasis of gastric cancer. Cancer Sci. 2005;96:784-790. [PubMed] [DOI] |
| 31. | Miyamoto N, Yamamoto H, Taniguchi H, Miyamoto C, Oki M, Adachi Y, Imai K, Shinomura Y. Differential expression of angiogenesis-related genes in human gastric cancers with and those without high-frequency microsatellite instability. Cancer Lett. 2007;254:42-53. [PubMed] [DOI] |
| 32. | Yu HG, Ai YW, Yu LL, Zhou XD, Liu J, Li JH, Xu XM, Liu S, Chen J, Liu F. Phosphoinositide 3-kinase/Akt pathway plays an important role in chemoresistance of gastric cancer cells against etoposide and doxorubicin induced cell death. Int J Cancer. 2008;122:433-443. [PubMed] [DOI] |
| 33. | He RF, Hu ZL, Wen JF. Biological implication of PTEN gene expression in human gastric cancer and related molecular mechanisms. Zhonghua Binglixue Zazhi. 2007;36:324-328. [PubMed] |
| 34. | Xue Y, Bi F, Zhang X, Pan Y, Liu N, Zheng Y, Fan D. Inhibition of endothelial cell proliferation by targeting Rac1 GTPase with small interference RNA in tumor cells. Biochem Biophys Res Commun. 2004;320:1309-1315. [PubMed] [DOI] |
| 35. | Hong L, Zhao Y, Han Y, Guo W, Jin H, Qiao T, Che Z, Fan D. Mechanisms of growth arrest by zinc ribbon domain-containing 1 in gastric cancer cells. Carcinogenesis. 2007;28:1622-1628. [PubMed] [DOI] |
| 36. | Zhao XY, Chen L, Xu Q, Li YH. Expression of Plexin A1 in gastric carcinoma and its relationship with tumor angiogenesis and proliferation. Zhonghua Weichang Waike Zazhi. 2007;10:265-268. [PubMed] |
| 37. | Tang H, Wang J, Bai F, Hong L, Liang J, Gao J, Zhai H, Lan M, Zhang F, Wu K. Inhibition of osteopontin would suppress angiogenesis in gastric cancer. Biochem Cell Biol. 2007;85:103-110. [PubMed] [DOI] |
| 38. | Zhu BH, Zhan WH, Li ZR, Wang Z, He YL, Peng JS, Cai SR, Ma JP, Zhang CH. (-)-Epigallocatechin-3-gallate inhibits growth of gastric cancer by reducing VEGF production and angiogenesis. World J Gastroenterol. 2007;13:1162-1169. [PubMed] |
| 39. | Chen JL, Hong J, Lu JL, Chen MX, Chen WX, Zhu JS, Chen NW, Chen GQ, Geng JG. Effect of non-anticoagulant N-desulfated heparin on expression of vascular endothelial growth factor, angiogenesis and metastasis of orthotopic implantation of human gastric carcinoma. World J Gastroenterol. 2007;13:457-461. [PubMed] |
| 40. | 陈 金联, 陆 金来, 陈 明祥, 陈 维雄, 朱 金水, 陈 尼维, 陈 国强, 耿 建国. N-去硫酸肝素对SCID小鼠胃癌血管生成和VEGF 表达的影响. 世界华人消化杂志. 2005;13:2685-2688. [DOI] |
| 41. | Chen MX, Chen JL, Lu JL, Hong J, Chen WX, Zhu JS, Chen NW, Geng JG. Inhibition of bFGF gene expression and tumor angiogenesis of orth otopic implantation of human gastric carcinoma by N-desulfated heparin. Zhonghua Yixue Yichuanxue Zazhi. 2008;25:78-81. [PubMed] |
| 42. | Lang SA, Gaumann A, Koehl GE, Seidel U, Bataille F, Klein D, Ellis LM, Bolder U, Hofstaedter F, Schlitt HJ. Mammalian target of rapamycin is activated in human gastric cancer and serves as a target for therapy in an experimental model. Int J Cancer. 2007;120:1803-1810. [PubMed] [DOI] |
| 43. | Wu YL, Fu SL, Zhang YP, Qiao MM, Chen Y. Cyclooxygenase-2 inhibitors suppress angiogenesis and growth of gastric cancer xenografts. Biomed Pharmacother. 2005;59 Suppl 2:S289-S292. [PubMed] [DOI] |
| 44. | Stetler-Stevenson WG. The tumor microen-vironment: regulation by MMP-independent effects of tissue inhibitor of metalloproteinases-2. Cancer Metastasis Rev. 2008;27:57-66. [PubMed] [DOI] |
| 45. | Miyagi M, Aoyagi K, Kato S, Shirouzu K. The TIMP-1 gene transferred through adenovirus mediation shows a suppressive effect on peritoneal metastases from gastric cancer. Int J Clin Oncol. 2007;12:17-24. [PubMed] [DOI] |
| 46. | Hu XW, Duan HF, Gao LH, Pan S, Li YM, Xi Y, Zhao SR, Yin L, Li JF, Chen HP. Inhibition of Tumor Growth and Metastasis by ATF-Fc, an Engineered Antibody: Targeting Urokinase Receptor. Cancer Biol Ther. 2008;7. [PubMed] |
| 47. | Song MQ, Zhu JS, Chen JL, Wang L, Da W, Zhu L, Zhang WP. Synergistic effect of oxymatrine and angiogenesis inhibitor NM-3 on modulating apoptosis in human gastric cancer cells. World J Gastroenterol. 2007;13:1788-1793. [PubMed] |
| 48. | Chen JL, Zhu JS, Hong J, Chen MX, Lu JL, Chen WX, Shen B, Zhu ZM, Chen NW. Effect of 2-(8-hydroxy-6-methoxy-1-oxo- 1H-2-benzopyran-3-yl) propionic acid in combination with carboplatin on gastric carcinoma growth in vivo. World J Gastroenterol. 2007;13:509-514. [PubMed] |
| 49. | Koehl GE, Wagner F, Stoeltzing O, Lang SA, Steinbauer M, Schlitt HJ, Geissler EK. Mycophenolate mofetil inhibits tumor growth and angiogenesis in vitro but has variable antitumor effects in vivo, possibly related to bioavailability. Transplantation. 2007;83:607-614. [PubMed] [DOI] |
| 50. | Zhang B, Luo Y, Weng Q, He Q, Lu W, Yang B. CPT21, a novel compound with anti-proliferative effect against gastric cancer cell SGC7901. Invest New Drugs. 2008;. [PubMed] |
| 51. | Wu J, Shi YQ, Wu KC, Zhang DX, Yang JH, Fan DM. Angiostatin up-regulation in gastric cancer cell SGC7901 inhibits tumorigenesis in nude mice. World J Gastroenterol. 2003;9:59-64. [PubMed] |
| 52. | Zhang Q, Nie M, Sham J, Su C, Xue H, Chua D, Wang W, Cui Z, Liu Y, Liu C. Effective gene-viral therapy for telomerase-positive cancers by selective replicative-competent adenovirus combining with endostatin gene. Cancer Res. 2004;64:5390-5397. [PubMed] [DOI] |