修回日期: 2008-04-09
接受日期: 2008-06-08
在线出版日期: 2008-06-28
目的: 研究regⅠ在急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)大鼠肠组织中的表达, 探讨该基因的表达与ANP肠黏膜损害的关系.
方法: Sprague-Dawley大鼠随机分为假手术对照组(n = 40)和ANP组(n = 80). 对照组开腹后只翻动胰腺, ANP组大鼠胰胆管恒速逆行注射30 g/L牛磺胆酸钠, 制成ANP大鼠模型. 观察胰腺和小肠的病理改变及小肠黏膜通透性的改变, 应用逆转录聚合酶链反应(RT-PCR)检测胰腺、小肠组织中regⅠ mRNA的表达水平, 并研究所观察指标与regⅠ基因表达的相关性.
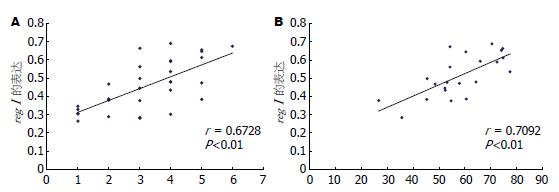
结果: ANP组大鼠术后12, 24和36 h肠黏膜组织病理学评分明显高于对照组(1.8±0.89 vs 0.2±0.42, 3.3±1.17 vs 0.3±0.48, 4.2±0.95 vs 0.3±0.48, 均P<0.01); ANP组大鼠[99mTc]-DTPA排泄率术后12, 24和36 h较对照组均明显增加(34.70%±4.03% vs 4.62%±1.17%, 54.63%±6.94% vs 6.14%±1.42%, 66.83%±7.56% vs 7.48%±0.92%, 均P<0.01); 与对照组相比, ANP组大鼠小肠组织中reg Ⅰ的mRNA水平过度表达, reg Ⅰ的表达水平分别与肠黏膜病理学评分和肠黏膜通透性指数正相关(r = 0.6728, 0.7092, 均P<0.01).
结论: ANP时大鼠小肠组织中regⅠ mRNA的表达水平明显上调且与ANP所致肠黏膜损害的严重程度相关.
引文著录: 胡浩霖, 石欣, 张齐, 孔波. regⅠ基因表达与肠黏膜损害在急性坏死性胰腺炎中的相关性. 世界华人消化杂志 2008; 16(18): 1985-1989
Revised: April 9, 2008
Accepted: June 8, 2008
Published online: June 28, 2008
AIM: To investigate gene expression of reg I in intestinal tissues in rats with acute necrotizing pancreatitis (ANP) and to determine correlation between reg Ⅰ gene expression and intestinal mucosal lesion.
METHODS: Sprague-Dawley rats were randomly allocated into the control group (n = 40) and ANP group (n = 80). The rats in control group received laparotomy only. In ANP group, 30 g/L sodium taurocholate was injected under constant temperature into the pancreatic duct to develop the ANP model. Reverse transcriptase polymerase chain reaction (RT-PCR) was performed to detect reg Ⅰ mRNA level in pancreas and intestines. The pathologic changes of pancreas and intestines were observed, the permeability of intestinal mucosa was estimated. The measured parameters were evaluated to find whether correlation exited between reg Ⅰ mRNA expression level and pathological mucosal changes of ANP.
RESULTS: The intestinal pathological scores of ANP rats were significantly higher than that of control group at 12, 24, 36 h (1.8 ± 0.89 vs 0.2 ±0.42, 3.3 ± 1.17 vs 0.3 ± 0.48, 4.2 ± 0.95 vs 0.3 ± 0.48, all P < 0.01), postoperatively. The excretory rate of [99mTc]-DTPA in ANP rats were higher at 12, 24, 36 h, postoperatively, compared with control group (34.70% ± 4.03% vs 4.62% ± 1.17%, 54.63% ± 6.94% vs 6.14% ± 1.42%, 66.83% ± 7.56% vs 7.48% ± 0.92%, all P < 0.01). Reg Ⅰ mRNA was highly expressed in intestine in ANP rats compared with that in control group. Reg Ⅰ expression level was positively correlated with intestinal pathological scores(r = 0.6728, P < 0.01) and with intestinal permeability (r = 0.7092, P < 0.01).
CONCLUSION: Reg Ⅰ mRNA expression is up-regulated in intestinal tissues in ANP rats, and expression level of reg Ⅰ is positively correlated with severity of intestinal mucosal lesion caused by ANP.
- Citation: Hu HL, Shi X, Zhang Q, Kong B. Correlation between reg I expression and intestinal mucosal lesion of acute necrotizing pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1985-1989
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1985
急性坏死型胰腺炎(acute necrotizing pancreatitis, ANP)病程凶险, 并发症多, 病死率高[1]. 肠黏膜损害所致肠道细菌或内毒素移位并发脓毒症及脓毒症相关的多器官功能衰竭是发病2-3 wk死亡的主要原因, 死亡率可达50%, 也是ANP时威胁生命的主要并发症之一. 因此, ANP时的肠黏膜损害被认为是目前影响ANP死亡率最重要的风险因素之一[2]. ANP时肠黏膜损害的发病机制一直是研究热点, 近年来, 再生基因regⅠ在ANP发生发展过程中的作用日益受到重视, 但对于其在ANP时肠黏膜损害中的作用了解甚少. 我们探讨ANP大鼠模型中regⅠ基因在肠组织中的表达情况, 探讨其表达与肠黏膜损害的相关性, 以期进一步了解ANP时肠黏膜损害的病理机制、发展过程, 为ANP的治疗提供实验和理论依据.
健康成年Sprague-Dawley大鼠120只, 体质量230-270 g. 实验前禁食12 h, 不禁饮水. 10 g/L氯胺酮100 mg/kg, ip麻醉. 采用胆胰管内逆行注射30 g/L牛磺胆酸钠1 mL/kg制作ANP模型(n = 80). 假手术对照组(n = 40)仅将十二指肠提出切口, 轻轻翻动胰腺3次, 不注射牛磺胆酸钠, 余操作步骤与ANP组相同. 分别于术后12, 24和36 h各处死20只ANP大鼠和10只对照组大鼠, 留取末段回肠、胰腺和门静脉血标本. 获取新鲜组织后, 立即切成块状并投入液氮, 保存在-80℃超低温冰箱中, 或经40 g/L甲醛固定后脱水包埋、常规切片. 血液分离血浆后进行淀粉酶测定(碘-淀粉比色法).
1.2.1 肠黏膜通透性的检测: 用同位素99mTc标记的亚锡喷替酸(99mtechnetium diethlene triamine pentacetic acid, 99mTc-DTPA)为探针, 分子直径为11 nm, 可反映肠黏膜腺管细胞间紧密连接的通透性. 一般情况下, 仅有不到10%的DTPA可以通过正常肠黏膜, 当肠黏膜受损、通透性增加时, 更多的DTPA可以通过肠黏膜, 进入血液循环, 而后迅速从肾脏排出, 因此尿液中同位素脉冲数可以间接反映肠黏膜通透性. 肠黏膜通透性(%) = [99mTc]-DTPA排泄率(%) = (尿液测定值-本底测定值)×总尿量/(药物测定值-本底测定值)×100%.
用灭菌生理盐水淋洗钼-锝发生器获得[99mTc](中国核动力研究设计院第一研究所)淋洗液, 放射活度仪测定其放射活度, 灭菌生理盐水将其稀释成放射活度为3.7 MBq DTPA(中国原子能科学研究院同位素所)标记. 术中于近端空肠内缓慢注入3.7 MBq [99mTc]-DTPA. 术后放入代谢笼, 留取12, 24和36 h尿液. 于上述时相点测量大鼠尿液, 用放射免疫γ计数器测定尿中[99mTc]-DTPA脉冲数.
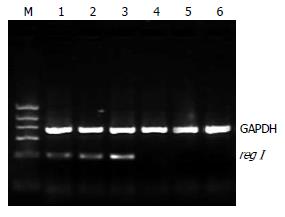
1.2.2 regⅠ半定量分析: 总RNA的提取按照TRIzol法. 简介如下, 将组织置于TRIzol裂解液中研碎, 裂解后依次以氯仿、异丙醇抽提, 在冷乙醇中沉淀, 溶于不含RNA酶的水中, -80℃冰箱保存. 上述RNA经过DNA酶处理后, 总RNA被逆转录成cDNA(大连宝生物公司逆转录试剂盒), 逆转录所得cDNA在-20℃保存. 应用Primer premier软件进行引物设计, regⅠ基因和GAPDH的引物序列见表1. 所有引物由Invitrogen公司合成.
| 基因名称 | 引物 | 序列 | 扩增片段(bp) |
| SregⅠ | 上游引物 | 5'-GCC AGG AGG CTG AAG AAG-3' | 316 |
| 下游引物 | 5'-CCA GTG TCC CAG GAT TTG-3' | ||
| GAPDH | 上游引物 | 5'-GTT CAA CGG CAC AGT CAA-3' | 671 |
| 下游引物 | 5'-CCT CAG TGT AGC CCA GGA T-3' |
PCR反应体积为25 μL, 含cDNA模板3 μL、25 mmol/L MgCl2 1 μL、上下游引物各1.5 μL和0.25 μL 83.35 mkaf/L Tap酶. 反应条件如下: 94℃预变性2 min, 94℃变性30 s, 54℃复性30 s, 72℃延伸1 min, 32个循环, 72℃延伸7 min, 4℃终止反应. 反应完成后, 取5 μL扩增产物常规进行15 g/L琼脂糖凝胶电泳(100 V, 40 min), 鉴定扩增产物. 以上PCR扩增重复3遍, 结果经过计算机扫描(ImageMaster VDS), 用标准曲线法进行regⅠ的半定量分析.
1.2.3 胰腺和小肠组织的病理学检查: 胰腺、小肠组织于40 g/L甲醛溶液中固定12 h后, 常规石蜡包埋、切片, HE染色, 进行光镜观察. 用单盲法对胰腺、小肠组织进行病理学评分.
统计学处理 用SPSS软件对数据进行统计学分析, 计量资料采用t检验, 各组数据以mean±SD表示, P<0.05为差异有显著性.
ANP组血淀粉酶活性显著高于假手术对照组(P<0.05). 开腹证实腹腔内有血性腹水, 可见胰腺出血斑和坏死灶. 镜下病理检查也证实ANP的发生. ANP组大鼠术后12 h肠黏膜即出现水肿; 术后24 h肠黏膜水肿加重, 上皮变性、坏死; 术后36 h肠黏膜重度水肿, 上皮变性、坏死、脱落, 局部肠黏膜表面被覆假膜, 黏膜及黏膜下层可见血管扩张、出血及炎症细胞浸润(表2).
用同位素法检测肠黏膜通透性, 发现与对照组相比, ANP组大鼠术后12 h[99mTc]-DTPA排泄率明显增加, 而且随着时间推移, 其排泄率逐渐增加(表2), 提示肠黏膜通透性增加.
分别于术后12, 24和36 h各处死20只ANP大鼠和10只假手术对照组大鼠, 留取末段回肠组织, 以检查regⅠ mRNA的表达, 12 h上述基因的表达见图1. 在小肠组织中, regⅠ和GAPDH都得到了有效扩增, 各个标本中GAPDH基因的扩增基本一致(图1). 将RT-PCR检测小肠中regⅠ mRNA的表达与肠黏膜病理学评分和肠黏膜通透性指数进行相关性分析, 结果发现, regⅠ的表达水平分别与肠黏膜病理学评分(r = 0.6728, P<0.01)和肠黏膜通透性指数(r = 0.7092, P<0.01)明显正相关(图2).
肠道细菌或内毒素移位是导致胰腺肠源性感染的主要原因, 由此并发的脓毒症及脓毒症相关的多器官功能衰竭死亡率可达50%. 肠道黏膜屏障功能的损害是造成肠道细菌移位的重要原因. 对于肠黏膜损害, 目前比较一致的意见是组织损伤、感染、缺血等因素导致胃肠道黏膜屏障功能受损、免疫抑制和肠道菌群改变, 三者相互作用可促使肠源性细菌和内毒素通过血液、淋巴、腹膜等途径移位至远隔器官. 移位的肠道细菌和毒素使循环中的细胞因子再次升高, 对全身各脏器造成再次损害, 形成所谓的"二次打击", 但其确切机制还不清楚. 研究表明, 肠源性内毒素血症不仅与ANP的严重程度密切相关, 而且是导致ANP并发多器官功能衰竭的主要原因[3].
人regⅠ基因编码的RegⅠ蛋白含166个氨基酸, 分子质量约为16-19 kDa左右, 是一种分泌蛋白, 其主要功能是促进胰岛细胞的增殖和改善糖尿病的发病状态, 同时与胰腺结石的形成也存在密切关系. 大量研究发现regⅠ基因与人类疾病关系密切, 在人类糖尿病、胃溃疡、胰腺炎、心肌梗死、胃肿瘤、肝脏肿瘤、结直肠肿瘤等疾病的发生发展过程中均存在着不同程度的regⅠ基因的过度表达或表达下调[4-10], 但其表达水平的改变在这些疾病的发生发展过程的作用目前尚不清楚. 自1988年Terazono et al[11]成功将regⅠ基因分离出来后, 为阐明regⅠ基因的功能, 研究人员做了大量的工作, 研究热点及研究较明确的部分主要集中在炎症和损伤方面, 发现作为再生蛋白, regⅠ主要是作为一种生长因子存在于胰腺中, 这可有他与钙依赖性凝集素的结构相似性、对胰腺β细胞和导管细胞的促有丝分裂效应[12]以及逆转术后高血糖的功能[13]所证实. 同时在其他组织中也有regⅠ基因的的表达, 包括胃组织细胞[14]; 用水浸淹大鼠造成应激性胃黏膜损害的模型, 在愈合过程中可见regⅠ基因的表达上调, 说明regⅠ基因参与了胃肠组织的再生和生长[15]; 而且已发现急性胰腺炎也可导致regⅠ基因表达的上调; 将RegⅠ蛋白的受体基因转入胰腺β细胞株RINm5F中, 使其受体表达上调, 再将其暴露于含RegⅠ蛋白的培养液中, 结果显示细胞的有丝分裂增强[18]. 以上都说明regⅠ基因作为一种再生基因, 在组织炎症或损伤后, 其表达上调, 发挥组织细胞再生和修复功能. 近年来研究发现, regⅠ基因作为参与急性胰腺炎的发生发展过程的成员, 其在ANP时在胰腺组织中表达上调且对损伤的胰腺组织起修复作用目前逐渐明确并已得到公认[6,19]. 然而regⅠ在ANP时小肠组织中的表达水平还不清楚, regⅠ在ANP肠黏膜损害中的作用也不清楚.
我们发现, 与假手术对照组相比, ANP小肠组织中regⅠ mRNA水平过度表达, regⅠ的表达与小肠组织病理学评分和肠黏膜通透性指数相关. 基于Reg Ⅰ蛋白及其受体蛋白在胰腺组织中参与胰腺损伤修复这一事实, 推测ANP时机体为促进肠黏膜损害的修复而导致regⅠ基因的上调, 从而对肠黏膜损害起修复作用. 但是过度表达的regⅠ是否可能加剧ANP时肠黏膜的损害尚不清楚. 在ANP时通过外部干预手段上调或下调小肠组织中regⅠ的表达, 是否可能导致肠黏膜屏障的改变, 值得进一步探讨.
由于人再生基因regⅠ与人类疾病的密切相关性, 目前该基因已引起了人们极大的关注与重视, 又由于人regⅠ基因生理状态下在人胰腺组织中表达较高或仅仅只在胰腺组织中表达, 因此该基因在胰腺疾病中的表达和临床意义更是成为研究热点.
樊晓明, 主任医师, 复旦大学附属金山医院消化科; 闻勤生, 教授, 中国人民解放军第四军医大学唐都医院消化内科.
急性坏死型胰腺炎(ANP)时肠黏膜损害的发病机制一直是研究热点, regⅠ基因在ANP发生发展过程中的作用日益受到重视.
大量研究发现regⅠ基因与人类疾病关系密切; regⅠ基因作为一种再生基因, 在组织炎症或损伤后, 其表达上调, 发挥组织细胞再生和修复功能; 近年来研究发现, regⅠ基因作为参与急性胰腺炎的发生发展过程的成员, 其在ANP时在胰腺组织中表达上调且对损伤的胰腺组织起修复作用目前逐渐明确. 但对于regⅠ基因在ANP时小肠组织中的表达水平还不清楚, 在ANP时肠黏膜损害中的作用了解甚少.
本研究进一步了解了ANP时肠黏膜损害的病理机制、发展过程, 为ANP的治疗提供实验和理论依据.
Reg基因: 在鼠、人等物种体内发现的一种能够促进胰腺β细胞再生的基因, 称之为再生基因(Reg). 该基因编码一种可以促进胰腺β细胞生长的分泌蛋白, 其主要功能是促进胰岛细胞的增殖和改善糖尿病的发病状态, 同时与胰腺结石的形成也存在密切关系. Reg是一个多基因家族, 迄今为止总共发现了Reg基因家族的17个成员, 根据编码蛋白质的氨基酸序列将其分成4个亚型分别是Ⅰ、Ⅱ、Ⅲ、Ⅳ.
本文为进一步研究regⅠ在ANP时肠黏膜损害中的作用和意义提供了基础, 具有较好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Hartwig W, Werner J, Muller CA, Uhl W, Buchler MW. Surgical management of severe pancreatitis including sterile necrosis. J Hepatobiliary Pancreat Surg. 2002;9:429-435. [PubMed] [DOI] |
| 2. | Gloor B, Muller CA, Worni M, Martignoni ME, Uhl W, Buchler MW. Late mortality in patients with severe acute pancreatitis. Br J Surg. 2001;88:975-979. [PubMed] [DOI] |
| 3. | Wig JD, Kochhar R, Ray JD, Krishna Rao DV, Gupta NM, Ganguly NK. Endotoxemia predicts outcome in acute pancreatitis. J Clin Gastroenterol. 1998;26:121-124. [PubMed] [DOI] |
| 4. | Qiu L, List EO, Kopchick JJ. Differentially expressed proteins in the pancreas of diet-induced diabetic mice. Mol Cell Proteomics. 2005;4:1311-1318. [PubMed] [DOI] |
| 5. | Kawanami C, Fukui H, Kinoshita Y, Nakata H, Asahara M, Matsushima Y, Kishi K, Chiba T. Regenerating gene expression in normal gastric mucosa and indomethacin-induced mucosal lesions of the rat. J Gastroenterol. 1997;32:12-18. [PubMed] [DOI] |
| 6. | Bluth MH, Patel SA, Dieckgraefe BK, Okamoto H, Zenilman ME. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 2006;12:4511-4516. [PubMed] |
| 7. | Kiji T, Dohi Y, Takasawa S, Okamoto H, Nonomura A, Taniguchi S. Activation of regenerating gene Reg in rat and human hearts in response to acute stress. Am J Physiol Heart Circ Physiol. 2005;289:H277-H284. [PubMed] [DOI] |
| 8. | Sekikawa A, Fukui H, Fujii S, Takeda J, Nanakin A, Hisatsune H, Seno H, Takasawa S, Okamoto H, Fujimori T. REG Ialpha protein may function as a trophic and/or anti-apoptotic factor in the development of gastric cancer. Gastroenterology. 2005;128:642-653. [PubMed] [DOI] |
| 9. | Yuan RH, Jeng YM, Chen HL, Hsieh FJ, Yang CY, Lee PH, Hsu HC. Opposite roles of human pancreatitis-associated protein and REG1A expression in hepatocellular carcinoma: association of pancreatitis-associated protein expression with low- stage hepatocellular carcinoma, beta-catenin mutation, and favorable prognosis. Clin Cancer Res. 2005;11:2568-2575. [PubMed] [DOI] |
| 10. | Sekikawa A, Fukui H, Fujii S, Nanakin A, Kanda N, Uenoyama Y, Sawabu T, Hisatsune H, Kusaka T, Ueno S. Possible role of REG Ialpha protein in ulcerative colitis and colitic cancer. Gut. 2005;54:1437-1444. [PubMed] [DOI] |
| 11. | Terazono K, Yamamoto H, Takasawa S, Shiga K, Yonemura Y, Tochino Y, Okamoto H. A novel gene activated in regenerating islets. J Biol Chem. 1988;263:2111-2114. [PubMed] |
| 12. | Zenilman ME, Magnuson TH, Swinson K, Egan J, Perfetti R, Shuldiner AR. Pancreatic thread protein is mitogenic to pancreatic-derived cells in culture. Gastroenterology. 1996;110:1208-1214. [PubMed] [DOI] |
| 13. | Watanabe T, Yonemura Y, Yonekura H, Suzuki Y, Miyashita H, Sugiyama K, Moriizumi S, Unno M, Tanaka O, Kondo H. Pancreatic beta-cell replication and amelioration of surgical diabetes by Reg protein. Proc Natl Acad Sci U S A. 1994;91:3589-3592. [PubMed] [DOI] |
| 14. | Perfetti R, Egan JM, Zenilman ME, Shuldiner AR. Differential expression of reg-I and reg-II genes during aging in the normal mouse. J Gerontol A Biol Sci Med Sci. 1996;51:B308-B315. [PubMed] |
| 15. | Asahara M, Mushiake S, Shimada S, Fukui H, Kinoshita Y, Kawanami C, Watanabe T, Tanaka S, Ichikawa A, Uchiyama Y. Reg gene expression is increased in rat gastric enterochromaffin-like cells following water immersion stress. Gastroenterology. 1996;111:45-55. [PubMed] [DOI] |
| 16. | Iovanna JL, Keim V, Michel R, Dagorn JC. Pancreatic gene expression is altered during acute experimental pancreatitis in the rat. Am J Physiol. 1991;261:G485-G489. [PubMed] |
| 17. | Dusetti NJ, Mallo GV, Ortiz EM, Keim V, Dagorn JC, Iovanna JL. Induction of lithostathine/reg mRNA expression by serum from rats with acute pancreatitis and cytokines in pancreatic acinar AR-42J cells. Arch Biochem Biophys. 1996;330:129-132. [PubMed] [DOI] |
| 18. | Kobayashi S, Akiyama T, Nata K, Abe M, Tajima M, Shervani NJ, Unno M, Matsuno S, Sasaki H, Takasawa S. Identification of a receptor for reg (regenerating gene) protein, a pancreatic beta-cell regeneration factor. J Biol Chem. 2000;275:10723-10726. [PubMed] [DOI] |