修回日期: 2008-05-20
接受日期: 2008-06-01
在线出版日期: 2008-06-28
目的: 评价经脾脏途径行骨髓间充质干细胞(hSMCs)移植对对乙酰氨基酚所致小鼠急性肝损伤的疗效.
方法: 建立对乙酰氨基酚导致的急性药物性肝损伤动物模型, 将SCID小鼠20只, 随机分成2组, 经脾脏注射组和对照组(n = 10), 经脾脏途径行hSMCs移植, 采用肝功能检查、免疫荧光、荧光显微镜、网状纤维染色等方法观察hMSC移植前后重症联合免疫缺陷病(severe combined immunodeficiency disease, SCID)小鼠肝腺泡结构的恢复与肝功能的改善情况.
结果: SCID小鼠肝功能在经脾脏移植组与对照组相比较呈现显著性改善(28 d时, ALT: 26.3 U/L vs 50.1 U/L, P<0.01; AST: 108.0 U/L vs 154.3 U/L, P<0.05; ALB: 40.0 g/L vs 31.9 g/L, P<0.05). 免疫荧光显示经脾脏移植的hMSCs在脾脏、肝脏均有较多量定植、分化与增殖. 免疫荧光观察到脾脏移植后肝腺泡结构有较明显改善.
结论: 经脾脏途径行hMSCs移植能改善小鼠急性肝损伤肝功能, hMSCs在小鼠肝内生长良好, 是hMSCs移植治疗的有效途径.
引文著录: 刘迎娣, 杨云生, 王韫芳, 南雪, 彭丽华, 孙刚, 李明阳, 裴雪涛. 经脾脏hMSCs移植对乙酰氨基酚所致小鼠急性肝损伤的治疗作用. 世界华人消化杂志 2008; 16(18): 1969-1973
Revised: May 20, 2008
Accepted: June 1, 2008
Published online: June 28, 2008
AIM: To assess efficacy of transsplenic human mesochymal stem cells (hMSCs) transplantation on acetaminophen-induced acute liver injury in mice.
METHODS: An animal model of acetaminophen-induced acute liver injury was established. Twenty severe combined immunodeficiency mice (SCID mice) were randomly divided into 2 groups: transsplenic hMSCs transplantation group (n = 10) and control group (n = 10). After transsplenic hMSCs transplantation, liver function test, immunofluorescence method, fluorescence microscopy and reticular fiber staining were performed to observe hepatic acinus and liver function of SCID rats.
RESULTS: Liver function of SCID mice after transsplenic hMSCs transplantation was improved significantly compared with controls (at d 28, ALT: 26.3 U/L vs 50.1 U/L, P < 0.01; AST: 108.0 U/L vs 154.3 U/L, P < 0.05; ALB: 40.0 g/L vs 31.9 g/L, P < 0.05). Fluorescence microscopy indicated hMSCs through transsplenic transplantation began to reside, differentiate and proliferate in spleen and liver in large number. Immunofluorescence method showed remarkable improvement of hepatic acinus following transsplenic hMSCs transplantation.
CONCLUSION: Transsplenic hMSCs transplantation improves acute liver injury induced by acetaminophen in SCID mice and human mesochymal stem cells are able to proliferate in liver. Transsplenic transplantation is effective for hMSCs transplantation.
- Citation: Liu YD, Yang YS, Wang YF, Nan X, Peng LH, Sun G, Li MY, Pei XT. Curative effect of transsplenic human mesochymal stem cells transplantation on acetaminophen-induced acute liver injury in mice. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1969-1973
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1969.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1969
自1999年发现骨髓干细胞可分化成肝细胞后[1], 干细胞移植治疗是继肝移植后又一治疗急性肝损伤的热点研究[2-7]. 以往文献曾报道经不同种途径干细胞移植治疗各种肝病的疗效[8-13]. 本实验通过经脾脏途径的人骨髓间充质干细胞(human mesochymal stem cells, hMSCs)的移植治疗对乙酰氨基酚所致的急性药物性肝损伤, 旨在探讨经此途径干细胞移植对急性肝损伤的治疗价值.
♂SCID小鼠, 6 wk龄, 由北京维通利华实验动物技术有限公司提供, SPF(specific pathogen free)条件下饲养. 对乙酰氨基酚为北京第二制药厂生产, PKH26染料为Sigma公司生产、FITC-Mouse anti Human CDlla为Serotec公司生产, FITC-Mouse IgG为Serotec公司产品、DAB染色剂为中杉公司产品, Olympus AU-600全自动生化分析仪, Olympus光学显微镜, Heraeus Labofuge 400R台式高速冷冻离心机, Olympus IX70型倒置荧光显微镜, LeicaRM2016切片机, CM3050S冷冻切片机, EG1150组织包埋机.
1.2.1 造模: 对乙酰氨基酚1000 mg与生理盐水10 mL混匀, 加5‰醋酸纤维素钠40 mL, 制成对乙酰氨基酚20 g/L混悬液. 超声震荡器混匀. SCID小鼠模型建立前禁食6 h, 经小鼠金属胃管胃内注射对乙酰氨基酚混悬液500 mg/kg. ig后恢复正常饮食.
1.2.2 hMSCs的分离、体外扩增与鉴定: 无菌条件下采集非血液系统疾病的胸外科手术患者的肋骨, 钳夹挤压将骨髓挤出, 加适量含100 mL/L FBS的α-MEM培养液稀释, 200目筛网过滤, 离心去脂肪层, 加入5 mL完全培养液, 混匀后轻轻叠加到密度为1.073 kg/L的percoll分离液上, 常规密度梯度离心加贴壁法分离获取HMSCs[14-15], 在HMSCs条件培养基中培养. 每2-3天换液1次. 细胞长到80%融合时用2.5 g/L胰酶消化, 按1:3传代继续扩增培养. 按照PKH26 Red Fluorescent Cell Linker Mini Kit说明书进行操作进行细胞标记.
1.2.3 分组与hMSCs移植: 已建模的SCID小鼠20只, 随机分成2组, 每组10只, 为经脾脏注射组和对照组. 分别于术后第3、5、7、9、12、14和28天等眼球取血行肝功能检查(ALT、AST及ALB检查), 脊髓脱位法处死小鼠, 并留取肝脏、脾脏组织分别行荧光显微镜、免疫荧光、免疫组化、HE染色及网状纤维染色等检查. 将小鼠给予3.5%水合氯醛(10 mL/kg)麻醉, 取仰卧位固定, 备腹部皮肤, 沿肋下缘斜行切口, 暴露脾脏, 从脾下极注射人胚胎hMSCs 0.3 mL, 对照组脾脏下极注射生理盐水0.3 mL, 按压止血后缝合切口, 分笼饲养, 给予软食3 d.
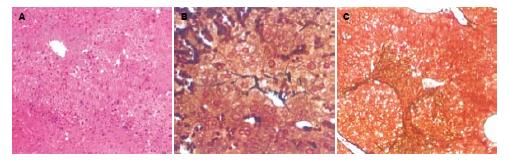
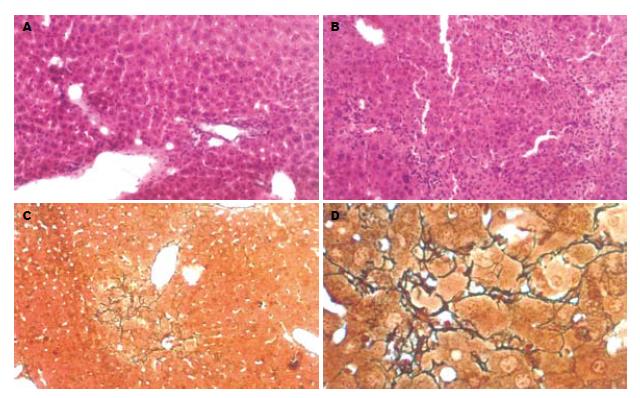
正常小鼠的显微结构中, 腺泡结构清楚, 汇管区清晰, 肝细胞板排列整齐. 网状纤维染色见少量网状纤维着色. 对乙酰氨基酚灌胃后呈现病理改变. 造模后第2天病理改变最严重, 细胞变性明显并见大量炎性细胞浸润, 病变坏死表现为桥接样或灶状坏死, 枯否氏细胞增生, 网状纤维染色着色稍增强(图1A-B). 病变严重部位可以明显观察到小叶中央静脉周围的细胞变性较汇管区周边为严重. 这与正常肝脏的腺泡样结构特点相吻合. 之后病变呈现平稳及好转表现. 肝细胞浊肿、淋巴细胞浸润仍较明显. 网状纤维染色逐渐加深, 呈条索样延伸, 最终与相邻汇管区相连, 成为肝纤维化, 出现假小叶雏形(图1C). 因而, 通过预实验结果, 选择小鼠肝脏病病理改变最为明显的术后48 h作为移植时间.
经脾hMSCs移植组与模型组比较, ALT、AST、ALB水平较明显好转, ALT两组间具有非常显著性差异(P<0.01), AST与ALB两组之间具有显著性差异(P<0.05, 表1).
| 时间(d) | ALT(U/L) | AST(U/L) | ALB(g/L) | |||
| S | M | S | M | S | M | |
| 3 | 50.0 | 76.0 | 284.2 | 403.5 | 23.2 | 16.1 |
| 5 | 54.8 | 66.3 | 293.7 | 392.6 | 25.4 | 21.5 |
| 7 | 50.3 | 67.4 | 267.3 | 358.1 | 29.8 | 25.7 |
| 9 | 39.2 | 72.8 | 174.2 | 301.4 | 36.5 | 23.6 |
| 12 | 39.6 | 69.2 | 154.6 | 262.3 | 38.5 | 27.8 |
| 14 | 32.7 | 61.4 | 159.9 | 242.0 | 39.9 | 30.2 |
| 28 | 26.3 | 50.1b | 108.0 | 154.3a | 40.0 | 31.9a |
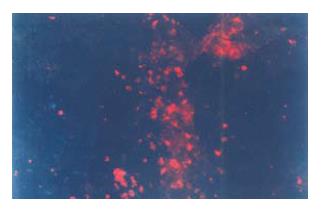
在经脾注射组移植组植术后可观察到的干细胞脾脏内大量存留, 并于移植后第3天可见hMSCs在肝脏及脾脏中的定植与分化(图2). hMSCs的定植首先出现的部位是汇管区, 细胞核形态呈现出双核、多核或不规则形结构. 移植后第4天, 在每10个高倍视野(HP)中, 平均可以见到5.6±3.2个/HP hMSCs的定植与分化. 脾注射后hMSCs的出现伴随着肝功能的恢复以及肝腺泡结构的重建与好转. 移植后的肝组织的结构的恢复在短期内并未见到明显的改善, 但在肝功能方面较早出现了好转. 至术后4 wk, 未见假小叶的形成(图3A-B)网状纤维染色与对照组相比较轻(图3C-D).
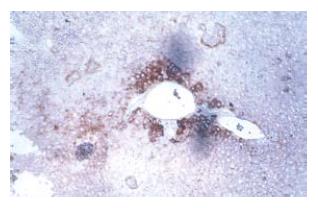
经脾脏移植后的肝脏组织内第3天即可见到抗人核蛋白抗体阳性细胞分布于汇管区, 第7天后可以观察到抗人白蛋白抗体的阳性表达, 并且随时间推移, 染色阳性细胞范围逐渐扩大(图4).
本研究结果表明, 经脾脏hMSCs移植后, 受体鼠的肝脏功能得到了的一定程度的恢复与好转. 移植组肝功能与对照组相比具有显著性差异(P<0.05或P<0.01). hMSCs移植后肝脏功能恢复的可能机制有: 多种细胞因子刺激了hMSCs的生长、分化及转化, 在肝内高浓度细胞因子的作用下, 通过信号转导机制, 使细胞转录因子按不同比例发生新的组合, 启动新基因的转录, 最终使hMSCs的表型和功能发生变化, 从而进一步分化为肝细胞和胆管细胞, 本研究中免疫荧光检查可见hMSCs分化为分泌白蛋白的肝前体细胞, 也证实了hMSCs移植后分化为具有部分肝功能的肝前体细胞或肝细胞. hMSCs的移植, 使得细胞因子的变化更加复杂化, 从肝功能得到改善的结果看, 细胞因子的变化结果, 有利于hMSCs的生长; 药物损伤后, 肝卵圆细胞开始活化、增殖和分化成肝细胞, 这部分细胞在肝功能改善方面所起作用的大小还需今后进一步的研究. 经脾脏移植的干细胞虽然能在短期内达到改善肝功能的目的, 但由于其不能在脾脏内形成有效的肝腺泡等排泌结构, 其依赖于脾脏内干细胞的分化, 长期效果仍然需要来源于由脾脏回流到肝脏的干细胞的分化增殖.
对乙酰氨基酚给药后第2天肝脏损伤最为严重. 由于对乙酰氨基酚的严重损伤导致肝脏的结构不能完全恢复, 部分坏死的肝腺泡结构被纤维组织所替代, 肝功能的基本平稳大约发生于损伤后2 wk左右, 本研究将肝脏损伤的观察时间设定为28 d, 目的是更好的与肝脏的自身修复作对比.
经脾脏途径移植的hMSCs肝脏荧光显微镜检查, 发现除脾脏内可见干细胞定植外, 还发现有少量肝脏内的定植. 肝脏结构的变化与未移植组比较, 在胆小管再生方面稍有变化, 但程度不大, 但对于肝腺泡的炎症程度, 肝板破坏的修复未见明确效果. 一方面是因为: 经脾脏hMSCs移植后, hMSCs部分被脾髓破坏或阻拦, 少部分较小的hMSCs通过门静脉循环进至肝脏, 因而其数量有限. 另一方面脾脏内无法形成有效的肝腺泡等排泌结构, 其依赖于脾脏内干细胞的分化, 长期效果仍然需要来源于由脾脏回流到肝脏的干细胞的分化增殖. hMSCs移植后在靶器官的定植与增殖与所移植hMSCs的数量密切相关. 本实验采取的是每只小鼠hMSCs移植1×106个细胞, 经脾脏的拦截后, 进入肝脏的hMSCs数量可能直接影响肝脏结构的改变. 移植后第3天, 免疫荧光和光镜下在每10个高倍视野(400×10)中, 可观察到5.6±3.2个/HP hMSCs的早期定植, 此时hMSCs仅仅是通过血管内皮到达肝窦内, 并在此分化与增生. 有hMSCs定植的肝腺泡结构与早期未见hMSCs定植的肝腺泡结构恢复情况存在者一定差异. 前者表现在肝腺泡细胞条索排列相对整齐, hMSCs外形相对正常, 细胞变性不明显, 少量淋巴细胞浸润, 网状纤维染色较少. 而后者表现为肝细胞条索排列不整齐或呈无序状排列, 细胞多呈浊肿, 淋巴细胞浸润较明显. 网状纤维形成较多, 但较少有假小叶的形成.
本实验的研究结果表明, 经脾脏途径的hMSCs移植是hMSCs移植治疗急性药物性肝损伤的可选择途径之一. 临床上以经皮途径的给药也简便易行, 随自体hMSCs的分离、培养的方法的日趋完善, 经脾脏途径的hMSCs移植治疗在临床应用具有一定的应用价值.
自1999年发现骨髓干细胞可分化成肝细胞后, 干细胞移植治疗是继肝移植后又一治疗急性肝损伤的热点研究. 本实验通过经脾脏途径的人骨髓间充质干细胞(hMSCs)的移植治疗对乙酰氨基酚所致的急性药物性肝损伤, 旨在探讨经此途径干细胞移植对急性肝损伤的治疗价值.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科; 陈光, 教授, 吉林大学第一医院消化器官外科.
干细胞移植治疗肝损伤的研究历史较短, 临床还处在试验阶段.
经脾脏途径行hMSCs移植能改善小鼠急性肝损伤肝功能, hMSCs在小鼠肝内生长良好, 是hMSCs移植治疗的有效途径.
本研究设计合理, 技术先进, 结论客观可靠, 具有一定的应用价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] [DOI] |
| 2. | Miyazaki M, Akiyama I, Sakaguchi M, Nakashima E, Okada M, Kataoka K, Huh NH. Improved conditions to induce hepatocytes from rat bone marrow cells in culture. Biochem Biophys Res Commun. 2002;298:24-30. [PubMed] [DOI] |
| 3. | Wollert KC, Meyer GP, Lotz J, Ringes-Lichtenberg S, Lippolt P, Breidenbach C, Fichtner S, Korte T, Hornig B, Messinger D. Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial. Lancet. 2004;364:141-148. [PubMed] [DOI] |
| 4. | Sáez-Lara MJ, Frecha C, Martín F, Abadía F, Toscano M, Gil A, Fontana L. Transplantation of human CD34+ stem cells from umbilical cord blood to rats with thioacetamide-induced liver cirrhosis. Xenotransplantation. 2006;13:529-535. [PubMed] [DOI] |
| 5. | Nagata H, Ito M, Cai J, Edge AS, Platt JL, Fox IJ. Treatment of cirrhosis and liver failure in rats by hepatocyte xenotransplantation. Gastroenterology. 2003;124:422-431. [PubMed] [DOI] |
| 6. | Kobayashi N, Ito M, Nakamura J, Cai J, Hammel JM, Fox IJ. Hepatocyte transplantation improves liver function and prolongs survival in rats with decompensated liver cirrhosis. Transplant Proc. 1999;31:428-429. [PubMed] [DOI] |
| 7. | Blakolmer K, Jaskiewicz K, Dunsford HA, Robson SC. Hematopoietic stem cell markers are expressed by ductal plate and bile duct cells in developing human liver. Hepatology. 1995;21:1510-1516. [PubMed] |
| 8. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 10. | Gao J, Dennis JE, Muzic RF, Lundberg M, Caplan AI. The dynamic in vivo distribution of bone marrow-derived mesenchymal stem cells after infusion. Cells Tissues Organs. 2001;169:12-20. [PubMed] [DOI] |
| 11. | 王 韫芳, 南 雪, 尉 承泽, 李 艳华, 张 锐, 管 立东, 岳 文, 裴 雪涛. 丙稀醇致肝损伤微环境定向诱导骨髓干细胞向肝细胞 分化. 中华肝脏病杂志. 2005;13:274-277. |
| 12. | Olynyk JK, Yeoh GC, Ramm GA, Clarke SL, Hall PM, Britton RS, Bacon BR, Tracy TF. Gadolinium chloride suppresses hepatic oval cell proliferation in rats with biliary obstruction. Am J Pathol. 1998;152:347-352. [PubMed] |
| 15. | Avital I, Inderbitzin D, Aoki T, Tyan DB, Cohen AH, Ferraresso C, Rozga J, Arnaout WS, Demetriou AA. Isolation, characterization, and transplantation of bone marrow-derived hepatocyte stem cells. Biochem Biophys Res Commun. 2001;288:156-164. [PubMed] [DOI] |