修回日期: 2008-03-17
接受日期: 2008-04-20
在线出版日期: 2008-06-28
目的: 探讨T辅助细胞亚群Th1/Th2和Treg在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病机制中的意义.
方法: SD大鼠正常喂养1 wk后, 随机分为正常组(n = 20)和高脂饮食组(n = 20). 正常组大鼠以普通饲料喂养, 高脂饮食组以高脂饲料喂养. 实验第8、16周分批处死大鼠. 观察肝组织的病理改变, 荧光定量PCR方法检测肝脏TNF-a、IFN-γ、IL-4和Foxp3的基因表达.
结果: 高脂饮食8 wk大鼠肝细胞脂肪变明显, 无明显炎症改变, IFN-γ、IL-4在肝脏的基因表达与正常组比较无明显变化, TNF-α稍升高, 但无统计学意义, Foxp3 mRNA的表达比正常组明显降低(ct值: 26.12±0.69 vs 24.22±0.62, P<0.05). 高脂饮食16 wk大鼠脂肪肝明显, 炎症明显, IFN-γ和TNF-α基因表达均显著升高(ct值: 24.52±0.87 vs 29.94±1.44, 24.31±1.13 vs 28.88±1.95, 均P<0.05), IL-4与正常组相比较无明显变化, Foxp3基因表达较正常组和高脂饮食8 wk时均显著降低(ct值: 32.57±1.54 vs 24.29±1.08, 26.12±0.69, P<0.05).
结论: 高脂饮食大鼠肝脏Foxp3和Treg表达减少可能是高脂饮食NAFLD发生发展的重要因素. IFN-γ和TNF-α的联合作用加重了肝脏的炎症损伤.
引文著录: 陆金来, 陈金联, 陈明祥, 洪静, 陈维雄, 朱金水, 陈尼维. T辅助细胞亚群在大鼠非酒精性脂肪性肝病模型中的变化. 世界华人消化杂志 2008; 16(18): 1962-1968
Revised: March 17, 2008
Accepted: April 20, 2008
Published online: June 28, 2008
AIM: To detect tumor necrosis factor-alpha (TNF-α), interferon-gamma (IFN-γ), interleukin-4 (IL-4) and forkhead/winged helix transcription factor p3 (Foxp3) gene expression of fatty liver rats under high fat diet and to explore the role of Th1/Th2 balance and Treg in non-alcoholic fatty liver disease (NAFLD).
METHODS: Sprague-Dawley rats, after one-week normal diet, were randomly divided into two groups: the normal group (treated with normal diet, n = 20) and the high fat diet group (treated with high fat diet, n = 20). The rats were all killed at the eighth and sixteenth week, respectively. TNF-a, IFN-γ, IL-4 and Foxp3 gene expression were detected using real time PCR and pathological changes in liver tissues were recorded.
RESULTS: After high fat diet for 8 weeks, liver became remarkably steatotic, but without significant inflammatory changes. IFN-γ mRNA and IL-4 mRNA had no significant change compared with the normal group, and TNF-α mRNA increased slightly but without statistical significance. The ct value of Foxp3 mRNA was significantly higher than normal (26.12 ± 0.69 vs 24.22 ± 0.62, P < 0.05). After high fat diet for 16 weeks, severe fatty liver, inflammatory cell infiltration and hepatocyte necrosis were observed in high fat diet rats. Both of IFN-γ mRNA and TNF-α mRNA were increased significantly (ct value: 24.52 ± 0.87 vs 29.94 ± 1.44, 24.31 ± 1.13 vs 28.88 ± 1.95, both P < 0.05). IL-4 mRNA was not significantly different from the normal group. Foxp3 mRNA was decreased significantly compared with both normal group and high fat diet group at wk 8 (ct value: 32.57 ± 1.54 vs 24.29 ± 1.08, 26.12 ± 0.69, both P < 0.05).
CONCLUSION: Decreased expression of Foxp3 mRNA and Treg in rat livers may play a key role in development of NAFLD. The combined effect of IFN-γ and TNF-α aggravates liver inflammatory injury.
- Citation: Lu JL, Chen JL, Chen MX, Hong J, Chen WX, Zhu JS, Chen NW. Alteration of T helper cells in rats with non-alcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1962-1968
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1962.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1962
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是慢性肝病的常见原因, 近年来发病率日益增高. 以往的研究认为, 单纯性脂肪肝是一种良性疾病, 但部分非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)仍可进展为肝纤维化、肝硬化等终末期肝病[1-3]. 不久前, Wong et al[4]对国内80位NAFLD患者活组织检查发现, 其中28位患者是单纯性脂肪肝, 52位患者为脂肪性肝炎. 这说明单纯性脂肪肝易于进展为脂肪性肝炎, 但目前对于NASH发展的根本机制仍未完全弄清[5]. CD4+ T辅助细胞(Th)是重要的免疫调节细胞, 根据其分泌的细胞因子不同, 分为Th1、Th2细胞亚型, Th1细胞主要分泌IL-2、IFN-γ、TNF-α等细胞因子, 具有促炎症反应作用; Th2细胞主要分泌IL-4、IL-6、IL-10等细胞因子, 具有抗炎作用[6]. 在已有的研究中发现, Th1/Th2的失衡在炎症反应中发挥了重要的作用, 但目前在NASH中的报道甚少. 调节性T细胞(CD4+, CD25+ regulatory T cell, Treg), 约占外周CD4+ T细胞的5%-l0%, 具有很强的免疫抑制能力[7], 在NAFLD中的研究尚未见报道. 叉头蛋白3(forkhead/winged helix transcription factor p3, Foxp3)是FOX蛋白家族成员之一, 主要表达于CD4+CD25+调节性T细胞, 是Treg的特异性标志, 调节Treg发育和发挥功能的重要开关[8]. 本研究通过荧光定量PCR技术检测Th1/Th2细胞因子IFN-γ、TNF-α、IL-4以及Foxp3在脂肪肝肝组织的基因表达, 旨在探讨NAFLD时肝脏的免疫环境变化, 研究T辅助细胞亚群Th1/Th2和Treg在NAFLD发病机制中的意义.
健康♂SD大鼠由中科院上海实验动物中心提供, 体质量220±30 g, 逆转录酶、Taq DNA聚合酶、引物和荧光标记探针由中山大学达安基因股份有限公司(广州)提供. 胆固醇由上海盛季科技发展有限公司提供. ABI-7300 Real-time检测仪为美国ABI公司产品, 低温冷冻离心机和生物安全柜为美国Sigma公司产品, XW-80A旋涡振荡器(Vortex)由上海青浦泸西仪器厂生产.
实验大鼠正常喂养1 wk后, 随机分为正常组(n = 20)和高脂饮食组(n = 20). 正常组大鼠以普通饲料喂养, 高脂饮食组以高脂饲料(88%标准饲料+10%猪油+2%胆固醇)喂养, 实验大鼠饲养于本院动物房, 动物房通风条件良好, 装有空调, 明暗各12 h, 自由进食和饮水, 3-4只/笼.
1.2.1 标本收集和病理学检查: 实验第8、16周分批处死正常组和高脂饮食组大鼠. 在肝固定部位取2块肝组织, 1块以中性甲醛固定后制作石蜡切片, HE染色, 光镜下观察肝病理变化, 检测脂肪肝程度, 根据肝小叶内含脂滴细胞数占总细胞的比值为0、<1/3、1/3-2/3、>2/3将肝脏脂肪变分为(-)、(+)、(++)、(+++), 达到(++)或以上者, 诊断为脂肪肝; 另一块置液氮冷冻保存.
1.2.2 PCR试验: (1)PCR试验所需试剂盒由5×逆转录Buffer, 5×定量PCR Buffer, Taq酶, dNTPs, MMLV, DEPC处理水, ddH2O, 上游引物F, 下游引物R, TaqMan探针组成. 各细胞因子的引物序列见表1, 5'端FAM修饰, 3'端TAMRA修饰.
| Cytokine细胞因子 | Forward(5'-3')5'正向引物 | Reverse(5'-3')3'反向引物 | Prob(5'-3')荧光探针序列 |
| IFN-γ | GCGTCCCAAGAAGCAGAATGA | TCCGTGTGGACGAATCATCA | CACCACAATCCGCAACTGATTCTC |
| TNF-α | GCCTGCTGACCCCACTGAT | TCCGGACAACTCCCAGTGA | CGCTGAGTGGCTGTCGTTTG |
| IL-4 | ACTCCATGCACCGAGATGTTT | CTGGAAGCCCTGCAGATGAG | TACCAGACGTCCTTACGGCAACAAG |
| Foxp3 | TCATCACCGAACGCTTTGC | GGGCACCTTGACGAAGCA | CCCGCGCAAGTGGCAGAACA |
(2)PCR试验前的准备: 试验耗材预先用0.1% DEPC水浸泡过夜, 然后用灭菌水淋洗, 并于100℃烤干; 玻璃器具蒸馏水淋洗数次, 150℃烘烤, 4 h以上; 专用一次性96孔联体PCR反应板及配套的透明黏模; TRIzol、氯仿、异丙醇、750 mL/L乙醇(1倍的DEPC处理水加3倍的无水乙醇)预冷; 试验前将生物安全柜UV及标本处理间UV打开照射30 min. (3)采用TRIzol法抽提正常组织和高脂饮食大鼠肝组织的总RNA, 烘干后加入20 μL DEPC处理水, 溶解RNA, -80℃冰箱, 保存待用. 将经过稀释后的RNA样本进行逆转录, 反应体系如下: 5×逆转录Buffer上游引物F 0.4 μL, 下游引物R 0.4 μL, dNTPs 0.2 μL, 逆转录酶MMLV 1 μL, DEPC处理水10 μL, RNA模板4 μL, 总体积20 μL. 反应条件: 37℃ 1 h、95℃ 5 min.
1.2.3 FQ-PCR反应: 将制备好的cDNA进行PCR扩增, 扩增体系如下: 5×PCR Buffer 10 μL, 外上游引物F 0.5 μL, 外下游引物R 0.5 μL, dNTPs 0.5 μL, 荧光探针0.5 μL, Taq酶1 μL, ddH2O水32 μL, cDNA模板5 μL, 总体积50 μL. 扩增条件: 50℃ 2 min, 93℃ 15 min, 做40个循环. 数据采用仪器自带软件(ABI Prism 7300 SDS Software)分析. 每个模板的阈值循环圈数(ct值)与该模板起始拷贝数的对数存在线性关系, ct值越小, 起始拷贝数越多.
统计学处理 采用SPSS11.0软件包统计. 计量资料用mean±SD, 采用t检验和方差分析, P<0.05有显著性差异.
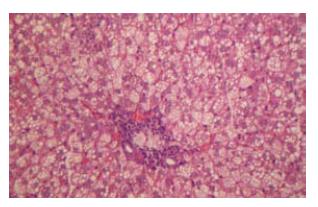
光镜下, 正常大鼠肝组织均无脂肪肝等病理改变, 肝小叶结构清晰完整, 门管区无扩大, 肝界板完整, 肝细胞无变性和坏死, 无明显炎症细胞浸润. 高脂饮食8 wk大鼠肝细胞脂肪变明显, 分别有2只、5只、3只大鼠脂肪肝程度为(+)、(++)、(+++), 80%大鼠达到脂肪肝诊断标准, 肝小叶结构完整, 门管区无明显扩大. 肝细胞内可见大囊泡型和小囊泡型脂肪滴贮积, 为大泡性和小泡性混合性肝细胞脂肪变性, 肝界板完整, 肝细胞无坏死, 无明显炎症改变, 肝间质无纤维化. 高脂饮食16 wk大鼠脂肪肝明显, 大鼠脂肪肝程度均为(+++), 100%大鼠达到脂肪肝诊断标准, 门管区见少量慢性炎细胞浸润, 肝小叶内肝细胞内可见大囊泡和小囊泡型脂肪滴贮积, 为大泡性和小泡性混合性肝细胞脂肪变性, 可见肝细胞坏死, 炎症细胞浸润明显, 主要以单个核细胞浸润为主, 肝间质无纤维化(图1).
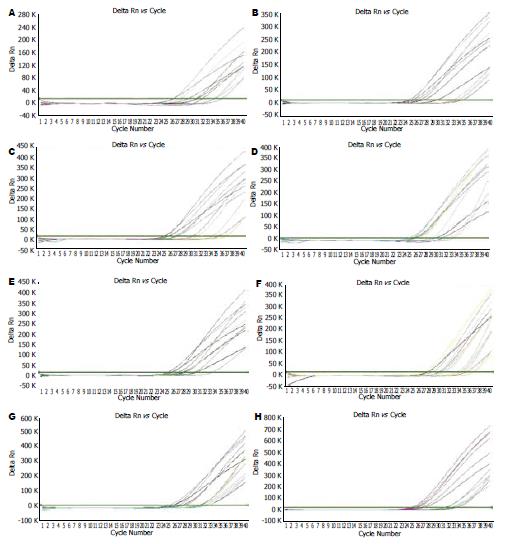
应用荧光定量PCR技术检测大鼠肝组织IFN-γ、IL-4和TNF-α基因表达, 每个模板的ct值与该模板的起始拷贝数的对数存在线性关系, 起始拷贝数越多, ct值越小. 结果发现, 高脂饮食8 wk肝组织IFN-γ mRNA、IL-4 mRNA的ct值与正常组无显著差异(P>0.05), TNF-α mRNA的ct值较正常组低, 但无统计学意义(P>0.05), 表明高脂饮食8 wk时肝组织IFN-γ mRNA、IL-4 mRNA的表达与正常组比较无明显变化, TNF-α mRNA表达略升高. 高脂饮食16 wk时大鼠肝组织IFN-γ mRNA、TNF-α mRNA的ct值比正常组显著降低(P<0.05), IL-4 mRNA与正常组相比较无明显变化(P>0.05), 表明高脂饮食16 wk时肝脏IFN-γ mRNA与TNF-α mRNA表达显著升高. 这说明在单纯性脂肪肝期, 肝组织并无促炎细胞因子IFN-γ mRNA、TNF-α mRNA明显表达, 而在脂肪性肝炎期IFN-γ mRNA、TNF-α mRNA显著表达, 从而说明二者与NASH的发生发展有着显著的联系(表2, 图2A-F).
| 第8周 | 第16周 | ||||
| 正常组 | 高脂饮食组 | 正常组 | 高脂饮食组 | ||
| IFN-γ | 29.81±2.53 | 28.08±3.74 | 29.94±1.44 | 24.52±0.87 | |
| TNF-α | 28.36±3.43 | 26.91±2.85 | 28.88±1.95 | 24.31±1.13 | |
| IL-4 | 29.89±3.49 | 29.58±3.26 | 31.36±1.96 | 30.99±3.74 | |
| Foxp3 | 24.22±0.62 | 26.12±0.69 | 24.29±1.08 | 32.57±1.54 | |
实验结果显示, 高脂饮食8 wk IFN-γ/IL-4的ct比值为0.95±0.11, 正常组为1.01±0.17, 两组之间差异无统计学意义(P>0.05); 高脂饮食16 wk IFN-γ/IL-4的ct比值为0.80±0.05, 正常组为0.96±0.08, 经统计学处理, 两组之间差异有统计学意义(P<0.05), 提示高脂饮食16 wk IFN-γ/IL-4的ct比值与正常组比较明显下降. 表明NASH时IFN-γ的基因表达明显高于IL-4, 这说明CD4+ T细胞优先向Th1亚群分化, TH1亚群优势表达与NASH的发展密切相关.
1986年Mosmann et al提出Th细胞的分类以来, Th1/Th2失衡在自身免疫性疾病、肿瘤和炎症等疾病的研究受到重视. Matsuda et al[9]对结肠术后并发感染患者研究发现与没有术后感染的患者相比, Th1/Th2比值明显降低, 说明Th2优势与术后的感染发展有关. 而Falasca et al[10]研究发现, 患有慢性乙型或丙型肝炎的患者血中也以Th1类细胞因子占优势, 促进肝脏炎症和肝细胞损伤, 提示Th1/Th2失衡与慢性肝病有关. 但目前Th1/Th2在NASH的报道甚少. 前不久, Pacifico et al[11]研究发现患有NASH的肥胖儿童血中IFN-γ、TNF-α显著升高, 且与HOMA-IR、胰岛素抵抗成正相关, 推测Th1优势是肥胖引起炎症的重要机制. 但在高脂饮食所致NASH发病中肝脏Th细胞分化趋势的研究未见报道, 因为NASH是隐源性终末期肝病的主要原因, 所以研究该疾病发生发展的基本机制具有重要意义.
本研究通过荧光定量PCR技术检测高脂饮食大鼠肝脏IFN-γ、TNF-α和IL-4的基因表达, 结果显示大鼠高脂饮食8 wk后出现脂肪肝, 肝脏TNF-α基因表达比正常组稍有升高, 但是没有统计学意义, IFN-γ、IL-4没有明显变化, 不存在Th1/Th2失衡, 说明Th细胞不是诱导脂肪肝初期发病的因素, 而是脂肪肝发病后的继发反应. 肝脏是一个重要的免疫器官, Li et al[12]认为高脂饮食使肝脏内在的免疫系统异常, 包括NKT细胞凋亡增加, NKT细胞减少. NKT细胞是内在免疫系统的组成成分, NKT细胞减少可刺激Th细胞向Th1亚群分化, 分泌促炎细胞因子IFN-γ、TNF-α等, 使脂肪肝进展[13-14]. Pacifico et al[11]也认为有肝损伤的肥胖儿童的细胞内的IFN-γ产物增加是激发的. 这些实验结果均支持上述理论.
细胞因子是肝脏第二次打击的重要因素[15-16]. 高脂饮食16 wk后, 我们的实验结果显示大鼠肝脏即发生明显的脂肪性肝炎病变, 肝脏的细胞因子IFN-γ、TNF-α基因表达显著高于正常组, 提示NASH的发病与大量的促炎介质IFN-γ、TNF-α分泌有关系. IFN-γ是一个重要的免疫激活的细胞因子, 可以激活巨噬细胞, 产生细胞因子和氧自由基, 刺激内皮细胞表达黏附分子, 并诱导内皮细胞和平滑肌细胞上MHCⅡ类分子表达, 具有促炎和致动脉粥样硬化形成的作用[17-18]. 多项研究表明, TNF-α是NASH发病的关键因素, 在Yang et al[19]和Guebre-Xabier et al[20]实验中发现受LPS刺激后肝脏TNF-α大量表达, 但是面对相同水平的TNF-α, 肥胖大鼠与正常大鼠的肝损伤程度不同, 说明肥胖可能通过增加肝脏对TNF-α毒性的敏感性而促进肝损伤, 实验中进一步研究发现, 予内毒素刺激后, IFN-γ过度表达, 而Smith et al[21]研究发现IFN-γ易使肝脏对TNF毒性的敏感性增加. 所以也许是IFN-γ和TNF-α的联合作用加重了肝损伤. 研究结果表明, 细胞因子IFN-γ、TNF-α在NASH发病中起主要作用.
我们的研究结果显示, 高脂饮食16 wk, 主要由Th2细胞分泌的IL-4基因表达没有明显变化, IFN-γ/IL-4数量的比值明显升高, 提示肝脏CD4+ T辅助细胞优先向Th1亚群分化, Th1/Th2比例失衡, 呈现TH1优势应答. 这与文献报道一致. Pacifico et al[11]检测肥胖儿童和正常儿童血中IL-4表达同样没有明显差异, 肥胖儿童血中的IFN-γ显著升高. Kremer et al[22]发现小鼠脂肪肝模型予conA刺激后肝脏Th1调节器(T-bet)显著上调, 而Th2调节器GATA-3受到抑制, T-bet是IFN-γ基因的转录激活剂, 同时抑制IL-4、IL-5等Th2型细胞因子的产生, 且能将分化中的效应性Th2和已完全分化的Th2逆转为Th1, 使Th1类细胞因子优势应答. 另外, Sierra et al[23]发现(n-3)、(n-6)不饱和脂肪酸可以直接抑制Th1细胞分化, 使免疫调节因子IL-10分泌增加, 从而发挥抗炎作用. Viardot et al[24]研究证实外源性胰岛素可诱导T细胞优先向Th2亚群分化, 降低Th1/Th2比值发挥抗炎作用. 这些研究结果说明Th1/Th2失衡, Th1优势应答是NASH发病的重要机制, 如果能逆转该应答, 抑制促炎细胞因子分泌, 可能具有防治该病的效果.
目前, 有关Treg在NAFLD发病机制中的研究少见报道. 我们的实验结果显示高脂饮食8 wk、16 wk大鼠肝脏的Foxp3 mRNA表达均明显降低, 且16 wk时与第8周相比较, Foxp3 mRNA表达显著降低, 这说明在NAFLD疾病进程中, Foxp3 mRNA表达明显降低且呈现阶段性抑制增强. 研究证明Foxp3 mRNA与Treg的表达频率一致[7,25], 即提示Treg在NAFLD疾病的进程中发育和功能显著受抑制, 尤其在NASH变时明显被抑制. 这一抑制过程的具体机制目前尚不清楚. Hong et al[26]发现细胞因子COP-1(4种氨基酸谷氨酸, 赖氨酸, 丙氨酸, 酪氨酸的无规共聚物)可诱导Foxp3表达, 使外周CD4+CD25- T转化为CD4+CD25+ T细胞, 产生免疫调节作用, 且该过程依赖IFN-γ的大量表达. 我们最近对NASH大鼠肝代谢组学的研究表明, NASH大鼠肝谷氨酸, 丙氨酸, 酪氨酸等氨基酸含量比正常大鼠肝明显降低(未发表), 分别降低了0.68、0.37、0.05倍. 故Foxp3和Treg抑制原因考虑可能与肝氨基酸含量降低有关. 实验研究发现Foxp3缺乏或将Treg去除后引发了多种自身免疫性疾病和炎症反应, 如自身免疫性肝炎、自身免疫性糖尿病等, 而回输CD4+CD25+ T细胞则可抑制上述疾病的发生[7,27-29]. Xu et al[30]发现体内外Treg均能够抑制Th1和Th2的分化和增殖, 且对后者的作用较强, 提示Treg可通过影响Th细胞的功能调节机体免疫应答. 且这种抑制性不具有MHC限制性, 可通过细胞直接接触抑制或分泌抑制性细胞因子实现[31]. 实验结果表明在NAFLD发病过程中, 可能由于Foxp3和Treg表达减少, 失去正常的抑制功能, 从而使Th1、Th2细胞的分化和增殖异常, 表现为Th细胞优先向Th1亚群分化, 又或可能由于上文中提到的其他原因, Th2细胞的表达未发生明显的变化. 实验发现在脂肪肝期, Treg就已明显受抑制, 早于Th细胞分化出现异常, 因此, 通过各种措施改善Foxp3或Treg表达, 从而调节Th细胞向亚群的分化, 或许能够阻止NAFLD病情恶化.
总之, Foxp3和Treg表达减少, 其抑制功能下降, 使Th1、Th2细胞的分化和增殖异常, 表现为肝脏Th细胞优先向Th1亚群分化, 分泌大量的IFN-γ、TNF-α等促炎细胞因子, 而具有抗炎作用的Th2类细胞因子IL-4的基因表达量在高脂饮食组没有明显变化, 致使促炎和抗炎力量失衡, 这是NASH发生发展的重要因素. IFN-γ和TNF-α的联合作用加重了肝脏的炎症损伤. 检测IFN-γ、TNF-α和或Foxp3基因表达将可能作为NASH的临床诊断手段, 而应用药物或其他手段调节Th1/Th2亚群保持平衡, 抑制促炎细胞因子分泌, 将对NASH的临床防治具有重要作用.
NAFLD系以弥漫性肝细胞大泡性脂肪变为病理特征的临床综合征, 包括单纯性脂肪肝、脂肪性肝炎和脂肪性肝硬化. 近年来, 随着人民生活水平的提高和饮食结构的变化, NAFLD发病率日渐升高. 目前, NAFLD发生发展的机制至今尚未阐明, 临床上亦缺乏防治该病的有效措施, 因此积极研究该病发生发展的机制具有重要意义.
王新月, 教授, 北京中医药大学东直门医院消化科; 秦成勇, 教授, 山东省立医院消化内科.
由于NASH是单纯性脂肪肝发生进展性肝纤维化和肝硬化的中间阶段, 是导致NAFLD进展的限速步骤, 因此NASH肝脏炎症发生机制以及如何防治成为当前研究的热点. Th1/Th2和其相关细胞因子网络失衡及Treg在慢性肝病中的作用亦已受到人们的重视.
Pacifico et al发现NASH的肥胖儿童血中以Th1类细胞因子IFN-γ、TNF-α表达升高, IL-4与正常儿童比较没有明显变化. 肝脏是一个重要的免疫器官, Li et al发现高脂饮食可使肝脏内在的免疫系统发生异常, NKT细胞减少. 但目前尚未见有关NAFLD肝组织Th细胞和Treg表达情况的报道.
本文通过FQ-PCR定量检测NAFLD肝组织TNF-α、IFN-γ、IL-4、Foxp3的基因表达, 首次探讨了Th1/Th2及其细胞因子网络失衡、Treg在NAFLD疾病发生发展中的作用.
本研究结果表明在NAFLD疾病的发展进程中, Treg表达呈进行性抑制. NASH时Th细胞优先向Th1亚群分化增值, Th1/Th2失衡, Th1类促炎细胞因子大量表达. 所以通过应用药物或其他手段改善Treg表达, 调节Th1/Th2亚群保持平衡, 抑制促炎细胞因子分泌, 可能有阻断NAFLD进程的作用.
调节性T细胞: 是近年来发现的具有免疫抑制作用的一类T细胞亚群, 根据来源的不同可将其分为天然型和诱生型. 天然型是由胸腺细胞自然分化发育而来的一个主要Treg亚群; 诱生型(Th3或Tr1细胞)是外周成熟CD4+CD25- T细胞在受到特异性抗原刺激并在细胞因子的诱导下转化为具有Treg功能特征的细胞亚群. 转录因子Foxp3是Treg的特异性标志, 在调控其发育和功能上起很重要的作用.
本研究设计严谨, 方法得当, 结果可信, 结论有参考意义, 具有一定的临床价值.
编辑: 李军亮 电编:郭海丽
| 1. | Harrison SA, Kadakia S, Lang KA, Schenker S. Nonalcoholic steatohepatitis: what we know in the new millennium. Am J Gastroenterol. 2002;97:2714-2724. [PubMed] |
| 2. | Roberts EA. Non-alcoholic steatohepatitis in children. Clin Liver Dis. 2007;11:155-172. [PubMed] [DOI] |
| 3. | Maier KP. Non-alcoholic steatohepatitis--a new epidemic. Schweiz Rundsch Med Prax. 2007;96:1857-1860. [PubMed] |
| 4. | Wong VW, Hui AY, Tsang SW, Chan JL, Tse AM, Chan KF, So WY, Cheng AY, Ng WF, Wong GL. Metabolic and adipokine profile of Chinese patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2006;4:1154-1161. [PubMed] [DOI] |
| 5. | Yu J, Ip E, Dela Pena A, Hou JY, Sesha J, Pera N, Hall P, Kirsch R, Leclercq I, Farrell GC. COX-2 induction in mice with experimental nutritional steatohepatitis: Role as pro-inflammatory mediator. Hepatology. 2006;43:826-836. [PubMed] [DOI] |
| 6. | Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol. 1986;136:2348-2357. [PubMed] |
| 7. | Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995;155:1151-1164. [PubMed] |
| 8. | Karim M, Kingsley CI, Bushell AR, Sawitzki BS, Wood KJ. Alloantigen-induced CD25+CD4+ regulatory T cells can develop in vivo from CD25-CD4+ precursors in a thymus-independent process. J Immunol. 2004;172:923-928. [PubMed] |
| 9. | Matsuda A, Furukawa K, Suzuki H, Kan H, Tsuruta H, Matsumoto S, Shinji S, Tajiri T. Does impaired TH1/TH2 balance cause postoperative infectious complications in colorectal cancer surgery? J Surg Res. 2007;139:15-21. [PubMed] [DOI] |
| 10. | Falasca K, Ucciferri C, Dalessandro M, Zingariello P, Mancino P, Petrarca C, Pizzigallo E, Conti P, Vecchiet J. Cytokine patterns correlate with liver damage in patients with chronic hepatitis B and C. Ann Clin Lab Sci. 2006;36:144-150. [PubMed] |
| 11. | Pacifico L, Di Renzo L, Anania C, Osborn JF, Ippoliti F, Schiavo E, Chiesa C. Increased T-helper interferon-gamma- secreting cells in obese children. Eur J Endocrinol. 2006;154:691-697. [PubMed] [DOI] |
| 12. | Li Z, Soloski MJ, Diehl AM. Dietary factors alter hepatic innate immune system in mice with nonalcoholic fatty liver disease. Hepatology. 2005;42:880-885. [PubMed] [DOI] |
| 13. | Li Z, Oben JA, Yang S, Lin H, Stafford EA, Soloski MJ, Thomas SA, Diehl AM. Norepinephrine regulates hepatic innate immune system in leptin-deficient mice with nonalcoholic steatohepatitis. Hepatology. 2004;40:434-441. [PubMed] [DOI] |
| 14. | Matsui K, Yoshimoto T, Tsutsui H, Hyodo Y, Hayashi N, Hiroishi K, Kawada N, Okamura H, Nakanishi K, Higashino K. Propionibacterium acnes treatment diminishes CD4+ NK1.1+ T cells but induces type I T cells in the liver by induction of IL-12 and IL-18 production from Kupffer cells. J Immunol. 1997;159:97-106. [PubMed] |
| 15. | Lalor PF, Faint J, Aarbodem Y, Hubscher SG, Adams DH. The role of cytokines and chemokines in the development of steatohepatitis. Semin Liver Dis. 2007;27:173-193. [PubMed] [DOI] |
| 16. | Copaci I, Micu L, Voiculescu M. The role of cytokines in non-alcoholic steatohepatitis. A review. J Gastrointestin Liver Dis. 2006;15:363-373. [PubMed] |
| 17. | Hansson GK. Immune mechanisms in atherosclerosis. Arterioscler Thromb Vasc Biol. 2001;21:1876-1890. [PubMed] [DOI] |
| 18. | Frostegard J, Ulfgren AK, Nyberg P, Hedin U, Swedenborg J, Andersson U, Hansson GK. Cytokine expression in advanced human atherosclerotic plaques: dominance of pro-inflammatory (Th1) and macrophage-stimulating cytokines. Atherosclerosis. 1999;145:33-43. [PubMed] [DOI] |
| 19. | Yang SQ, Lin HZ, Lane MD, Clemens M, Diehl AM. Obesity increases sensitivity to endotoxin liver injury: implications for the pathogenesis of steatohepatitis. Proc Natl Acad Sci U S A. 1997;94:2557-2562. [PubMed] [DOI] |
| 20. | Guebre-Xabier M, Yang S, Lin HZ, Schwenk R, Krzych U, Diehl AM. Altered hepatic lymphocyte subpopulations in obesity- related murine fatty livers: potential mechanism for sensitization to liver damage. Hepatology. 2000;31:633-640. [PubMed] [DOI] |
| 21. | Smith SR, Calzetta A, Bankowski J, Kenworthy-Bott L, Terminelli C. Lipopolysaccharide-induced cytokine production and mortality in mice treated with Corynebacterium parvum. J Leukoc Biol. 1993;54:23-29. [PubMed] |
| 22. | Kremer M, Hines IN, Milton RJ, Wheeler MD. Favored T helper 1 response in a mouse model of hepatosteatosis is associated with enhanced T cell-mediated hepatitis. Hepatology. 2006;44:216-227. [PubMed] [DOI] |
| 23. | Sierra S, Lara-Villoslada F, Comalada M, Olivares M, Xaus J. Dietary fish oil n-3 fatty acids increase regulatory cytokine production and exert anti-inflammatory effects in two murine models of inflammation. Lipids. 2006;41:1115-1125. [PubMed] [DOI] |
| 24. | Viardot A, Grey ST, Mackay F, Chisholm D. Potential antiinflammatory role of insulin via the preferential polarization of effector T cells toward a T helper 2 phenotype. Endocrinology. 2007;148:346-353. [PubMed] [DOI] |
| 25. | Janson PC, Winerdal ME, Marits P, Thorn M, Ohlsson R, Winqvist O. FOXP3 promoter demethylation reveals the committed Treg population in humans. PLoS ONE. 2008;3:e1612. [PubMed] [DOI] |
| 26. | Hong J, Li N, Zhang X, Zheng B, Zhang JZ. Induction of CD4+CD25+ regulatory T cells by copolymer-I through activation of transcription factor Foxp3. Proc Natl Acad Sci U S A. 2005;102:6449-6454. [PubMed] [DOI] |
| 27. | Sakaguchi S, Wing K, Miyara M. Regulatory T cells - a brief history and perspective. Eur J Immunol. 2007;37 Suppl 1:S116-S123. [PubMed] [DOI] |
| 28. | Longhi MS, Ma Y, Mitry RR, Bogdanos DP, Heneghan M, Cheeseman P, Mieli-Vergani G, Vergani D. Effect of CD4+ CD25+ regulatory T-cells on CD8 T-cell function in patients with autoimmune hepatitis. J Autoimmun. 2005;25:63-71. [PubMed] [DOI] |
| 29. | Chen Z, Benoist C, Mathis D. How defects in central tolerance impinge on a deficiency in regulatory T cells. Proc Natl Acad Sci U S A. 2005;102:14735-14740. [PubMed] [DOI] |
| 30. | Xu D, Liu H, Komai-Koma M, Campbell C, McSharry C, Alexander J, Liew FY. CD4+CD25+ regulatory T cells suppress differentiation and functions of Th1 and Th2 cells, Leishmania major infection, and colitis in mice. J Immunol. 2003;170:394-399. [PubMed] |
| 31. | Ramsdell F, Ziegler SF. Transcription factors in autoimmunity. Curr Opin Immunol. 2003;15:718-724. [PubMed] [DOI] |