修回日期: 2008-04-30
接受日期: 2008-05-23
在线出版日期: 2008-06-18
目的: 观察卵清蛋白肠道致敏BALB/c小鼠时肠道屏障功能变化, 研究有无细菌易位现象发生; 观察其脾细胞中CD4+CD25+调节性T细胞数量的变化以期进一步探讨食物过敏机制.
方法: 无受试蛋白喂养的BALB/c小鼠20只, 随机分为实验组和对照组. 实验组给予以卵清蛋白(OVA), 对照组给予等量生理盐水. 培养法分析粪便菌群、ELISA法测定肠黏液分泌型免疫球蛋白A(sIgA)含量及血清二胺氧化酶(DAO)含量. 对肠系膜淋巴结(MLN)、腹腔灌洗液及肝、肾、肺组织进行培养以探讨有无细菌易位的发生. 同时, 采用流式细胞术分析其脾细胞悬液中CD4+CD25+调节性T细胞的数量变化
结果: 与对照组相比, 实验组小鼠肠道固有菌群中益生菌乳酸杆菌、双歧杆菌的含量显著降低(P = 0.006, P = 0.016), 条件致病菌大肠杆菌、类杆菌的含量显著升高(P = 0.001, P = 0.001); 肠道黏液中sIgA的含量(A值)显著升高(0.107±0.012 vs 0.086±0.008, P = 0.001); 血清DAO含量(A值)显著升高(0.357±0.025 vs 0.179±0.035, P = 0.001); MLN及外周器官细菌易位率显著升高(47.8% vs 15.6%, P = 0.001); 脾细胞悬液中CD4+CD25+ T细胞数量显著降低(4.350%±0.618% vs 6.488%±2.313%, P = 0.001).
结论: OVA肠道致敏小鼠肠道菌群失调, 肠通透性增高反映肠屏障功能受损, OVA肠道致敏小鼠存在肠道细菌易位现象. CD4+CD25+调节性T细胞细胞的下调可能在食物过敏的发生中起重要作用.
引文著录: 黄煌, 郑鹏远, 罗予, 张利利. 食物过敏对小鼠肠道屏障功能及CD4+CD25+调节性T细胞的影响. 世界华人消化杂志 2008; 16(17): 1932-1937
Revised: April 30, 2008
Accepted: May 23, 2008
Published online: June 18, 2008
AIM: To investigate the gut barrier functional changes of ovalbumin-induced allergic mice and to determine whether there is bacteria translocation; and to observe changes of CD4+CD25+ regulatory T cells in FA mice spleen in order to shed light on relationship between CD4+CD25+ regulatory T cells and food allergy.
METHODS: Twenty BALB/c mice on ovalbulmin (OVA)-free diet were randomly divided into experimental group and control group. The mice in experimental group were sensitized with OVA while mice in control group were given normal saline (NS). The intestinal microbial flora was detected by culturing the feces. The secretory immunoglobulin A (sIgA) in intestinal mucus and the diamine oxidase (DAO) in blood serum were analyzed using ELISA. The mesenteric lymph nodes (MLN), homogenated tissues of livers, lungs, kidneys, and NS used for peritoneal lavage were cultured to determine bacterial translocation. The number of CD4+CD25+ regulatory T cells (CD4+CD25+ Treg cells) in spleens was estimated using flow cytometry.
RESULTS: The number of probiotics in experimental group was significantly lower than that of the control group (Lactobacillus: P = 0.006; Bifidobacterium: P = 0.016). In contrast, the number of conditional pathogenic bacteria was significantly higher than that of control group (Escherichia coli: P = 0.001; Bacteroides: P = 0.001). Compared with the control group, sIgA (0.107 ± 0.012 vs 0.086 ± 0.008, P = 0.001) in intestinal mucus, DAO (0.357 ± 0.025 vs 0.179 ± 0.035, P = 0.001) in blood serum and frequency of bacteria translocation (47.8% vs 15.6%, P = 0.001) were significantly higher in experimental group. The number of CD4+CD25+ Treg cells was significantly lower in experimental group (4.350% ± 0.619% vs 6.488% ± 2.313%, P = 0.001).
CONCLUSION: Intestinal flora imbalance and high intestinal permeability in ovalbumin-induced allergic mice suggest gut barrier dysfunction. The phenomenon of bacteria translocation is verified in FA mice. Down-regulation of CD4+CD25+ Treg cells may play an important role in food allergy.
- Citation: Huang H, Zheng PY, Luo Y, Zhang LL. Influence of food allergy on gut barrier function and CD4+CD25+ regulatory T cells in food allergic mice. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1932-1937
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1932.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1932
近年来过敏性疾病的发病率在全球范围内大大提高, 15%-20%的人曾发生IgE介导的对外来抗原的高反应性, 约4%-8%的儿童和1%-2%的成年人发生过食物过敏(food allergy, FA)[1]. FA的发生机制尚不清楚, 目前的病因研究多集中在Th1/Th2细胞失衡与卫生假说、细菌毒素及食物蛋白的共同作用、口服耐受受损等方面[2-4]. 其中, CD4+CD25+调节性T细胞(CD4+CD25+ regulatory T cells, CD4+CD25+ Treg)作为贯穿各个假说的线索倍受研究者的关注. CD4+CD25+ Treg细胞是新近被认识的一类免疫调节细胞, 主要发挥抑制性免疫调节功能, 其功能紊乱或数目下降是导致自身免疫性及过敏性疾病的重要原因之一[5]. 在FA中, 肠道是一个主要的受累脏器, 所以对肠道屏障功能的研究可能对FA的病因研究及治疗有一定价值. 肠道屏障包括肠道正常菌群、黏液层、肠上皮细胞层和肠道免疫系统等, 其主要功能在于防止肠道内细菌及毒素的易位(bacterial translocation, BT). 目前, 尚未见针对肠道屏障的各个组成来全面评价FA的肠道屏障功能以及在FA中是否存在细菌易位现象的报道. 本文选用常见的食物过敏原卵清蛋白(ovalbumin, OVA)对Balb/c小鼠进行肠道致敏, 对其肠道屏障功能做出全面的评价, 并探讨在FA的发生发展中是否存在BT现象.
卵清蛋白(OVA, Sigma公司), 小鼠sIgA、IgE ELISA定量试剂盒(美国RB公司)、邻连茴香胺(O-dianisidine, Sigma公司), 辣根过氧化物酶(peroxidase-horseradish, Sigma公司), 盐酸戊二胺(cadaverine dihydrochloride, Sigma公司), 二胺氧化酶标准品(diamine oxidase, Sigma公司), FITC-抗鼠CD4、PE-抗鼠CD25(美国eBioscience公司), Balb/c小鼠购于河南省实验动物中心.
1.2.1 分组及造模: 无受试蛋白喂养Balb/c小鼠20只, 体质量18-22 g, 雌雄各半, 随机分为实验组和对照组. 按照文献[6]方法进行致敏, 实验组动物第1天以含OVA 10 μg和Al(OH)3 1 mg的无菌生理盐水0.5 mL溶液腹腔注射进行基础致敏; 第15天以含OVA 10 μg的无菌生理盐水0.5 mL ip进行强化致敏; 第20、24、28天以含OVA 0.5 mg的无菌生理盐水0.5 mL进行灌胃激发; 对照组分别以等量生理盐水进行ip及ig. 以腹泻为造模成功标志, 如果被致敏小鼠未出现明显腹泻, 可观察处死后小鼠的肠道内容物, 相对于正常鼠结肠中的球样大便, 水样粪便亦可被视为腹泻[7].
1.2.2 大便菌群分析: 造模第30天, 取小鼠新鲜粪便, 制成101-106稀释倍数的混悬液. 分别接种于相应的培养基上培养大肠杆菌(伊红美兰培养基)、类杆菌(Bds培养基)、乳酸杆菌(Lbs培养基)、双歧杆菌(Blb培养基). 大肠杆菌需氧培养24 h, 其余三菌置于厌氧罐中厌氧培养48 h. 根据菌落形态、涂片分析及耐氧试验结果计算各个菌种每克粪便中菌落形成单位(CFU/g).
1.2.3 血清总IgE和DAO测定: 造模第31天, 摘眼球取血并处死小鼠. 全血37℃静止1 h后, 4℃低温离心取血清. 按试剂盒说明进行血清总IgE测定, 于酶标仪492 nm处读出A值. 取血清按照黎君有[8]方法使用分光光度计进行血清DAO测定, 436 nm处读出吸光度A值.
1.2.4 细菌易位研究: 小鼠处死后以750 mL/L乙醇浸泡15 min, 于超净工作台内无菌取肠系膜淋巴结(mesenteric lymph node, MLN)、腹腔灌洗液1 mL、肝脏、肾脏、肺脏置于增菌液中分别进行培养. 需氧24 h后或厌氧35℃增菌48 h后观察是否有细菌生长, 增菌阳性标本进行涂片观察并分别接种于伊红美兰平板及基础厌氧平板上培养, 24 h或48 h后观察并涂片鉴定. 有大肠杆菌(G-兼性厌氧菌)及类杆菌(G-专性厌氧菌)生长者记为阳性. 易位率 = 阳性器官个数/(小鼠个数×5).
1.2.5 小肠黏液sIgA测定: 取紧靠回盲部小肠肠段4 cm, 平铺于滤纸上纵向剖开, 刮取肠道内容物及黏液入EP管, 加入1 mL PBS充分匀浆, 10 000 g离心15 min, 取上清, 按ELISA试剂盒说明进行黏液sIgA测定, 在酶标仪492 nm处读出相应A值.
1.2.6 流式细胞仪测定脾脏单个核细胞悬液CD4+CD25+ Treg细胞: 无菌取脾, 置于缚有200目筛网的平皿上细细剪碎, 以预冷的Hank's液收集细胞, 1500 r/min 10 min离心, 弃上清. 取Tris-NH4Cl溶液5 mL吹匀细胞, 静置5 min裂解红细胞, 1500 r/min 10 min, 弃上清. PBS液洗涤3次, 使用含100 mL/L胎牛血清的RPMI 1640培养液重悬细胞. 调整细胞浓度至(1-2)×106/L. 将FITC-抗鼠CD4 0.2 μL、PE-抗鼠CD25 0.25 μL加入流式样管底部, 加入500 μL(细胞总数为5×105-1×106)细胞悬液混匀, 避光静置30 min后1 mL PBS洗涤2次, 500 μL PBS重悬细胞上机检测.
统计学处理 实验结果采用SPSS13.0统计软件包分析. 组间均数比较选用独立样本t检验, 易位率的比较采用四格表卡方检验. 采用α = 0.05为假设检验标准.
FA小鼠的粪便菌群中, 条件致病菌大肠杆菌(P = 0.001)及类杆菌(P = 0.001)的Log10 CFU/g值明显高于对照组, 肠道益生菌双歧杆菌(P = 0.016)及乳酸杆菌(P = 0.006)的Log10 CFU/g值则低于对照组(表1).
FA小鼠血清总IgE含量(A值)明显高于对照组(P = 0.001), 本研究所造FA动物模型呈高IgE性反应, 所采用的OVA肠道致敏方法是有效的(表2). 血清DAO含量(A值)明显高于对照组(P = 0.005). DAO是一种具有高度活性的细胞内酶, 存在于哺乳类动物的黏膜或绒毛上层, 当小肠黏膜机械屏障受损导致通透性增高时, DAO将释放入血导致外周血中DAO含量升高. 该结果提示FA小鼠小肠通透性增高(表2).
小肠黏液sIgA含量(A值)明显高于对照组(P = 0.002). 作为肠道屏障的重要组成部分, sIgA与食物抗原结合可加强集合淋巴小结对抗原的捕获, 强化肠道的免疫屏障功能. 此结果提示, 在FA中, 小鼠的sIgA反应体系呈亢进状态(表2).
MLN及肝、肺、肾、腹腔灌洗液培养显示实验组与对照组小鼠均有BT现象发生, 但实验组细菌易位率显著高于对照组(P = 0.001, 表2).
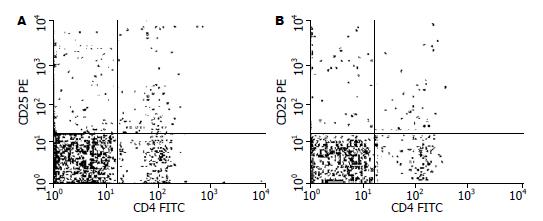
流式细胞仪分析FA及照组小鼠脾脏单个核细胞悬液CD4+CD25+ Treg细胞, 结果表明FA小鼠脾脏中CD4+CD25+ Treg细胞的数量显著低于对照组(4.3500%±0.6182% vs 6.4875%±2.3129%, P = 0.011, 图1).
FA是一种多因素、多系统参与的, 由遗传背景和环境因素共同作用发生的复杂疾病. FA的症状轻则表现为呕吐、腹泻、呼吸困难、皮疹等不适, 重则发生威胁生命的过敏性休克[9]. 最近的流行病学调查显示食物过敏在发达国家的发生率大大高于发展中国家. 卫生假说提出过敏反应与细菌、病毒、原生动物感染密切相关, 幼年时过少暴露于上述病原体会导致对Th1细胞克隆的不充分刺激, 从而不能与Th2细胞克隆扩增相平衡, 导致一种过敏易患体制[2]. 我们的研究也表明某些微生物产物, 如葡萄球菌肠毒素(staphylococcal enterotoxin B, SEB)可能作为佐剂参与诱导过敏反应[3]. 然而, 肠道过敏的病原学和发病机制都不甚清楚. 一般认为, 正常情况下肠道免疫系统不会对食物抗原和肠道固有细菌发生免疫反应, 称为口服耐受(oral tolerance)状态[4]. 这种耐受状态与肠上皮细胞的各组成部分的完整性、树突状细胞(dendritic cell, DC)的提呈作用、CD4+CD25+ Treg细胞的作用等因素密切相关[10]. 所以, 任何对于肠道抗原与肠道免疫系统之间共生状态的干扰作用都会导致食物过敏.
本研究表明FA小鼠肠道内正常菌群已发生明显改变, 条件致病菌数量显著高于对照组小鼠, 益生菌则低于对照组, 导致肠道屏障的第一道防线被削弱. 血清DAO的增高表明小肠上皮通透性的增高, 这也进一步提示肠道屏障遭到破坏. 研究发现, 当肠黏膜屏障被破坏, 上皮通透性增高时, 食物抗原的经上皮转运会明显加强, 也就是说肠道免疫系统对微生物产物和食物大分子抗原摄取增多, 这样会加剧机体对食物抗原的Th2极化, 发生食物过敏[11]. 同样, 虽然与其他部位DC相比, 肠道黏膜的DC在一般情况下低表达B7等启动T细胞必要的共刺激分子, 但是当肠通透性增高, DC过多暴露于内毒素等细菌产物时会被启动, 从而启动位于MLN的抗原特异性T细胞, 诱发食物过敏[12]. 然而本研究也显示, 在上述指标提示肠道屏障功能被削弱的同时, 作为肠道屏障保护性因素的sIgA水平却是增高的. 这就提出了一个问题: sIgA水平的增高能不能有效的提高肠道屏障功能, 抵消菌群失调和上皮通透性增高带来的消极作用, 从而预防BT的发生. 通过对FA小鼠MLN和肝、肺、肾、腹腔灌洗液的培养, 本研究证实了BT的存在. BT是指肠道内可存活的和不能存活的微生物及其产物(包括内毒素等)穿过完整的肠壁到达外周血及器官的过程[13]. 在急性坏死性胰腺炎、肝硬化、肠梗阻、烧伤、肠外营养以及多器官功能衰竭综合征(multiple organ dysfunction syndrome, MODS)或者炎症反应综合征(systemic inflammatory response syndrome, SIRS)引起肠道屏障功能受损、肠通透性增高时, 可观察到BT现象[14-16]. 本实验同时表明, 在对照组小鼠中同样有BT现象的存在, 但易位率显著低于实验组小鼠. Karlsson et al[17]的研究表明正常人或某些疾病状态下, BT是一个普遍现象, 由于正常免疫系统的保护作用, 可以有效清除血液及淋巴液中的细菌及毒素, 所以并不会出现诸如自发性腹膜炎、败血症等明显的临床症状. 那么在FA发生发展的过程中, BT是加剧疾病进程导致疾病恶化还是仅仅作为一种客观现象存在, 还有待于进一步的证实和研究.
CD4+CD25+ Treg细胞是具有免疫抑制功能的T细胞亚群, 其细胞表面表达IL-2受体α链(CD25). 在维持机体内环境的稳定、抗感染免疫、诱导移植耐受及自身免疫性疾病等方面发挥重要作用[18]. 此群细胞可通过细胞表面CTLA-4和膜TGF-β作用抑制靶细胞表面IL-2α链表达从而抑制细胞增殖, 或分泌IL-10和TGF-β来发挥抑制作用, 还可通过抑制DC对T细胞的抗原提呈作用抑制T细胞的增殖反应[19]. CD4+CD25+ Treg细胞对于维持口服耐受有重要的作用. 口服耐受被打破或诱导口服耐受失败可能导致对食物抗原的高反应性[20]. 已有研究者证实在哮喘等过敏性疾病的动物模型中, CD4+CD25+ Treg细胞的数量下降[21]. 诱导口服耐受失败的牛奶过敏儿童的外周血单个核细胞中CD4+CD25+ Treg细胞的数量显著降低[22]. 本研究发现在OVA致敏的小鼠中CD4+CD25+ Treg细胞数量显著低于对照组, 也证实了CD4+CD25+ Treg细胞的下降有可能打破口服耐受, 诱发食物过敏.
本研究证实FA动物模型中肠道菌群紊乱及肠通透性增高现象的存在, 这为我们治疗食物过敏提供了一定的线索. 益生菌的重要功能之一就在于维持宿主肠道免疫系统平衡. 他们能刺激Treg细胞产生TGF-β和IL-10, 促进口服耐受的形成, 并且能够在FA中改善增高的肠道通透性, 增强sIgA的分泌, 从而有效的提高肠道屏障功能[23]. 临床研究也证实, 在炎症性肠病、腹泻、酒精性肝硬化以及一些儿童的过敏性疾病[24-28](FA、过敏性皮炎等)中应用益生菌是有效的. 给予高危新生儿口服鼠李糖乳杆菌能有效的预防抗原特异性湿疹的发生[29]. 益生菌制剂还可以防止心理应激大鼠的肠道细菌易位[30]. 这为我们临床治疗FA提供了依据. 针对菌群失调与肠通透性增高并存的现象, 我们可以考虑尝试将益生菌及肠道黏膜保护剂联合使用, 以期加强肠道屏障的保护作用, 减少肠道免疫系统对大分子食物抗原的摄取、防止细菌易位, 以预防食物过敏的发生、加剧并减轻食物过敏引起的腹泻等肠道症状.
近年来食物过敏的发病率在全球范围内大大提高, 尤以西方国家为明显. 肠道是食物过敏中重要的受累脏器, 对于过敏个体肠道屏障功能的研究对预防及治疗食物过敏有重要的参考意义. CD4+CD25+调节性T细胞是发挥抑制性免疫调节功能的T细胞亚群, 其功能紊乱或数目下降是导致自身免疫性及过敏性疾病的重要原因之一.
宣世英, 教授, 山东省青岛市市立医院肝病内科; 李瑜元, 教授, 广州市第一人民医院内科
FA的发生机制尚不清楚, 目前的病因研究多集中在Th1/Th2细胞失衡与卫生假说、细菌毒素及食物蛋白的共同作用、口服耐受受损等方面. 其中, CD4+CD25+调节性T细胞作为贯穿各个假说的线索倍受研究者的关注.
Bjorksten et al的研究表明牛奶过敏儿童较健康儿童肠道内乳酸杆菌比例低,而需氧菌尤其是肠杆菌、链球菌比例高. 有研究者证实在哮喘等过敏性疾病的动物模型中, CD4+CD25+ Treg细胞的数量显著下降. 诱导口服耐受失败的牛奶过敏儿童的外周血单个核细胞中CD4+CD25+ Treg细胞的数量显著降低.
肠道是接受细菌和食物抗原攻击的门户, 同时肠道也是人体最大的免疫器官. 本文选取肠道屏障的组成部分为指标逐一进行分析, 以期对食物过敏小鼠肠道屏障功能作出全面的评价, 并探讨在食物过敏小鼠中是否存在细菌易位现象.
本研究结果显示在食物过敏小鼠中存在肠道菌群失调、肠道上皮屏障受损现象, 导致肠道屏障功能削弱, 发生了肠道细菌易位. 这提示我们可以将益生菌与肠道黏膜保护剂联合使用以加强过敏个体的肠道屏障功能, 减轻肠道损伤.
本研究内容新颖, 设计合理, 方法先进, 数据可靠, 对预防食物过敏的发生、加剧并减轻食物过敏引起的腹泻具有重要意义.
编辑: 李军亮 电编:何基才
| 1. | Sicherer SH, Leung DY. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2007. J Allergy Clin Immunol. 2008;. [PubMed] |
| 2. | Yazdanbakhsh M, Kremsner PG, van Ree R. Allergy, parasites, and the hygiene hypothesis. Science. 2002;296:490-494. [PubMed] [DOI] |
| 3. | Liu T, Wang BQ, Zheng PY, He SH, Yang PC. Rhinosinusitis derived Staphylococcal enterotoxin B plays a possible role in pathogenesis of food allergy. BMC Gastroenterol. 2006;6:24. [PubMed] [DOI] |
| 4. | Faria AM, Weiner HL. Oral tolerance. Immunol Rev. 2005;206:232-259. [PubMed] [DOI] |
| 5. | 张 恒辉, 郭 芳, 费 然, 马 慧, 王 雪艳, 丛 旭, 魏 来, 陈 红松. CD4+CD25+调节性T细胞在慢性乙型肝炎患者免疫发病机制中作用. 世界华人消化杂志. 2007;15:2225-2230. [DOI] |
| 6. | Knippels LM, Penninks AH, Spanhaak S, Houben GF. Oral sensitization to food proteins: a Brown Norway rat model. Clin Exp Allergy. 1998;28:368-375. [PubMed] [DOI] |
| 7. | Yang PC, Jury J, Söderholm JD, Sherman PM, McKay DM, Perdue MH. Chronic psychological stress in rats induces intestinal sensitization to luminal antigens. Am J Pathol. 2006;168:104-114; quiz 363. [PubMed] |
| 9. | Bischoff SC. Food allergies. Curr Treat Options Gastroenterol. 2007;10:34-43. [PubMed] [DOI] |
| 10. | Sampson HA. Food allergy--accurately identifying clinical reactivity. Allergy. 2005;60 Suppl 79:19-24. [PubMed] [DOI] |
| 11. | McHugh RS, Shevach EM. The role of suppressor T cells in regulation of immune responses. J Allergy Clin Immunol. 2002;110:693-702. [PubMed] [DOI] |
| 12. | Yang PC, Xing Z, Berin CM, Soderholm JD, Feng BS, Wu L, Yeh C. TIM-4 expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy. Gastroenterology. 2007;133:1522-1533. [PubMed] [DOI] |
| 13. | Yu LC, Yang PC, Berin MC, Di Leo V, Conrad DH, McKay DM, Satoskar AR, Perdue MH. Enhanced transepithelial antigen transport in intestine of allergic mice is mediated by IgE/CD23 and regulated by interleukin-4. Gastroenterology. 2001;121:370-381. [PubMed] [DOI] |
| 14. | 龚 非力. 医学免疫学. 第2版. 北京: 科学出版社 2004; 152-153. |
| 15. | Chehade M, Mayer L. Oral tolerance and its relation to food hypersensitivities. J Allergy Clin Immunol. 2005;115:3-12; quiz 13. [PubMed] |
| 16. | 吴 奎, 孙 鲲, 毕 玉田, 夏 俊波, 王 长征. 哮喘小鼠CD4+ CD25+调节性T细胞数量及功能的改变. 中国呼吸与危重监护杂志. 2005;4:455-458. |
| 17. | Karlsson MR, Rugtveit J, Brandtzaeg P. Allergen-responsive CD4+CD25+ regulatory T cells in children who have outgrown cow's milk allergy. J Exp Med. 2004;199:1679-1688. [PubMed] [DOI] |
| 18. | Wiest R, Rath HC. Gastrointestinal disorders of the critically ill. Bacterial translocation in the gut. Best Pract Res Clin Gastroenterol. 2003;17:397-425. [PubMed] [DOI] |
| 19. | Almeida J, Galhenage S, Yu J, Kurtovic J, Riordan SM. Gut flora and bacterial translocation in chronic liver disease. World J Gastroenterol. 2006;12:1493-1502. [PubMed] |
| 20. | Balzan S, de Almeida Quadros C, de Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-471. [PubMed] [DOI] |
| 21. | Nadler EP, Ford HR. Regulation of bacterial translocation by nitric oxide. Pediatr Surg Int. 2000;16:165-168. [PubMed] [DOI] |
| 22. | O'Boyle CJ, MacFie J, Mitchell CJ, Johnstone D, Sagar PM, Sedman PC. Microbiology of bacterial translocation in humans. Gut. 1998;42:29-35. [PubMed] |
| 23. | Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E. Probiotics in primary prevention of atopic disease: a randomised placebo-controlled trial. Lancet. 2001;357:1076-1079. [PubMed] [DOI] |
| 25. | Stadlbauer V, Mookerjee RP, Hodges S, Wright GA, Davies NA, Jalan R. Effect of probiotic treatment on deranged neutrophil function and cytokine responses in patients with compensated alcoholic cirrhosis. J Hepatol. 2008;48:945-951. [PubMed] [DOI] |
| 26. | Htwe K, Yee KS, Tin M, Vandenplas Y. Effect of Saccharomyces boulardii in the treatment of acute watery diarrhea in Myanmar children: a randomized controlled study. Am J Trop Med Hyg. 2008;78:214-216. [PubMed] |
| 27. | Matricardi PM. Probiotics against allergy: data, doubts, and perspectives. Allergy. 2002;57:185-187. [PubMed] [DOI] |
| 29. | Rautava S, Kalliomäki M, Isolauri E. Probiotics during pregnancy and breast-feeding might confer immunomodulatory protection against atopic disease in the infant. J Allergy Clin Immunol. 2002;109:119-121. [PubMed] [DOI] |