修回日期: 2008-04-15
接受日期: 2008-04-30
在线出版日期: 2008-06-18
目的: 探讨大肠癌组织中DPC4和TGF-β1的表达及其与大肠癌肿瘤大小、淋巴结转移、临床分期及细胞分化程度等的关系.
方法: 2005-1/2005-12大肠癌手术切除标本48例, 原位杂交和免疫组织化学方法分别检测DPC4和TGF-β1 mRNA及蛋白表达.
结果: DPC4 mRNA在大肠癌组织中的表达相对正常组织较低(52.1% vs 72.9%, P<0.01), 其表达程度与肿瘤大小、细胞分化程度、临床分期、淋巴结转移有关. TGF-β1 mRNA在大肠癌中呈高表达(68.8% vs 41.7%, P<0.01), 与细胞分化程度、临床分期、淋巴结转移有关. DPC4蛋白在大肠癌组织表达程度显著低于正常组织(P<0.01), 其表达程度与肿瘤大小、细胞分化程度、临床分期、淋巴结转移有关. TGF-β1蛋白在大肠癌组织中呈高表达, 与临床分期、淋巴结转移有关. TGF-β1和DPC4的表达有相关性(χ2 = 3.95, P<0.05).
结论: TGF-β1和DPC4是TGF-β转导通路中起瓶颈作用的关键因子, TGF-β1高表达和DPC4 低表达可作为大肠癌预后不良的指标.
引文著录: 张东伟, 杨维良, 姚强. 大肠癌组织抑癌基因DPC4和TGF-β1的表达意义. 世界华人消化杂志 2008; 16(17): 1885-1889
Revised: April 15, 2008
Accepted: April 30, 2008
Published online: June 18, 2008
AIM: To investigate the expression of deleted in pancreatic carcinoma locus 4 (DPC4) and transforming growth factor-β1 (TGF-β1) in human colorectal cancer tissues and their clinical significances.
METHODS: Forty-eight samples of human colorectal carcinoma were collected from patients from January 2005 to December 2005. In situ hybridization and immunohistochemistry were used to detect DPC4/TGF-β1 mRNA and protein expression respectively.
RESULTS: The expression of DPC4 mRNA was lower in colorectal carcinoma specimens as compared with that in normal colorectal specimens (52.1% vs 72.9%, P < 0.01), while TGF-β1 mRNA expression was higher in carcinoma specimens (68.8% vs 41.7%, P < 0.01). The level of DPC4 protein expression in the cancer specimens was significantly lower than that in the normal specimens, while TGF-β1 protein level were higher in the carcinoma specimens. DPC4 expression was related with the tumor size, clinical stages, differentiation degree and lymph node metastasis, while TGF-β1 expression was related with the clinic stage, differentiation degree and lymph node metastasis. There existed a close correlation between DPC4 and TGF-β1 expression (χ2 = 3.95, P < 0.05).
CONCLUSION: DPC4 and TGF-β1 are the capital factors in TGF-β transduction pathway. Low-expression of DPC4 and over-expression of TGF-β1 may serve as an index for unfavorable prognosis of colorectal carcinoma.
- Citation: Zhang DW, Yang WL, Yao Q. Expression of deleted in pancreatic carcinoma locus 4 and transforming growth factor-β1 in human colorectal carcinoma and their clinical significance. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1885-1889
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1885.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1885
近年来, 随着人民生活水平的日益提高, 我国大肠癌的发患者数呈逐年增高的趋势. 转化生长因子β(TGF-β)是一簇属结构相关的异二聚体多肽, 他能够调节细胞增殖、分化、形态形成、凋亡等病理过程及刺激细胞外基质分泌, 抑制免疫反应等[1-5], TGF-β信号转导通路的异常与肿瘤关系密切. 该通路的异常常见于一些来源于上皮细胞肿瘤发展的晚期, 并且常与肿瘤的侵袭及转移有关. 其中TGF-β1是这一家族的主要成员. TGF-β信号可抑制B细胞Ig的合成, TGF-β1在肿瘤细胞中过表达能够破坏宿主T细胞介导的细胞毒性作用, 并引起CTL(cytolyic T cell)反应, 纵容了肿瘤的进一步发展[6-7]. 位于染色体18q21.1的抑癌基因DPC4(deleted in pancreatic carcinoma locus4, DPC4)/SMAD4是1996年由美国约翰·霍普金斯大学研究所Hahn et al发现的一种新基因. 不少学者认为他是一种肿瘤抑制基因[8-9]. 其所编码的Smad4蛋白是转导TGF-β1信号的重要胞质内信号级联分子, 调节TGF-β1应答基因的转录. Smad4功能失活或表达低下影响TGF-β1的信号转导并参与肿瘤的形成[10]. 我们采用原位杂交及免疫组化的方法, 对大肠癌组织中TGF-β1和DPC4在mRNA及蛋白水平的表达进行检测, 旨在探讨他们与大肠癌发生发展的关系.
2005-01/2005-12手术切除大肠癌标本48例, 结肠癌26例, 直肠癌22例; 年龄23-80(平均52.6)岁; 男27例, 女21例; 术前皆未接受放、化疗. 鼠抗人DPC4单克隆抗体[(B-8):sc-7966]购自Santa Cruz公司. 兔抗人TGF-β1抗体购自武汉博士德公司. S-P试剂盒购自福州MAXIM公司. DPC4原位杂交检测试剂盒和TGF-β1原位杂交检测试剂盒均为武汉博士德生物工程有限公司产品.
免疫组织化学染色(S-P法)阴性对照以PBS缓冲液代替一抗. 病理学家单盲法光学显微镜下进行观察. DPC4、TGF-β1均主要表达在细胞质内, 呈棕黄色颗粒. 每张切片选择染色良好区域, 连续观察10个高倍视野, 每个视野至少观察50个细胞, 依染色强度分级: 0%为阴性(-), 5%-25%为弱阳性(+), 26%-50%为中度阳性(++), >50%为强阳性(+++). 分子原位杂交操作按照试剂盒说明进行. DPC4和TGF-β1均主要表达在细胞质内, 以胞质或胞膜出现棕黄色颗粒为阳性细胞. 每张切片选择染色良好区域, 随机观察5个高倍视野, 每个视野至少观察100个细胞, 计数500个细胞中染色阳性细胞数, <10%为"-", ≥10%为"+"[11].
统计学处理 所有数据均用SPSS11.0统计软件分析结果. DPC4/TGF-β1蛋白表达水平用非参数Ridit检验; DPC4/TGF-β1 mRNA表达水平用χ2检验. P<0.05为差异有显著性意义.
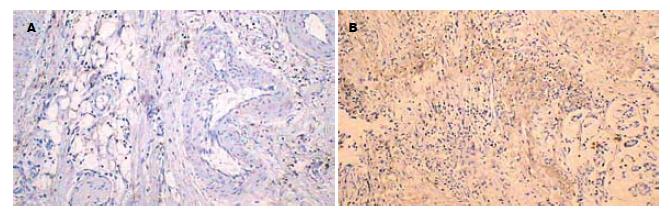
DPC4蛋白主要表达于细胞质, 呈棕黄色染色. 癌组织和正常组织都有DPC4蛋白表达, 但正常组织表达程度显著高于癌组织, 部分癌组织表达缺失(11例). DPC4蛋白表达程度与肿瘤大小、细胞分化程度、临床分期、淋巴结转移有关, 有统计学意义(表1, 图1A). TGF-β1蛋白与DPC4蛋白一样, 主要表达于细胞质, 呈棕黄色染色. 癌组织和正常组织都有TGF-β1蛋白表达, 但癌组织TGF-β1蛋白的表达程度明显高于正常组织. TGF-β1蛋白表达程度与临床分期、淋巴结转移有关, 有统计学意义. (表1, 图1B).
| 组织 | DPC4蛋白表达 | TGF-β1蛋白表达 | ||||||
| - | + | ++ | +++ | - | + | ++ | +++ | |
| 大肠癌b | 11 | 23 | 12 | 2 | 2 | 8 | 22 | 16 |
| 正常 | 3 | 21 | 24 | 6 | 21 | 18 | 3 | |
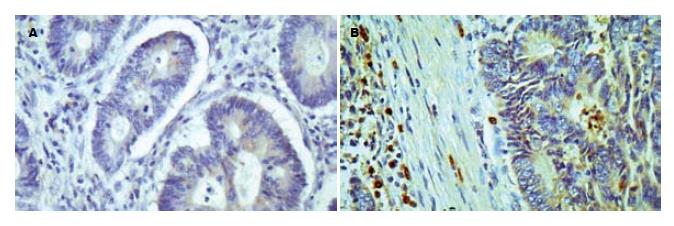
大肠癌组织中DPC4的阳性率为52.1%(25/48), 正常组织的阳性表达率(72.9%, 35/48)高于癌组织, 二者相比有显著性差异. 镜下可见阳性反应物质主要表达于黏膜细胞的胞质, 呈棕黄色染色, 间质细胞也有表达. 其表达程度与肿瘤大小、细胞分化程度、临床分期、淋巴结转移有关, 有统计学意义(表2, 图2A). 大肠癌组织中TGF-β1的阳性率为(68.8%, 33/48), 癌组织的阳性表达率高于正常组织(41.7%, 20/48), 二者相比有显著性差异. 镜下可见阳性反应物质主要表达于黏膜细胞的胞质或胞膜, 偶见胞核着色, 呈棕黄色染色, 阳性颗粒粗细不等. 表达程度与临床分期、淋巴结转移、细胞分化程度有关, 有统计学意义(表2, 图2B). TGF-β1阳性表达的大肠癌组织中, DPC4的阴性率显著高于TGF-β1阴性表达的大肠癌组织中DPC4的阴性率(χ2 = 3.95, P<0.05), 二者有相关关系(表3).
| 临床特征 | n | DPC4的表达 | TGF-β1的表达 |
| 性别 | |||
| 男 | 27 | 16(59.3) | 18(66.7) |
| 女 | 21 | 9(42.9) | 15(71.4) |
| 年龄 | |||
| <60岁 | 25 | 14(56.0) | 18(72.0) |
| ≥60岁 | 23 | 11(47.8) | 15(65.2) |
| 肿瘤大小 | |||
| ≤5 cm | 30 | 20(66.7)b | 22(73.3) |
| >5 cm | 18 | 5(27.8) | 11(61.1) |
| 淋巴结转移 | |||
| 无 | 14 | 11(78.6)a | 13(92.9)a |
| 有 | 34 | 14(41.2) | 20(58.8) |
| 分化程度 | |||
| 高中分化 | 28 | 19(67.9)b | 15(53.6)b |
| 低、未分化 | 20 | 6(30.0) | 18(90.0) |
| 临床分期 | |||
| A+B | 13 | 10(76.9)a | 12(92.3)a |
| C+D | 35 | 15(42.9) | 21(60.0) |
| 部位 | |||
| 结肠 | 26 | 13(50.0) | 16(61.5) |
| 直肠 | 22 | 12(54.5) | 17(77.3) |
| TGF-β1 | DPC4 | |
| + | - | |
| + | 14 | 9 |
| - | 11 | 4 |
大肠癌的发生、发展是一个错综复杂的过程, 受到多种相关基因的调控. TGF-β是一簇结构和功能密切相关的活性多肽, TGF-β1是这一家族的主要成员. 在体外已证实TGF-β1能够诱导细胞周期依赖性激酶(CDK)抑制因子的激活, 阻滞细胞由G1期到S期的进程[12], 但体内TGF-β1对人类肿瘤发生发展的作用以及肿瘤细胞逃逸其负调控功能的机制还不得而知. Smads介导的TGF-β信号通路大致是: TGF-β成员与TβRⅠ, TβRⅡ复合物结合, TβRⅡ引起TβRⅠGS区磷酸化, 活化的TβRⅠ与胞质内R-Smads同源寡聚体短暂结合, 使之C末端SSXS丝氨酸残基磷酸化. 其中Smad1, Smad5和Smad8是BMP的效应分子, Smad2和Smad3是Activin/TGF-β的效应分子. 磷酸化的R-Smads再与Smad4三聚体结合形成异源六聚体或其他形势寡聚体, 移位至细胞核, 与序列特异的DNA结合蛋白结合, 激活特定的靶基因调控转录[13]. TGF-β1对大肠细胞生长具有双向调节作用, 既可促进细胞生长, 又可抑制细胞生长. 当大肠黏膜炎症时他在上皮细胞和黏膜下层呈高表达, 提示TGF-β1与大肠黏膜炎症活动有关, 而当大肠恶变时他又呈现相互矛盾性的表达, 如在原代培养的转移性大肠癌细胞中TGF-β1的表达增高, 而在中度到高度分化的原位癌的生长则被抑制. 研究发现, 在高分化大肠癌细胞组织培养中加入外源性的TGF-β1, 癌细胞生长受到明显抑制, 而对低分化的大肠癌抑制作用则减弱, 同时大肠腺瘤在向大肠癌的发展过程中TGF-β1呈反应性下降. Shim et al[14]在分析121例大肠癌患者血浆中TGF-β1水平认为, 在肠肿瘤进展期这种矛盾转化, 是肿瘤细胞对TGF-β1的不敏感反应, 可能是由于TGF-β1信号通道的失活. 而癌细胞的生物学特性也正是由于受体缺失或性质的改变, 失去TGF-β1的生长抑制反应. 目前认为, TGF-β1在肿瘤的发展中扮演了双重角色, 早期当细胞对TGF-β1的抗增殖效应仍有反应时, TGF-β1起着肿瘤抑制作用; 而在恶性演进期, 当细胞获得了对TGF-β1生长抑制作用的耐受性时, 肿瘤细胞可自分泌大量的TGF-β1, 通过改变肿瘤组织的微环境, 如诱导肿瘤血管生成, 提高肿瘤细胞的运动能力, 免疫抑制及胞外基质的合成等来促进肿瘤的发展及转移[15]. Mamot et al[16]研究了SMAD4在早期大肠癌(Ⅰ、Ⅱ期)的潜在相关性. 在大量的DNA样本中, 73例存在SMAD4基因的一个等位基因缺失, 用PCR方法分析了这73例样本, 其中只有2例有点突变, 表明抑癌基因SMAD4在早期大肠癌中很少发生突变. 瑞士巴塞尔大学医院研究小组指出, 如果患者的肿瘤中检到DPC4这种基因, 则化疗对其有益的可能大了3倍[17]. 许多大肠癌因为肿瘤已对化疗有了抵抗性, 因而对化疗没有反应. DPC4基因抑制了开始失去控制的分裂的细胞, 因此能抗肿瘤. 他们用实时-定量-PCR法分析了202名已接受标准治疗(包括5-FU)的大肠癌患者的肿瘤标本, 得出结论, DPC4在大肠癌患者中可作为以5-FU为基础的化疗方式的预测性的标志物. 另外研究表明DPC4失活与大肠癌的恶性进展, 如远处转移有关[18-19]. 从本实验结果看, 随着大肠癌的转移及分化程度的降低, DPC4的阳性率明显下降.
对TGF-β1反应性降低或丢失在大肠癌的演进过程中是一个重要事件, 这主要涉及到TGF-β1信号通路组成元件的异常. DPC4在TGF-β1信号转导中具有关键作用, 其缺失或突变可使细胞对TGF-β1的生长抑制产生耐受, 促进肿瘤的发展. 不少学者认为, DPC4基因的缺失或突变发生在肿瘤进展的后期, 属于晚期分子事件, 并与肿瘤的浸润和转移密切相关[20-23]. 而DPC4在大肠癌中的低表达则提示, TGF-β1抑制肿瘤生长的转导通路被阻断, 这种阻断作用在转录过程中以及显现. 这种阻断作用可能同时还是TGF-β1在肿瘤中高表达的原因: 由于大肠癌组织细胞失去了对TGF-β1的敏感性, 导致TGF-β1的反馈性表达升高; 而升高的TGF-β1表达失去抑制肿瘤生长的作用, 却没有丧失对NK, LAK等免疫细胞的抑制作用, 因此TGF-β1高表达和DPC4低表达可能促进肿瘤细胞发生免疫逃逸. 此外, DPC4还具有一些独立于TGF-β1的功能, 如DPC4具有调节细胞黏附和侵入的潜在功能, 以及抑制肿瘤的血管增殖的能力等[24-25]. 因此我们认为, DPC4的低表达也可能独立促进肿瘤的浸润及转移, DPC4可被视为一个独立的肿瘤抑制因子. 本结果显示, TGF-β1阳性表达的大肠癌组织中, DPC4的阴性率显著高于TGF-β1阴性表达的大肠癌组织中DPC4的阴性率, 提示DPC4基因的缺失或突变阻断了TGF-β1抑制肿瘤生长的转导通路, 而这种阻断作用又可能通过负反馈作用使肿瘤细胞自分泌TGF-β1增加, 二者可能共同调节恶性肿瘤的发生发展及生物学行为. 总之, 本实验结果显示, TGF-β信号转导通路的紊乱可使细胞逃避TGF-β1介导的生长抑制效应, 在大肠癌的演进过程中起到了重要作用. DPC4的减少与大肠癌的恶性程度与发展过程有直接的关系[26]. 因此, 分析大肠癌组织标本中TGF-β1和DPC4的表达情况, 对于评估大肠癌的发展及预后判断具有重要意义, 也为临床治疗大肠癌提供了一条新的思路.
我国大肠癌的发病人数呈逐年增高的趋势, 其发生发展的分子基础仍不清楚, 未发现与大肠癌发生、预后直接有关的基因. TGF-β信号转导通路的异常与肿瘤关系密切, TGF-β1是这一家族的主要成员. DPC4/SMAD4 是1996年发现的一种新的肿瘤抑制基因, 其所编码的Smad4蛋白是转导TGF-β1信号的重要胞质内信号级联分子, 调节TGF-β1应答基因的转录.
吴泰璜, 教授, 山东省立医院肝胆外科
大肠癌的防治已成为大肠癌研究的一大热点. 寻找与大肠癌发生、发展、预后相关基因和新的干预治疗靶点具有重要意义.
研究发现Smad4在多种肿瘤如胆囊癌、口腔鳞癌、膀胱癌等表达下调, 并可调控TGF-β细胞信号传导通路, 抑制肿瘤细胞生长.
TGF-β1和DPC4是TGF-β转导通路中起瓶颈作用的关键因子. TGF-β1高表达和DPC4低表达可作为大肠癌预后不良的指标.
DPC4的抑癌功能及调节细胞信号转导通路的功能可被引入肿瘤的基因治疗, 从而使人工调节DPC4水平及干涉其作用通路成为治疗肿瘤的新的有效方法.
DPC4/SMAD4: 1996年由美国约翰·霍普金斯大学研究所Hahn et al发现的一种新的肿瘤抑制基因, 其所编码的Smad4蛋白是转导TGF-β1信号的重要胞质内信号级联分子, 调节TGF-β1应答基因的转录.
本研究内容全面, 目的明确, 论述条理, 具有一定的临床应用价值.
编辑: 潘伯荣 电编:吴鹏朕
| 1. | Attisano L, Wrana JL. Signal transduction by the TGF-beta superfamily. Science. 2002;296:1646-1647. [PubMed] [DOI] |
| 2. | Ehata S, Hanyu A, Hayashi M, Aburatani H, Kato Y, Fujime M, Saitoh M, Miyazawa K, Imamura T, Miyazono K. Transforming growth factor-beta promotes survival of mammary carcinoma cells through induction of antiapoptotic transcription factor DEC1. Cancer Res. 2007;67:9694-9703. [PubMed] [DOI] |
| 3. | Hsiao YW, Liao KW, Chung TF, Liu CH, Hsu CD, Chu RM. Interactions of host IL-6 and IFN-gamma and cancer-derived TGF-beta1 on MHC molecule expression during tumor spontaneous regression. 2008; Feb 8. [Epub ahead of print]. [PubMed] |
| 4. | Langenskiold M, Holmdahl L, Falk P, Angenete E, Ivarsson ML. Increased TGF-beta 1 protein expression in patients with advanced colorectal cancer. J Surg Oncol. 2008;97:409-415. [PubMed] [DOI] |
| 5. | Mincione G, Di Marcantonio MC, Artese L, Vianale G, Piccirelli A, Piccirilli M, Perrotti V, Rubini C, Piattelli A, Muraro R. Loss of expression of TGF-beta1, TbetaRI, and TbetaRII correlates with differentiation in human oral squamous cell carcinomas. Int J Oncol. 2008;32:323-331. [PubMed] |
| 6. | Effect of TGF-beta1 on cell cycle regulatory proteins in LPS-stimulated normal mouse B lymphocytes. J Immunol. 1997;159:4155-4164. [PubMed] |
| 7. | Kehrl JH, Taylor A, Kim SJ, Fauci AS. Transforming growth factor-beta is a potent negative regulator of human lymphocytes. Ann N Y Acad Sci. 1991;628:345-353. [PubMed] [DOI] |
| 8. | Cao WX, Cheng QM, Fei XF, Li SF, Yin HR, Lin YZ. A study of preoperative methionine-depleting parenteral nutrition plus chemotherapy in gastric cancer patients. World J Gastroenterol. 2000;6:255-258. [PubMed] |
| 9. | Pizzi S, Azzoni C, Bassi D, Bottarelli L, Milione M, Bordi C. Genetic alterations in poorly differentiated endocrine carcinomas of the gastrointestinal tract. Cancer. 2003;98:1273-1282. [PubMed] [DOI] |
| 10. | Ijichi H, Ikenoue T, Kato N, Mitsuno Y, Togo G, Kato J, Kanai F, Shiratori Y, Omata M. Systematic analysis of the TGF-beta-Smad signaling pathway in gastrointestinal cancer cells. Biochem Biophys Res Commun. 2001;289:350-357. [PubMed] [DOI] |
| 11. | Hirayama D, Fujimori T, Satonaka K, Nakamura T, Kitazawa S, Horio M, Maeda S, Nagasako K. Immunohistochemical study of epidermal growth factor and transforming growth factor-beta in the penetrating type of early gastric cancer. Hum Pathol. 1992;23:681-685. [PubMed] [DOI] |
| 12. | Crivello A, Giacalone A, Vaglica M, Scola L, Forte GI, Macaluso MC, Raimondi C, Di Noto L, Bongiovanni A, Accardo A. Regulatory cytokine gene polymorphisms and risk of colorectal carcinoma. Ann N Y Acad Sci. 2006;1089:98-103. [PubMed] [DOI] |
| 13. | Datto M, Wang XF. The Smads: transcriptional regulation and mouse models. Cytokine Growth Factor Rev. 2000;11:37-48. [PubMed] [DOI] |
| 14. | Shim KS, Kim KH, Han WS, Park EB. Elevated serum levels of transforming growth factor-beta1 in patients with colorectal carcinoma: its association with tumor progression and its significant decrease after curative surgical resection. Cancer. 1999;85:554-561. [PubMed] [DOI] |
| 15. | Pasche B. Role of transforming growth factor beta in cancer. J Cell Physiol. 2001;186:153-168. [PubMed] [DOI] |
| 16. | Mamot C, Mild G, Reuter J, Laffer U, Metzger U, Terracciano L, Boulay JL, Herrmann R, Rochlitz C. Infrequent mutation of the tumour-suppressor gene Smad4 in early-stage colorectal cancer. Br J Cancer. 2003;88:420-423. [PubMed] [DOI] |
| 17. | Boulay JL, Mild G, Lowy A, Reuter J, Lagrange M, Terracciano L, Laffer U, Herrmann R, Rochlitz C. SMAD4 is a predictive marker for 5-fluorouracil-based chemotherapy in patients with colorectal cancer. Br J Cancer. 2002;87:630-634. [PubMed] [DOI] |
| 18. | Isaksson-Mettävainio M, Palmqvist R, Forssell J, Stenling R, Oberg A. SMAD4/DPC4 expression and prognosis in human colorectal cancer. Anticancer Res. 2006;26:507-510. [PubMed] |
| 19. | Shiou SR, Singh AB, Moorthy K, Datta PK, Washington MK, Beauchamp RD, Dhawan P. Smad4 regulates claudin-1 expression in a transforming growth factor-beta-independent manner in colon cancer cells. Cancer Res. 2007;67:1571-1579. [PubMed] [DOI] |
| 20. | Ohtaki N, Yamaguchi A, Goi T, Fukaya T, Takeuchi K, Katayama K, Hirose K, Urano T. Somatic alterations of the DPC4 and Madr2 genes in colorectal cancers and relationship to metastasis. Int J Oncol. 2001;18:265-270. [PubMed] |
| 21. | Schneider G, Schmid RM. Genetic alterations in pancreatic carcinoma. Mol Cancer. 2003;2:15. [PubMed] [DOI] |
| 22. | Cowgill SM, Muscarella P. The genetics of pancreatic cancer. Am J Surg. 2003;186:279-286. [PubMed] [DOI] |
| 23. | Moore PS, Beghelli S, Zamboni G, Scarpa A. Genetic abnormalities in pancreatic cancer. Mol Cancer. 2003;2:7. [PubMed] [DOI] |
| 24. | Schwarte-Waldhoff I, Klein S, Blass-Kampmann S, Hintelmann A, Eilert C, Dreschers S, Kalthoff H, Hahn SA, Schmiegel W. DPC4/SMAD4 mediated tumor suppression of colon carcinoma cells is associated with reduced urokinase expression. Oncogene. 1999;18:3152-3158. [PubMed] [DOI] |
| 25. | Schwarte-Waldhoff I, Volpert OV, Bouck NP, Sipos B, Hahn SA, Klein-Scory S, Lüttges J, Klöppel G, Graeven U, Eilert-Micus C. Smad4/DPC4-mediated tumor suppression through suppression of angiogenesis. Proc Natl Acad Sci U S A. 2000;97:9624-9629. [PubMed] [DOI] |
| 26. | Xu WQ, Jiang XC, Zheng L, Yu YY, Tang JM. Expression of TGF-beta1, TbetaRII and Smad4 in colorectal carcinoma. Exp Mol Pathol. 2007;82:284-291. [PubMed] [DOI] |