修回日期: 2008-05-07
接受日期: 2008-05-27
在线出版日期: 2008-06-18
目的: 探讨DNA异常甲基化与肝细胞肝癌间的相关性及5-氮杂胞苷(5-aza-CR)抑制肝癌细胞恶性表型和逆转甲基化状态的作用及其机制.
方法: 用5-aza-CR处理肝癌细胞株HuH-7和裸鼠移植瘤模型, 然后用相差显微镜观察药物处理前后细胞形态变化, MTT法观察细胞生长速度变化, 流式细胞仪检测细胞周期、细胞凋亡率, 甲基化特异性PCR(MSP)检测p16基因5'CpG岛甲基化状态, RT-PCR法检测p16 mRNA的表达情况.
结果: 5-aza-CR对肿瘤细胞HuH-7和裸鼠移植瘤细胞均有明显的抑制作用; 实验组HuH-7细胞周期G0/G1期延长41.1%±3.2%, S期缩短39.0%±1.4%, G2期缩短2.2%±0.7%, 凋亡细胞增加30.0%±4.5%; 裸鼠移植瘤细胞周期G0/G1期延长27.4%±3.1%, S期缩短25.8%±2.1%, G2期缩短1.6%±1.8%, 凋亡细胞增加2.9%±0.6%; 对照组HuH-7与裸鼠细胞仅甲基化引物扩增出特异PCR条带, 实验组HuH-7细胞仅非甲基化引物扩增出特异PCR条带, 而实验组裸鼠细胞甲基化和非甲基化引物均扩增出特异PCR条带; 实验组肿瘤细胞HuH-7和裸鼠移植瘤细胞的p16 mRNA均有表达, 而对照组则无表达.
结论: 5-aza-CR在体外和体内均有抑制肝癌细胞生长、阻滞细胞周期G1/S和促进p16 mRNA表达的作用; 5-aza-CR可抑制肝癌细胞恶性表型和逆转p16甲基化状态.
引文著录: 董科, 李波, 覃扬, 俞小炯, 温尔刚. 5-氮杂胞苷抑制肝癌细胞恶性表型和逆转甲基化状态的作用及机制. 世界华人消化杂志 2008; 16(17): 1842-1848
Revised: May 7, 2008
Accepted: May 27, 2008
Published online: June 18, 2008
AIM: To investigate correlation between DNA methylation alteration and hepatocellular carcinoma as well as to explore mechanisms of 5-aza-CR inhibiting hepatoma cell lines and reversed methylation.
METHODS: Human hepatoma cell lines, HuH-7, and the murine xenograft model were treated with 5-aza-CR. Cell morphology changes were determined under phase contrast microscopy, cell growth speed was measured using MTT assay, cell cycle distribution and apoptosis rate were estimated using flow cytometry, methylation status of p16 was determined using methylation-specific PCR and mRNA expression of p16 was determined using RT-PCR.
RESULTS: After treatment with 5-aza-CR, significant inhibiting effects were detected both in hepatoma cell lines HuH-7 and the murine xenograft model cells. In the treatment group, G1 of HuH-7 increased by 41.1% ± 3.2%, S and G2 + M decreased by 39.0% ± 1.4% and 2.2% ± 0.7%, respectively, and apoptosis rate increased by 30.0% ± 4.5%. In the murine xenograft model group, G1 increased by 27.4% ± 3.1%, S and G2 + M decreased by 25.8% ± 2.1% and 1.6% ± 1.8%, respectively, and apoptosis rate increased by 2.9% ± 0.6%. Only methylating PCR product appeared before treatment with drugs, Conversely while only demethylating PCR amplification product was detected after drug treatment. For the murine xenograft model group, methylated PCR product was detected in the control group, however, methylated and demethylated PCR amplification products were observed in the experimental group. Both cell and xenografted nude mice presented the expression of p16 mRNA in experimental group. No expression of p16 mRNA was detected in the control group.
CONCLUSION: 5-aza-CR inhibits tumor cell growth, decreases cell cycle and increases mRNA expression of p16 in hepatoma cell lines both in vitro and in vivo. 5-aza-CR inhibits the malignant phenotypes of human hepatocellular carcinoma cells and reverses hympermethylation of p16.
- Citation: Dong K, Li B, Qing Y, Yu XJ, Wen EG. Effects of 5-azacytidine on the growth inhibition of human hepatocellular carcinoma cells and reversion of p16 hympermethylation. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1842-1848
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1842.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1842
肝癌是危害人类健康的恶性肿瘤之一, 发病率和死亡率均很高, 肝癌的发生发展是一个涉及到多基因改变多阶段的复杂过程, 肝癌形成后表现出大量的遗传学改变和表遗传学改变(epigenetic alterations), 表遗传学改变是基因表达的主要修饰方式之一, 在肿瘤的发生发展中起着重要作用[1-2]. 如DNA损伤修复、细胞周期调控、血管生成及细胞凋亡等都与其调控区的CpG岛甲基化有密切关系. 肿瘤相关基因的异常甲基化在癌形成中起着持续可逆的潜在作用, 这种情况与基因缺失或畸变不同, 这种异常甲基化可以通过临床的治疗来逆转, 使其恢复正常状况[3-4]. 许多研究证明HCC中, CpG岛甲基化发生率较高, 而缺失、突变却相对少见, 可见DNA甲基化是肝癌中p16基因失活的主要机制. 于是, 我们用5-氮杂胞苷(5-azacytidine, 5-aza-CR)处理HuH-7肝癌细胞株(已证实为p16基因CpG岛甲基化)和裸鼠HuH-7细胞移植瘤[5-6], 在体外和体内观察其恶性生物学行为与甲基化状态的变化, 分析其机制.
肝癌细胞系HuH-7细胞购于武汉大学保藏中心细胞库裸鼠, 雌雄不分, 4-6 wk龄, 体质量15-20 g, 购于四川大学华西实验动物中心; 所选用的甲基化、非甲基化特异引物序列和p16 RT-PCR引物根据基因序列并参照国外文献设计[7], 内参照β2微球蛋白(β2-MG)引物(表1), 引物均委托上海生工公司合成.
| 引物序列 | 片段大小(bp) | ||
| p16 | Sense | 5'- ATGGAGCCTTCGGCTGACTG-3' | 404 |
| Antisence | 5'-CGGGCATGGTTACTGCTCTG-3 | ||
| β2-M | Sense | 5'-CTCGCGCTACTCTCTCTTTCTGG-3' | 335 |
| Antisence | 5'-GCTTACATGTCTCGATCCCACTTAA-3' | ||
| p16 M | Sense | 5'-TTATAGAGGGTGGGGCGGATCGC -3' | 150 |
| Antisense | 5'-GACCCCGAACCGCGACCGTAA-3' | ||
| p16 U | Sense | 5'-TTATTAGAGGGTGGGGTGGATTGT-3' | 151 |
| Anfisemse | 5'-CAACCCCAAACCACAACCATAA-3' |
1.2.1 体外实验: (1)选用HuH-7细胞株, 取对数生长期细胞调节细胞浓度为5×107个/L, 进行MTT实验, 试验组加入不同浓度的5-aza-CR, 使其终浓度分别为1、2、4、8、10 μmol/L, 绘制HuH-7细胞生长曲线. (2)取处于对数生长期的HuH-7细胞, 调细胞浓度到5×108个/L, 加入5-aza-CR, 药物终浓度为5 μmol/L, 对照组不加药. 培养5 d, 送FCM检测, 分析细胞周期和凋亡峰. (3)未经药物处理(对照组)和经5 μmol/L 5-aza-CR处理(实验组)5 d后的HuH-7细胞基因组DNA进行甲基化特异性PCR(MSP)扩增[7], 反应体系中(25 μL): 双蒸水11 μL, 10×PCR Reaction Buffer 2.5 μL, dNTP 2.5 μL, 上、下游引物各1 μL(20 mmol/L), DNA 5 μL, Taq聚合酶2 U(2 U/2 μL). 反应条件为: 95℃变性5 min, 95℃变性45 s, 65℃退火45 s, 72℃延伸45 s, 循环扩增35次. (4)逆转录聚合酶链式反应(RT-PCR): 经β2-MG PCR扩增后的cDNA再进行p16基因PCR扩增. 反应体积为30 μL, 其中l0×PCR Buffer 3 μL, 25 mmol/L MgCl2 3 μL, 25 mmol/L dNTPmix 3.6 μL, 20 µmol/L Sense 0.75 μL, 20 µmol/L Antisence 0.75 μL, Taq多聚酶(5 U/1 μL)1 U(0.2 μL), 稀释RT产物: cDNA 1.2 μL. 反应条件为: 预变性94℃, 5 min; 变性94℃ 30 s, 退火58.5℃ 30 s, 72℃延伸1 min, 进行35个循环; 后延伸72℃冷延伸10℃.
1.2.2 体内实验: (1)裸鼠人肝癌模型的制作: 将对数期生长HuH-7细胞调整浓度为5×106/0.2 mL细胞悬液, 接种于裸小鼠右侧腋下. 共接种14只裸鼠, 实验组和对照组各7只, 实验组: 接种裸小鼠1 wk后, 经腹腔内注入5-aza-CR 1.5 μg/g, 每天一次, 连续3 d; 对照组: 腹腔内只给等体积生理盐水, 每天一次, 连续3 d. 5 wk后处死裸小鼠, 并计算两组瘤体积大小和抑瘤率, 抑瘤率(%) = (1-实验组平均瘤体积/对照组平均瘤体积)×100%, P<0.05有意义. 标本送检测. (2)实验组和对照组移植瘤组织细胞DNA p16基因甲基化状态的检测: 取移植肿瘤组织并提取DNA, 提取的两组裸鼠移植瘤DNA按体外实验部分的方法检测p16基因甲基化状态, 反应体系和反应条件亦同体外实验部分. (3)裸鼠组织细胞RNA的提取和RT-PCR: 裸鼠肝癌移植瘤组织用TRIzol Reagent提取RNA, 以后按体外实验部分进行逆转录聚合酶链式反应(RT-PCR).
统计学处理 对计量资料及计数资料分别进行t检验和方差分析.
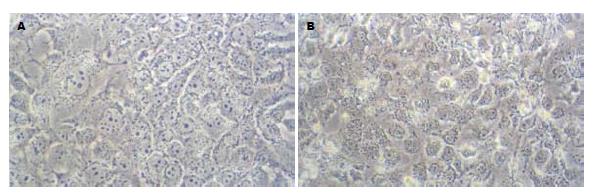
光镜见: 对照组细胞呈多角形、核大、细胞数量和增殖速度明显快于实验组; 实验组细胞大小趋于均匀, 形态趋于规则, 核浆比例降低, 增值分裂减慢, 部分细胞有凋亡和坏死(图1).
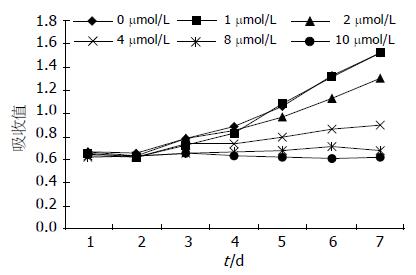
对照组细胞生长曲线呈快速上升趋势, 实验组当药浓度上升至4 μmol/L以上时, 细胞生长速度较对照组明显缓慢(图2).
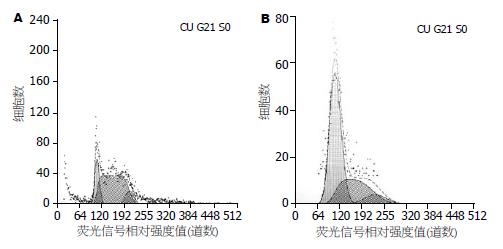
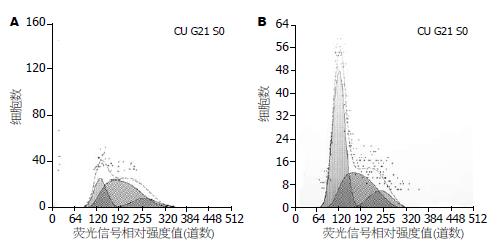
HuH-7细胞经5-aza-CR处理前后细胞周期和凋亡率有明显改变: 5-aza-CR对肿瘤细胞HuH-7有明显的抑制作用, 实验组细胞的细胞周期发生了明显改变, G0/G1期延长了41.1%±3.2%, S期缩短了39.0%±1.4%, G2期缩短了2.2%±0.7%, 凋亡细胞增加了30.0%±4.5%(图3-4).
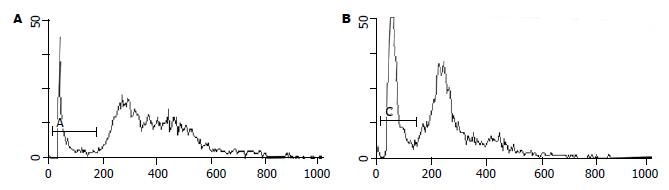
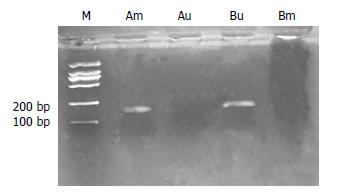
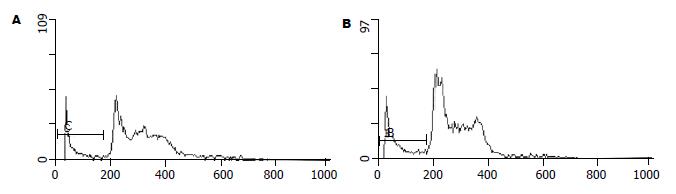
MSP电泳结果可见, 对照组细胞仅甲基化引物扩增出特异PCR条带(Am道150 bp), 实验组仅非甲基化引物扩增出特异PCR条带(Bu道)(图5).
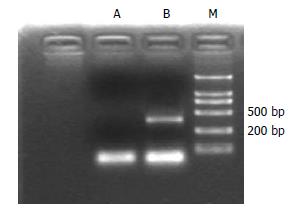
实验组细胞有p16 mRNA表达(B道404 bp), 而对照组没有p16 mRNA表达(A道)(图6).
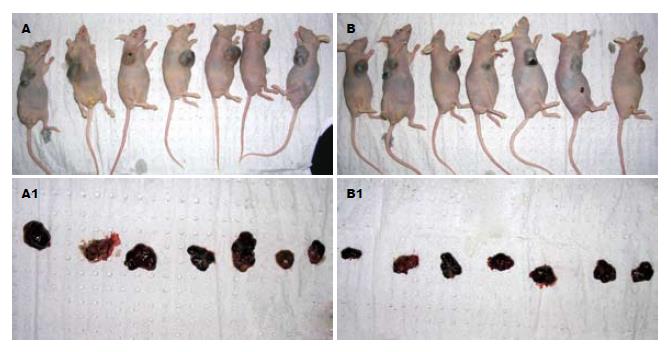
5 wk后, 处死裸鼠, 实验组和对照组移植肿瘤以及切除移植瘤体积大小对比结果见图7, 抑瘤率(%) = (1-4.45/8.13)×100% = 42.44(表2).
| 裸鼠编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | mean±SD |
| 对照组 | 8.91 | 9.56 | 4.91 | 4.47 | 9.56 | 9.19 | 10.32 | 8.13±0.32 |
| 实验组 | 4.28 | 3.44 | 6.37 | 3.48 | 6.16 | 5.46 | 1.92 | 4.45±0.25 |
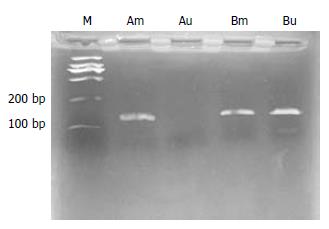
对照组甲基化引物扩增阳性(Am道150 bp), 而非甲基化引物扩增阴性(Au道); 实验组甲基化引物和而非甲基化引物扩增均阳性(Bm和Bu道)(图8).
该药对裸鼠移植瘤亦有明显抑制作用: 实验组和对照组比较, 凋亡细胞增加2.9%±0.6%, 细胞周期发生了明显改变, G0/G1期延长了27.4%±3.1%, S期缩短了25.8%±2.1%, G2期缩短了1.6%±1.8%(图9-10)
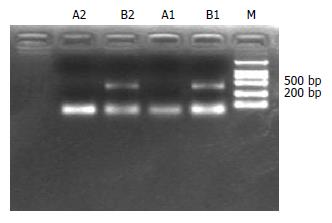
实验组HuH-7移植瘤细胞有p16 mRNA表达(B1和B2道, 404 bp); 而对照组HuH-7移植瘤细胞没有p16 mRNA表达(A1和A2道)(图11).
我们用四唑盐比色法(MTT)检测HuH-7细胞在用药物处理后的生长曲线. 用一定浓度5-aza-CR处理后, p16基因异常甲基化就可能得以逆转, 其抑癌功能可能就得以表现. 然而, 我们发现: 在5-aza-CR浓度为2 μmol/L以下时, 实验组与对照组相比, 其抑制作用无显著性差异(P>0.05); 但当5-aza-CR浓度达到4 μmol/L或以上时, 与对照组相比, 则抑制作用有显著性差异(P<0.01), 具统计学意义. 这说明该药物要达一定浓度, 才有抑制肿瘤细胞生长的作用. MTT结果表明: 5-aza-CR对HuH-7细胞生长的抑制作用有时间及浓度依赖作用, 即随着药物浓度的增加, 作用时间的延长, 细胞生长缓慢、停滞, 甚至死亡. 这说明低浓度的5-aza-CR可能不能改变p16基因的异常甲基化状态, 其抑制肿瘤增殖功能尚未表现出来.
流式细胞术检测结果: 细胞G0/G1期延长, 分别由19.6%增加到60.7%, 而G2期和S期均缩短; G2期分别由10.0%减少到8.1%; S期分别由70.1%减少到31.2%. 这提示5-氮杂胞苷可能将通过G0/G1期而进入S期的HuH-7细胞阻滞于G1期, 从而导致DNA合成期(S期)细胞含量相对下降; 细胞凋亡率增加了30.9%, 说明5-aza-CR具有诱导凋亡的作用. 5-aza-CR可改变肿瘤细胞周期, 使G0/G1期延长, S期缩短, 这与大多数5-aza-CR的实验结果是相同的[9-13].
迄今已有许多事实证明, 在许多肿瘤中, 包括肝细胞癌, 对p16基因来说, 除了缺失、突变外, p16基因甲基化是一种普遍现象. 如图5所示, 以5 μmol/L 5-aza-CR处理HuH-7细胞5 d后, 均使p16基因完全去甲基化, 非甲基化引物扩增阳性. 5-aza-CR同5-脱氧杂氮胞苷一样对p16基因是一个有效的去甲基化药物[10-11].
p16基因mRNA的表达情况决定了p16蛋白的表达. 我们应用RT-PCR技术检测HuH-7肝癌细胞, 经5-aza-CR药物处理后, p16基因mRNA出现表达, 而未经药物处理的细胞未出现p16 mRNA的表达. 说明5-aza-CR处理后, 肝癌细胞生长抑制和恶性程度降低是因为5-aza-CR去甲基化作用, 诱导因高甲基化而处于静止状态的基因重新表达, 尤其是抑癌基因p16的表达. 提示高甲基化状态及p16基因失活在肝癌的发生发展中起重要作用.
HuH-7裸鼠移植瘤经5-aza-CR处理后, 肿瘤细胞生长受到抑制, 裸鼠致瘤性也明显降低, 其抑瘤率达45%. 进一部用MSP检测p16基因甲基化状态发现, 对照组甲基化引物扩增阳性, 而非甲基化引物扩增阴性; 实验组甲基化引物和非甲基化引物扩增均阳性. 说明该药部分改变了p16基因的甲基化状态, 也就是说只有部分肿瘤细胞的p16基因的甲基化改变得以逆转, 从而表现为甲基化引物和非甲基化引物扩增均有条带. 进一步研究发现实验组p16 mRNA表达均增高, 说明5-aza-CR处理后, p16基因功能得以恢复或部分恢复, P16蛋白重新表达, 使细胞阻滞于G1期, 在其他凋亡诱导因子的协同作用下, 抑制肿瘤细胞生长. 同样提示高甲基化状态及p16基因失活在肝癌的发生发展中起重要作用. 当然, 绝非仅仅p16抑癌基因, 还可能有其他基因存在异常高甲基化, 如肖文华 et al[14], 在以往的研究中发现肝癌中17P13.3位点CpG岛、PYNZ 22.1基因CpG位点及Rb基因存在异常高甲基化. Zhong et al[15]研究发现HuH-7还存在RASSF1A基因启动子区CpG岛的异常甲基化, 用5-脱氧杂氮胞苷处理后, 其基因功能得以恢复. 因此, 5-aza-CR去甲基化作用是否也恢复了这些抑癌基因的功能, 尚待进一步研究. 用5-aza-CR注射裸鼠腹腔后, 实验组甲基化检测结果是甲基化引物和非甲基化引物扩增均阳性, 而体外实验的实验组甲基化检测结果是甲基化引物扩增阴性, 非甲基化引物扩增则阳性. 说明腹腔内给药只能部分改变p16基因的甲基化状态, 也就是说只有部分裸鼠肿瘤细胞的p16基因的甲基化改变得以逆转. 为什么会出现这种结果? 我们分析是: (1)给药剂量不够, 达不高有效的血浓度. (2)给药后裸鼠饲养时间较短, 使有些肿瘤细胞的异常甲基化还没逆转过来. (3)给药次数过少使药物的作用时间过短. 或许还有其他我们不能解释的原因.
总之, 经药物处理的细胞珠和裸鼠, 其光镜下、生长曲线、移植瘤大小、细胞周期的变化和p16 mRNA表达等, 提示5-aza-CR可抑制肝癌细胞的恶性表型.
肝癌的发生发展是一个涉及到多基因改变的多阶段复杂过程, 肝癌形成后表现出大量的遗传学和表遗传学改变. 表遗传修饰主要包括DNA甲基化/去甲基化和组蛋白乙酰化/去乙酰化, 在肿瘤发生发展中起着重要作用. DNA甲基化是肝癌中p16基因失活的主要机制. 肿瘤相关基因的异常甲基化在癌形成中起着持续的可逆的潜在作用, 这种异常甲基化可以通过临床的治疗来逆转, 使其恢复正常状况. 因此, 抑癌基因的去甲基化成为临床治疗肿瘤的一个新的途径, 5-氮杂胞苷是研究DNA甲基化在细胞分化和基因活化中所起作用的一个重要工具.
丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科; 杨林, 副研究员, 中山大学附属第三医院感染病科
有研究者用5-脱氧氮杂胞苷处理肝癌细胞株, 细胞生长受到抑制, 进一步研究发现其甲基转移酶mRNA表达降低、p16 mRNA、蛋白表达均增高, 并使肝癌细胞阻滞于G1期, 但未对用药前后肿瘤细胞的甲基化状态作进一步的研究, 也未进行相关的体内实验研究.
本课题前期研究阐明启动子区异常甲基化是HCC中p16基因失活的重要原因, 与HCC有明确的相关性. 该论文通过体外和体内实验, 来进一步研究p16基因去甲基化,对肿瘤细胞凋亡、细胞周期、p16 mRNA、P16蛋白和p16基因的甲基化状态的影响. 目前采用动物模型来作这方面的对比研究还少见报道.
通过5-aza-CR对肝癌细胞在体外和体内作用的研究, 检测细胞增殖、细胞周期、凋亡、p16甲基化状态改变、P16蛋白和p16 mRNA表达变化, 探讨DNA甲基化异常与肝细胞肝癌间的相关性及5-aza-CR抑制肝癌细胞恶性表型和逆转甲基化状态的作用及其机制, 对肝癌的发病机制探讨、基因和药物治疗均有一定的指导意义.
MSP: 甲基化特异性PCR. 其原理是基于亚硫酸氢盐和氢醌能将DNA链上的C碱基变成U碱基; 而当C碱基被甲基化后, 这一转化将不会发生. 这样, 甲基化与非甲基化的DNA序列经过亚硫酸氢盐修饰后, 即可通过序列特异的引物区分开来.
本文设计合理, 研究方法正确, 图表清楚, 书写规范, 有一定的学术价值及潜在应用价值.
编辑: 李军亮 电编:郭海丽
| 1. | Coleman WB. Mechanisms of human hepatocarcinogenesis. Curr Mol Med. 2003;3:573-588. [PubMed] [DOI] |
| 2. | Esteller M, Corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] |
| 3. | Herranz M, Esteller M. DNA methylation and histone modifications in patients with cancer: potential prognostic and therapeutic targets. Methods Mol Biol. 2007;361:25-62. [PubMed] |
| 4. | Fojtova M, Piskala A, Votruba I, Otmar M, Bartova E, Kovarik A. Efficacy of DNA hypomethylating capacities of 5-aza-2'-deoxycytidine and its alpha anomer. Pharmacol Res. 2007;55:16-22. [PubMed] [DOI] |
| 5. | Cui X, Wakai T, Shirai Y, Yokoyama N, Hatakeyama K, Hirano S. Arsenic trioxide inhibits DNA methyltransferase and restores methylation-silenced genes in human liver cancer cells. Hum Pathol. 2006;37:298-311. [PubMed] [DOI] |
| 6. | Luan J, Qin Y, Xu D, Sun ZL, Sun ZF. Growth inhibition and demethylation by a component of natural drug, CDP, in cancer cell lines. Sichuan Daxue Xuebao Yixueban. 2005;36:834-838. [PubMed] |
| 8. | Hui AM, Sakamoto M, Kanai Y, Ino Y, Gotoh M, Yokota J, Hirohashi S. Inactivation of p16INK4 in hepatocellular carcinoma. Hepatology. 1996;24:575-579. [PubMed] [DOI] |
| 9. | Herman JG, Merlo A, Mao L, Lapidus RG, Issa JP, Davidson NE, Sidransky D, Baylin SB. Inactivation of the CDKN2/p16/MTS1 gene is frequently associated with aberrant DNA methylation in all common human cancers. Cancer Res. 1995;55:4525-4530. [PubMed] |
| 10. | Poirier F, Pontet M, Labas V, le Caer JP, Sghiouar-Imam N, Raphael M, Caron M, Joubert-Caron R. Two-dimensional database of a Burkitt lymphoma cell line (DG 75) proteins: protein pattern changes following treatment with 5'-azycytidine. Electrophoresis. 2001;22:1867-1877. [PubMed] [DOI] |
| 11. | Koh E, Bandle R, Clair T, Roberts DD, Stracke ML. Trichostatin A and 5-aza-2'-deoxycytidine switch S1P from an inhibitor to a stimulator of motility through epigenetic regulation of S1P receptors. Cancer Lett. 2007;250:53-62. [PubMed] [DOI] |
| 13. | Qin Y, Liu JY, Li B, Sun ZL, Sun ZF. Association of low p16INK4a and p15INK4b mRNAs expression with their CpG islands methylation with human hepatocellular carcinogenesis. World J Gastroenterol. 2004;10:1276-1280. [PubMed] |
| 15. | Zhong S, Yeo W, Tang MW, Wong N, Lai PB, Johnson PJ. Intensive hypermethylation of the CpG island of Ras association domain family 1A in hepatitis B virus-associated hepatocellular carcinomas. Clin Cancer Res. 2003;9:3376-3382. [PubMed] |