修回日期: 2008-04-06
接受日期: 2008-05-15
在线出版日期: 2008-06-18
目的: 探讨5-Aza-dC及TSA对胃癌细胞系中抑癌基因p16和hMLH-1基因甲基化水平和基因表达的影响.
方法: 5-Aza-dC及TSA处理体外培养的MKN-45细胞和MGC-803细胞, 应用逆转录PCR(RT-PCR)法及甲基化特异性PCR(MSP)法分别检测两株细胞药物干预前后抑癌基因p16和hMLH-1的表达及甲基化情况.
结果: MKN-45和MGC-803细胞系经TSA, 5-Aza-dC及联合作用后使原来不表达或有弱表达的抑癌基因p16和hMLH-1重新表达或表达增强. 胃癌细胞系MKN-45和MGC-803均显示p16、hMLH-1基因启动子区存在高甲基化, 其中p16基因在两种胃癌细胞系中均表现为甲基化, hMLH-1基因在胃癌细胞系MGC-803中表现为甲基化而在胃癌细胞系MKN-45中表现为半甲基化. 在5-Aza-dC及TSA的作用下, MKN-45和MGC-803细胞系中p16及hMLH-1基因的甲基化状态得到逆转.
结论: 胃癌细胞系中抑癌基因p16和hMLH-1基因启动子甲基化可能是导致其基因失活的主要原因, 5-Aza-dC单独作用和5-Aza-dC及TSA联合应用效果相似, 均能显著增强甲基化的肿瘤抑制基因的重新表达.
引文著录: 朱新江, 孟春风, 彭过, 戴冬秋. 5-Aza-dC和TSA对胃癌细胞系p16和hMLH-1基因甲基化水平及表达的影响. 世界华人消化杂志 2008; 16(17): 1837-1841
Revised: April 6, 2008
Accepted: May 15, 2008
Published online: June 18, 2008
AIM: To investigate effects of 5-Aza-2'-deoxy-citydine (5-Aza-dC) and trichostatin A (TSA) on the expression and methylation of p16 and hMLH-1 gene in gastric carcinoma cells.
METHODS: Human gastric cancer cell lines MKN-45 and MGC-803 were cultured in vitro in RPMI 1640 and then treated with different concentrations of 5-Aza-dC and TSA. The methylation of p16 and of MLH-1 gene in the two kind of cell lines was detected using methylation-specific-polymerase chain reaction (MSP), and the expression levels of p16 and hMLH-1 gene were detected using reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Reexpression or raised expressions of p16 and hMLH-1 mRNA was detected in MGC-803 and MKN-45 gastric cancer cell lines after treatment with 5-Aza-dC alone, or in combination with TSA, or with TSA alone. The two cell lines showed a characteristic DNA methylation status in each promoter region of p16 gene and hMLH-1 gene. p16 gene was hypermethylated in MGC-803 and MKN-45; hMLH-1 gene was hypermethylated in MGC-803, but hemi-methylated in MKN-45. The methylation of p16 and hMLH-1 gene in MKN-45 and MGC-803 cells was reversed after either 5-Aza-dC treatment or TSA treatment.
CONCLUSION: Aberrant methylation of p16 and hMLH-1 gene is a common event in the occurrence and progression of gastric cancer. The methylation of promoter region in CPG island is a main cause for p16 and hMLH-1 gene transcriptional inactivation. Siginificantly raised reexpression of methylated tumor suppressor genes was detected after either treatment with 5-Aza-dC alone or in combination with TSA.
- Citation: Zhu XJ, Meng CF, Peng G, Dai DQ. Effects of 5-Aza-2'-deoxycitydine and trichostatin A on expression and methylation of p16 and hMLH-1 gene in human gastric cancer cell lines. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1837-1841
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1837.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1837
胃癌是一种严重威胁人类健康的恶性肿瘤, 国内外大量资料显示, 胃癌的发生与其他恶性肿瘤一样是多基因多阶段变异累积形成的病理过程[1-5]. 抑癌基因启动子内CpG岛出现异常甲基化常导致其表达丧失或减少, 从而诱导肿瘤发生. p16及hMLH-1是已经确认的抑癌基因, 在细胞凋亡过程中起着重要作用[6-9]. 我们通过此二基因在MKN-45细胞系及MGC-803细胞系中药物干预前后的表达以及甲基化的状态探讨该抑癌基因的表达与其甲基化状态的相关性, 并分析肿瘤细胞的生物学行为改变, 以探讨胃癌的发生机制并寻求新的治疗靶点.
MKN-45细胞系、MGC-803细胞系来自中国医科大学细胞生物教研室, 5-氮杂-2'-脱氧胞苷(5-Aza-dC)及Trichostatin A(TSA)为Sigma产品, 总RNA抽提试剂TRIzol购自Invitrogen公司, RT-PCR试剂盒购自Promega公司, RPMI 1640培养基为Hyclone产品, Taq酶及dNTP均为TaKaRa产品, Wizard DNA Clean-up(Promega公司).
细胞接种于含10 mL/L小牛血清(56℃灭活30 min)、100×103 U/L青霉素及100×103 U/L链霉素的pH7.2的RPMI 1640培养液中, 在37℃、含50 mL/L CO2的湿润空气的恒温密闭式培养箱中培养. 实验时细胞处于对数生长期, 活细胞数达95%-100%. 对照组为同期培养不加药的胃癌细胞; 实验组: (1)5-Aza-dC组: 加5 μmol/L 5-Aza-dC培养72 h; (2)TSA组: 加TSA 300 nmol/L培养24 h; (3)联合组: 加5 μmol/L 5-Aza-dC 培养48 h后加TSA 300 nmol/L继续培养24 h.
1.2.1 RT-PCR分析p16及hMLH-1基因MRNA的表达: 用TRIzol试剂提取各组MKN-45细胞及MGC-803细胞总RNA, 用逆转录酶和Oliga(dT)20引物合成cDNA. p16及hMLH-1基因引物由上海博亚生物公司合成(表1), 以GAPDH为内参. PCR反应条件: 94℃ 3 min预变性后开始35个循环: 94℃ 30 s、54℃ 30 s, 72℃ 45 s, 最后于72℃延伸10 min. 扩增完毕在20 g/L琼脂糖凝胶上电泳分离, EB染色, 使用凝胶成像分析系统检测积分吸光度值, 将各基因与GAPDH吸光度比值作为其mRNA水平的相对值. 每种细胞每个基因至少重复实验3次, mRNA表达水平取其平均值进行统计分析.
| 基因 | 正向引物顺序(5'-3') | 反向引物顺序(5'-3') | 产物大小(bp) | 退火温度(℃) | 循环次数 |
| p16 | CAACGCACCGAATAGTTACGG | GCGCAGTTGGGCTCCG | 105 | 55 | 38 |
| hMLH-1 | AGTGGCTGGACAGAGGAAGA | GATCAGGCAGGTTAGCAAGC | 463 | 55 | 38 |
| GAPDH | CCATGTTCGTCATGGGTGTGAACCA | GCCAGTAGAGCAGGGATGATG | 251 | 55 | 38 |
1.2.2 甲基化特异性PCR(MSP)分析p16及hMLH-1基因甲基化: 蛋白酶K-苯酚抽取法从细胞中抽取总DNA, 紫外分光光度计检测DNA量和纯度, 琼脂糖凝胶电泳检测DNA完整性. 稀释2 μg DNA于50 μL水中, 加入NaOH, 42℃变性30 min后, 加入新鲜配置的亚硫酸氢钠和氢醌及石蜡油覆盖均匀, 55℃水浴16 h. 用DNA纯化试剂盒纯化(按说明书步骤)后将DNA重悬于50 μL水中, 再加入NaOH, 37℃水浴15 min, 然后用NaAc、无水乙醇沉淀回收DNA, 干燥, 并重悬于50 μL水中, -20℃用箔包裹保存. 采用甲基化特异性PCR扩增的方法, PCR反应条件(以p16为例): 94℃ 5 min预变性后开始35个循环: 95℃30 s、57℃ 30 s、72℃ 60 s, 最后于72℃延伸10 min. 扩增完毕在20 g/L琼脂糖凝胶电泳分离, EB染色, 使用凝胶成像分析系统分析电泳结果. p16及hMLH-1基因甲基化及非甲基化引物序列及产物大小(表2).
| 基因 | 正向引物顺序(5'-3') | 反向引物顺序(5'-3') | 产物大小(bp) | 退火温度(℃) | 循环次数 |
| p16 | M TTATTAGAGGGTGGGGCGGATCGC | GACCCCGAACCGCGACCGTAA | 150 | 60 | 35 |
| U TTATTAGAGGGTGGGGTGGATTGT | CAACCCCAAACCACAACCATAA | 151 | 60 | 35 | |
| hMLH-1 | M GATAGCGATTTTTAACGC | TCTATAAATTACTAAATCTCTTCG | 74 | 52 | 35 |
| U AGAGTGGATAGTGATTTTTAATGT | ACTCTATAAATTACTAAATCTCTTCA | 115 | 52 | 35 |
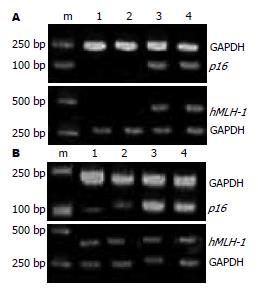
p16基因在MGC-803细胞中无表达, 经TSA作用后无表达, 5-Aza-dC及联合作用后有较强表达(相对值为0.413, 0.546); 在MKN-45细胞中有很弱表达(相对值0.16), 经TSA, 5-Aza-dC及联合作用后有不同程度表达(相对值为0.174, 0.876, 0.858).
hMLH-1基因在MGC-803中无表达, 经TSA作用后仍无表达, 5-Aza-dC及联合作用后有较强表(相对值为0.89, 0.91); 在MKN-45细胞中有很弱表达(相对值1.21), 经TSA, 5-Aza-dC及联合作用后有不同程度表达(相对值为1.1, 1.22, 1.23).
总之, p16基因及hMLH-1基因在MGC-803中不表达, 而在MKN-45细胞中弱表达. 5-Aza-dC能使MGC-803和MKN-45细胞中沉默的p16基因的重新表达, TSA对基因表达无明显影响, 5-Aza-dC及TSA联合应用与5-Aza-dC单独效果相似. 对于hMLH-1基因在MGC-803细胞中TSA对基因表达无影响, 5-Aza-dC及联合作用后能使其重新表达. 但是, 在MKN-45细胞中TSA、5-Aza-dC及联合作用均对hMLH-1基因的表达无影响(图1).
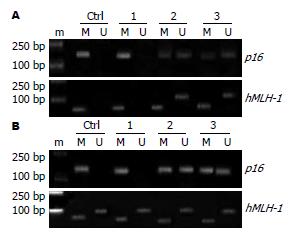
以研究对象基因组DNA模板, 经MSP扩增后, 无甲基化条带而出现非甲基化条带, 判定为非甲基化; 无非甲基化条带而出现甲基化条带, 判定为甲基化; 甲基化条带和非甲基化条带同时出现, 判定为半甲基化(图2). (1)在MGC-803和MKN-45细胞中, p16基因启动子区CpG岛表现为甲基化, 在MGC-803和MKN-45细胞中, 应用5-Aza-dC能使hMLH-1基因启动子区CpG岛发生去甲基化. 联合给予5-Aza-dC及TSA的作用和单独给予5-Aza-dC相似, 而TSA不影响p16基因DNA甲基化. (2)在MGC-803细胞中, hMLH-1基因启动子区CpG岛表现为甲基化(仅出现甲基化条带), 在MKN-45细胞中表现为半甲基化(同时出现甲基化和非甲基化条带). 在MGC-803细胞中, 应用5-Aza-dC能使hMLH-1基因启动子区CpG岛发生半甲基化(出现甲基化及非甲基化条带). 在MKN-45中, 药物对DNA甲基化无影响.
近几年, 表遗传学改变的研究取得了长足进展, 成为胃肠癌临床基础研究的一个热点领域. 表遗传学是研究非DNA序列变化引起的, 可遗传的基因表达的改变. 表遗传学的研究对象不是基因组核苷酸序列所携带的遗传信息, 而是研究基因表达在时间和空间上的调控问题, 包括DNA甲基化、组蛋白修饰、基因组印迹、染色体重塑、基因表达重新编程及X染色体失活等, 其中最主要的两个研究内容是DNA甲基化和组蛋白乙酰化[10].
DNA甲基化修饰是脊椎动物唯一的DNA 自然修饰方式, DNA甲基化是指在DNA甲基转移酶(DNA methyltransferase, Dnmt)的作用下, 以S-腺苷甲硫氨酸(SAM)为甲基供体, 将甲基基团转移到胞嘧啶和鸟嘌呤(CpG)二核苷酸的胞嘧啶中5位碳原子上并与其3'端的鸟嘌呤形成mCpG, 且在双链对称出现. 癌基因多为不充分甲基化, 导致重新开放或异常表达; 抑癌基因多为过度甲基化, 从而表达受抑制[11].
组蛋白乙酰化及其逆过程, 分别由组蛋白乙酰基转移酶(HAT)及去乙酰化转移酶(HDAC)催化的, HAT可将乙酰辅酶A的乙酰基部分转移到核心组蛋白氨基末端特定的赖氨酸残基, 中和其正电荷, 使核小体DNA易于接近转录因子. 许多研究已证实了组蛋白高/低乙酰化在肿瘤发生中起重要作用: 组蛋白的乙酰化促进基因转录, 而去乙酰化抑制基因转录[12].
本实验证实胃癌细胞株MGC-803及MKN-45中导致p16基因和hMLH-1基因沉默得主要原因为DNA甲基化, 应用5-Aza-dC作用于MSP方法证实p16, hMLH-1基因存在甲基化的MGC-803细胞和MKN-45细胞, 发现该药物能成功逆转两基因启动子得甲基化状态, 使该基因得以重新表达, TSA组效果较差, 联合用药组得效果与5-Aza-dC效果相似.
本实验应用的干预药物5-Aza-dC是一种嘧啶类药物, 应用与治疗复发性, 顽固性白血病和慢性髓性白血病危象有明显疗效, 但在实体瘤中作用尚不清楚. 制滴霉素A(TSA)是一种非特异性HDAC抑制剂, Suzuki et al[13]应用TSA(500 μg/L)加入到八个胃癌细胞系中, 发现TSA可以明显抑制全部胃癌细胞系的生长, 并且可以诱导胃癌细胞的凋亡. Cameron et al[14]在结肠癌细胞系的研究中显示: 对p16, TIMP-3, p15和hMLH-1基因启动子过度甲基化的结肠癌细胞, 单用HDAC抑制剂无法使失活的基因重新表达, 但如果先用小剂量的DNA甲基化抑制剂处理使基因获得轻度的重新表达, 再用HDAC抑制剂处理后, 则可使结肠癌细胞基因重新表达显著增强, 提示组蛋白的脱乙酰化和DNA的高甲基化共存于基因失活的过程之中. Shaker et al[15]将HDAC的抑制剂与5-Aza-dC连用, 降低剂量来减少5-Aza-dC的毒副作用, 并达到协同增效作用. 但DNA的高甲基化在导致这些基因失活中可能扮演主导作用.
总之, 肿瘤发病机制不仅体现在基因突变或缺失而导致的遗传学改变, 还体现在以DNA甲基化为代表的表遗传学改变, 深入研究DNA甲基化与基因表达的关系及作用机制为胃癌的早期诊断及去甲基化治疗提供了新的思路.
胃癌是一种严重威胁人类健康的恶性肿瘤, 在我国死亡率居恶性肿瘤的首位, 约50%的胃癌患者确诊时已属晚期, 癌细胞的转移是影响疗效的主要因素. 国内外大量的资料显示, 胃癌的发生与其他恶性肿瘤一样是多基因、多阶段变异累积形成的病理过程. 近来, 在肿瘤学研究发现启动子区高甲基化异常是导致许多肿瘤抑制基因表达异常的内在机制, 癌基因的激活和抑癌基因的失活为其中两个重要的分子事件. 目前, 普遍认为DNA甲基化除缺失与突变之外导致基因失活的第三种机制, 在肿瘤的发生发展起着不可忽视的作用. 由于高甲基化而不表达的抑癌基因, 如果能应用去甲基化制剂逆转甲基化异常状态, 使之重新表达, 理论上即可发挥起抑制肿瘤生长的功能.
熊斌, 教授, 武汉大学中南医院肿瘤科
肿瘤的发生常常涉及多个抑癌基因的失活, 针对单一基因的治疗不足以抑制肿瘤生长, 去乙酰化酶或甲基化抑制剂针对于整个基因组而不是特定的基因, 可同时恢复多个抑癌基因的表达, 并降低基因突变的发生率, 提高基因组稳定性, 可成为药物开发提供新的靶点, 将表遗传学药物与基因药物联用将为肿瘤治疗的治疗开辟新的领域.
胃癌相关抑制基因启动子CPG岛DNA甲基化与肿瘤抑癌基因沉默关系的研究, 揭示了胃癌相关抑癌基因失活的表遗传学机制, 此为国际生物学研究的热点之一. 体外研究5-Aza-dC及TSA调控和恢复沉默的胃癌相关抑制基因表达的情况, 为恶性肿瘤的防治提供新的靶点, 为两药物的胃癌的临床应用提供实验依据.
检测特定基因甲基化状态可为胃癌早期筛查、发现残余病灶、判断是否转移及预后提供帮助. 目前, 去甲基化诊断治疗成为全世界肿瘤研究的热点, 为攻克肿瘤这一顽疾提供新的思路, 但迄今为止, 用于胃癌甲基化标记物的基因还很少, 某些机制尚未明确, 仍需进一步研究.
1 DNA甲基化: 指在DNA甲基转移酶(Dnmt)的作用下, 以S-腺苷甲硫氨酸(SAM)为甲基供体, 将甲基基团转移到胞嘧啶和鸟嘌呤(CpG)二核苷酸的胞嘧啶中5位碳原子上并与其3'端的鸟嘌呤形成mCpG,且在双链对称出现. 癌基因多为不充分甲基化, 导致重新开放或异常表达; 抑癌基因多为过度甲基化, 从而表达受抑制. 2 组蛋白乙酰化: 是可逆的动态过程, 组蛋白乙酰基转移酶(HAT)将乙酰辅酶A(乙酰CoA)乙酰基部分转移到核心组蛋白氨基末端上特定Lys残基的-氨基基团. 氨基上的正电荷被消除, 这时DNA分子本身所带有的负电荷有利于DNA构象的展开, 核小体的结构变得松弛. 这种松弛的结构促进了转录因子和协同转录因子与DNA分子的接触, 因此组蛋白乙酰化可以激活特定基因的转录过程.
本研究设计合理, 研究方法可靠, 结果和结论可信, 有一定的学术价值和临床应用价值.
编辑: 李军亮 电编:郭海丽
| 1. | Song SH, Jong HS, Choi HH, Inoue H, Tanabe T, Kim NK, Bang YJ. Transcriptional silencing of Cyclooxygenase-2 by hyper-methylation of the 5' CpG island in human gastric carcinoma cells. Cancer Res. 2001;61:4628-4635. [PubMed] |
| 2. | Nakajima T, Maekita T, Oda I, Gotoda T, Yamamoto S, Umemura S, Ichinose M, Sugimura T, Ushijima T, Saito D. Higher methylation levels in gastric mucosae significantly correlate with higher risk of gastric cancers. Cancer Epidemiol Biomarkers Prev. 2006;15:2317-2321. [PubMed] [DOI] |
| 3. | Li M, Liu W, Zhu YF, Chen YL, Zhang BZ, Wang R. Correlation of COX-2 and K-ras expression to clinical outcome in gastric cancer. Acta Oncol. 2006;45:1115-1119. [PubMed] [DOI] |
| 4. | Tang LP, Cho CH, Hui WM, Huang C, Chu KM, Xia HH, Lam SK, Rashid A, Wong BC, Chan AO. An inverse correlation between Interleukin-6 and select gene promoter methylation in patients with gastric cancer. Digestion. 2006;74:85-90. [PubMed] [DOI] |
| 5. | Ma B, Zhao JS, Ding DY. Application of proteomics in the research of discrepancy proteins in gastric cancer. Zhonghua Weichang Waike Zazhi. 2006;9:534-537. [PubMed] |
| 7. | Lee TL, Leung WK, Chan MW, Ng EK, Tong JH, Lo KW, Chung SC, Sung JJ, To KF. Detection of gene promoter hypermethylation in the tumor and serum of patients with gastric carcinoma. Clin Cancer Res. 2002;8:1761-1766. [PubMed] |
| 8. | Song SH, Jong HS, Choi HH, Kang SH, Ryu MH, Kim NK, Kim WH, Bang YJ. Methylation of specific CpG sites in the promoter region could significantly down-regulate p16(INK4a) expression in gastric adenocarcinoma. Int J Cancer. 2000;87:236-240. [PubMed] [DOI] |
| 9. | Kondo Y, Shen L, Issa JP. Critical role of histone methylation in tumor suppressor gene silencing in colorectal cancer. Mol Cell Biol. 2003;23:206-215. [PubMed] [DOI] |
| 12. | Linggi BE, Brandt SJ, Sun ZW, Hiebert SW. Translating the histone code into leukemia. J Cell Biochem. 2005;96:938-950. [PubMed] [DOI] |
| 13. | Suzuki T, Yokozaki H, Kuniyasu H, Hayashi K, Naka K, Ono S, Ishikawa T, Tahara E, Yasui W. Effect of trichostatin A on cell growth and expression of cell cycle- and apoptosis-related molecules in human gastric and oral carcinoma cell lines. Int J Cancer. 2000;88:992-997. [PubMed] [DOI] |
| 14. | Cameron EE, Bachman KE, Myohanen S, Herman JG, Baylin SB. Synergy of demethylation and histone deacetylase inhibition in the re-expression of genes silenced in cancer. Nat Genet. 1999;21:103-107. [PubMed] [DOI] |
| 15. | Shaker S, Bernstein M, Momparler LF, Momparler RL. Preclinical evaluation of antineoplastic activity of inhibitors of DNA methylation (5-aza-2'-deoxycytidine) and histone deacetylation (trichostatin A, depsipeptide) in combination against myeloid leukemic cells. Leuk Res. 2003;27:437-444. [PubMed] [DOI] |