修回日期: 2008-04-01
接受日期: 2008-05-04
在线出版日期: 2008-06-08
目的: 检测趋化因子受体CCR7在结直肠癌中的表达状态, 探讨CCR7在结直肠癌发病中的作用.
方法: 采用免疫组化检测标本中CCR7蛋白表达, 逆转录PCR(RT-PCR)检测CCR7 mRNA表达, Western blotting检测结肠癌细胞CCR7蛋白表达.
结果: 45例结直肠癌组织标本检出CCR7 mRNA表达, 而其相应的癌旁组织中12例检出(χ2 = 34.44, P<0.01). 34例结直肠癌组织标本检出CCR7蛋白表达, 其相应的癌旁组织中, 则有6例检出 (χ2 = 28.51, P<0.01). 结肠癌细胞SW-480中CCR7 mRNA和蛋白表达显著, 而在HT-29中表达较弱.
结论: CCR7参与结直肠癌的发病过程, 其表达与结直肠癌转移有关.
引文著录: 张义侠, 赵成海, 张海鹏. 趋化因子受体CCR7在结直肠癌中的异常表达. 世界华人消化杂志 2008; 16(16): 1828-1831
Revised: April 1, 2008
Accepted: May 4, 2008
Published online: June 8, 2008
AIM: To determine expression level of chemokine receptor 7 (CCR7) and explore its role in colorectal tumor pathogenesis.
METHODS: Immunohistochemistry was used to detect CCR7 protein in specimens. Expression of CCR7 mRNA was determined using reverse transcription PCR (RT-PCR). And Western blotting was used to detect CCR7 protein in colon cancer cells.
RESULTS: CCR7 mRNA expression was found in 45 colorectal cancer specimens and 12 cancer-adjacent normal tissues (χ2 = 34.44, P < 0.01). CCR7 protein expression was found in 34 colorectal cancer specimens and 6 cancer-adjacent normal tissues (χ2 = 28.51, P < 0.01). CCR7 mRNA and protein were expressed highly in colon cancer cell line SW-480, but lowly in HT-29.
CONCLUSION: CCR7 is involved in colorectal cancer pathogenesis and its expression in metastasis.
- Citation: Zhang YX, Zhao CH, Zhang HP. Aberrant expression of chemokine receptor 7 in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1828-1831
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1828.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1828
趋化因子受体是7次跨膜受体, 其家族根据氨基酸序列可分为4种类型, 即CR, CCR, CXCR和CX3CR. 由于白细胞表面能够表达趋化因子受体, 因此在趋化因子的作用下, 白细胞可发生定向的趋化运动, 参与炎症的发展过程. 近些年研究发现, 肿瘤细胞表面可表达趋化因子受体. 这些肿瘤细胞在部分趋化物质的作用下, 可出现定向的趋化运动, 并导致肿瘤出现转移. 目前研究显示趋化因子受体CXCR4[1-4]和CCR7[5-8]在多种肿瘤中存在过度表达, 表明这些趋化因子受体参与了肿瘤的发生发展过程[9]. 本文对结直肠癌中CCR7的表达情况进行检测, 并对其与结直肠癌临床特征之间的相关性进行分析, 以探讨CCR7在结直肠癌发病机制中的作用.
结直肠癌及相应的癌旁正常组织标本各64例, 均来自于中国医科大学附属第一医院. 标本获取后即冷冻于液氮之中, 并保存在-80℃条件下备用. 采用HE染色确定肿瘤标本主要由肿瘤组织构成, 癌旁正常组织没有肿瘤细胞浸润. 人类结肠癌细胞系SW-480和HT-29购自于南京凯基(KeyGen)生物科技发展公司, 培养于RPMI 1640培养基中, 其中含有100 mL/L胎牛血清, 青霉素 (1×105 IU/L)及链霉素(100 mg/L), 于37℃下置于含有50 mL/L CO2的培养箱中.
1.2.1 RNA提取和逆转录PCR反应: 采用RNAiso试剂(TaKaRa公司)进行RNA提取, 具体步骤参照其说明书进行. 采用随机9引物和AMV逆转录酶进行逆转录反应. 反应体系共10 μL, 逆转录反应条件: 30℃ 10 min; 42℃ 25 min; 99℃ 5 min; 5℃ 5 min, 共1个循环. PCR总反应体系40 μL, 反应条件为: 94℃ 2 min, 1个循环. 94℃ 30 s; 60℃ 30 s; 72℃ 2 min, 共30个循环. CCR7基因引物序列参照文献[10].
1.2.2 免疫组化染色: 冰冻切片在室温下风扇吹干. 采用40 g/L多聚甲醛固定30 min. 3% H2O2 1份加纯甲醇50份混合, 室温浸泡30 min, 以灭活内源性过氧化物酶. 滴加50 g/L BSA封闭液, 室温下20 min. 滴加多克隆CCR7抗体(武汉博士得公司), 20℃下2 h. 滴加生物素化山羊抗小鼠IgG, 20-37℃下20 min. 滴加试剂SABC, 20-37℃下20 min. DAB显色, 苏木素轻度复染, 脱水, 透明, 封片, 显微镜观察.
1.2.3 Western blot: 使用裂解液裂解细胞, 收集样品蛋白. 取蛋白20 μg, 加入适量浓缩的SDS-PAGE蛋白上样缓冲液, 沸水浴加热3-5 min, 以充分变性蛋白. 冷却到室温后, 把蛋白样品直接上样到SDS-PAGE胶加样孔内, 进行凝胶电泳. 常规转膜. 将膜洗涤后, 用真空泵吸净洗涤液. 加入封闭液, 4℃过夜. 按1:1000稀释CCR7多克隆抗体. 用真空泵吸净封闭液, 加入一抗. 4℃孵育过夜. 按1:1000稀释加辣根过氧化物酶标记兔抗羊Ⅱ抗. 吸净洗涤液以后, 加入二抗, 4℃孵育1 h.
统计学处理 肿瘤组织与瘤旁正常组织之间比较采用卡方检验, CCR7蛋白表达与患者临床病理特征之间的相关性采用Fisher's exact检验分析. P<0.05为有显著性差异.
采用RT-PCR技术对肿瘤标本和癌旁正常组织标本CCR7 mRNA表达情况进行检测, 在64例结直肠癌组织标本中, 有45例(70.3%)检出CCR7 mRNA表达. 在其相应的癌旁组织中, 则有12例(18.8%)检出CCR7 mRNA表达, 两者差异显著(χ2 = 34.44, P<0.01). 采用免疫组织化学技术对肿瘤标本和癌旁正常组织标本CCR7蛋白表达情况进行检测, 显示在64例结直肠癌组织标本中, 有34例(53.1%)检出CCR7蛋白表达. 在其相应的癌旁组织中, 则有6例(9.4%)检出CCR7蛋白表达, 两者差异显著(χ2 = 28.51, P<0.01).
采用Fisher's检验, 我们对CCR7表达与结直肠癌患者的临床病理特征之间的相关性进行分析. 按诊断时年龄进行年龄分组: >50岁, <等于50岁; 肿瘤大小以直径>3 cm, ≤3 cm. 淋巴结转移状况按是否有转移进行分组. 在肿瘤分期上, T1和T2分为一组, T3和T4分为一组. 结果显示, CCR7表达与患者年龄、性别、肿瘤大小均无相关性, 而与肿瘤分期(P = 0.01)、淋巴结转移情况(P = 0.01)具有相关性(表1).
| 因素 | 分类 | n | CCR7(+) | P |
| 性别 | 男 | 38 | 20 | 0.2 |
| 女 | 26 | 14 | ||
| 年龄 | >50 | 42 | 22 | 0.21 |
| ≤50 | 22 | 12 | ||
| 分期 | T1与T2 | 30 | 11 | 0.01 |
| T3与T4 | 34 | 23 | ||
| 淋巴结 | N0 | 29 | 10 | 0.01 |
| 转移 | N1与N2 | 35 | 24 | |
| 肿瘤大小 | >3 cm | 36 | 18 | 0.17 |
| ≤3 cm | 28 | 16 |
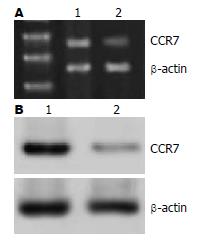
采用RT-PCR技术对结肠癌细胞系SW-480和HT-29 CCR7 mRNA表达情况进行检测. 结果显示在SW-480中CCR7 mRNA表达显著, 而在HT-29表达较弱(图1A). 采用Western blot技术对结肠癌细胞系SW-480和HT-29 CCR7蛋白表达情况进行检测. 结果显示在SW-480中CCR7蛋白表达显著, 而在HT-29表达较弱(图1B). CCR7蛋白表达结果与mRNA表达结果一致.
结直肠癌是人类常见的肿瘤之一, 在西方国家一直具有较高的发病率和致死率. 结直肠癌的发病主要与环境因素和遗传因素有关. 低叶酸盐、低蔬菜、高脂、高红肉饮食、吸烟、饮酒及缺乏运动等都是结直肠癌的风险因素. 近几年来, 随着研究的深入, 目前普遍认为绝大多数结直肠癌由腺瘤转化而来. 在腺瘤形成及向结直肠癌转化的过程中, 涉及到多重基因突变或表达改变, 其中包括抑癌基因失活和原癌基因激活等. 这些基因表达改变导致细胞增殖过度和凋亡减弱, 从而导致细胞出现失控性生长. 同时在研究中发现, 这些肿瘤细胞表面常常出现了部分趋化因子受体的过度表达, 提示这些趋化因子受体参与结直肠癌的发生发展过程.
趋化因子受体家族根据氨基酸序列可分为4种类型, 即CR, CCR, CXCR和CX3CR. 白细胞对某种特殊趋化因子的反应能力依赖于其细胞表面所表达的趋化因子受体. 在趋化因子受体作用下, 白细胞向趋化因子所在部位进行运动, 参与炎症的发展过程. 近些年研究发现, 肿瘤细胞表面亦可表达趋化因子受体, 这些受体包括CXCR4[9-12]、CCR7[13]、CXCR3[14-15]、CCR10[16]、CCR9[17-18]、CCR4[19]和CCR3[20]等. 其中CXCR4的研究最为广泛, 其已被发现参与20多种肿瘤的发病过程. 研究显示CCL21(CCR7配体)和CXCL12(CXCR4配体)在淋巴结、肺和肝脏等组织中高度表达, 故表达CCR7和CXCR4的肿瘤常常转移到这些部位.
由于趋化因子受体在结直肠癌发病中的作用, 目前仍缺乏足够的研究. 我们对CCR7在结直肠癌中的表达情况进行研究. RT-PCR检测结果显示在64例结直肠癌组织标本中, 70.3%检出CCR7 mRNA表达. 而在其相应的癌旁组织中, 则有18.8%检出CCR7 mRNA表达. CCR7在结直肠癌组织中的表达频率显著高于癌旁正常组织. 免疫组织化学检测结果显示在64例结直肠癌组织标本中, 有53.1%检出CCR7蛋白表达. 在其相应的癌旁组织中, 则只有9.4%检出CCR7蛋白表达, 两者差异亦显著. 在对结肠癌细胞系的检测中亦发现存在CCR7表达. 以上结果提示CCR7参与了结直肠癌的发病过程. 采用Fisher's检验, 我们对CCR7表达与结直肠癌患者的临床病理特征之间的相关性进行分析. 结果显示, CCR7表达与患者年龄、性别、肿瘤大小均无相关性, 而与肿瘤分期和淋巴结转移情况具有明显相关性. 结果提示CCR7在结直肠癌中的表达参与其转移过程.
近年研究发现, 肿瘤细胞表面可表达趋化因子受体. 肿瘤细胞在部分趋化物质的作用下, 可出现定向的趋化运动, 并导致肿瘤出现转移.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
本文检测结直肠癌中CCR7的表达情况, 并对其与结直肠癌临床特征之间的相关性进行了分析.
本研究提示CCR7在结直肠癌发生及转移中起到一定的作用, 对这部分肿瘤的基因治疗提供帮助.
本文探讨趋化因子受体CCR在结直肠癌中的异常表达, 内容新颖, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Kodama J, Hasengaowa , Seki N, Kusumoto T, Hiramatsu Y. Expression of the CXCR4 and CCR7 chemokine receptors in human endometrial cancer. Eur J Gynaecol Oncol. 2007;28:370-375. [PubMed] |
| 2. | Zeelenberg IS, Ruuls-Van Stalle L, Roos E. The chemokine receptor CXCR4 is required for outgrowth of colon carcinoma micrometastases. Cancer Res. 2003;63:3833-3839. [PubMed] |
| 3. | Yasumoto K, Koizumi K, Kawashima A, Saitoh Y, Arita Y, Shinohara K, Minami T, Nakayama T, Sakurai H, Takahashi Y. Role of the CXCL12/CXCR4 axis in peritoneal carcinomatosis of gastric cancer. Cancer Res. 2006;66:2181-2187. [PubMed] [DOI] |
| 4. | Pan J, Mestas J, Burdick MD, Phillips RJ, Thomas GV, Reckamp K, Belperio JA, Strieter RM. Stromal derived factor-1 (SDF-1/CXCL12) and CXCR4 in renal cell carcinoma metastasis. Mol Cancer. 2006;5:56. [PubMed] [DOI] |
| 5. | Ishigami S, Natsugoe S, Nakajo A, Tokuda K, Uenosono Y, Arigami T, Matsumoto M, Okumura H, Hokita S, Aikou T. Prognostic value of CCR7 expression in gastric cancer. Hepatogastroenterology. 2007;54:1025-1028. [PubMed] |
| 6. | Mashino K, Sadanaga N, Yamaguchi H, Tanaka F, Ohta M, Shibuta K, Inoue H, Mori M. Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma. Cancer Res. 2002;62:2937-2941. [PubMed] |
| 7. | Wilson JL, Burchell J, Grimshaw MJ. Endothelins induce CCR7 expression by breast tumor cells via endothelin receptor A and hypoxia-inducible factor-1. Cancer Res. 2006;66:11802-11807. [PubMed] [DOI] |
| 8. | Heresi GA, Wang J, Taichman R, Chirinos JA, Regalado JJ, Lichtstein DM, Rosenblatt JD. Expression of the chemokine receptor CCR7 in prostate cancer presenting with generalized lymphadenopathy: report of a case, review of the literature, and analysis of chemokine receptor expression. Urol Oncol. 2005;23:261-267. [PubMed] [DOI] |
| 9. | Engl T, Relja B, Marian D, Blumenberg C, Müller I, Beecken WD, Jones J, Ringel EM, Bereiter-Hahn J, Jonas D. CXCR4 chemokine receptor mediates prostate tumor cell adhesion through alpha5 and beta3 integrins. Neoplasia. 2006;8:290-301. [PubMed] [DOI] |
| 10. | Rubie C, Frick VO, Wagner M, Weber C, Kruse B, Kempf K, König J, Rau B, Schilling M. Chemokine expression in hepatocellular carcinoma versus colorectal liver metastases. World J Gastroenterol. 2006;12:6627-6633. [PubMed] |
| 11. | Salvucci O, Bouchard A, Baccarelli A, Deschênes J, Sauter G, Simon R, Bianchi R, Basik M. The role of CXCR4 receptor expression in breast cancer: a large tissue microarray study. Breast Cancer Res Treat. 2006;97:275-283. [PubMed] [DOI] |
| 12. | Scala S, Ottaiano A, Ascierto PA, Cavalli M, Simeone E, Giuliano P, Napolitano M, Franco R, Botti G, Castello G. Expression of CXCR4 predicts poor prognosis in patients with malignant melanoma. Clin Cancer Res. 2005;11:1835-1841. [PubMed] [DOI] |
| 13. | Mori T, Kim J, Yamano T, Takeuchi H, Huang S, Umetani N, Koyanagi K, Hoon DS. Epigenetic up-regulation of C-C chemokine receptor 7 and C-X-C chemokine receptor 4 expression in melanoma cells. Cancer Res. 2005;65:1800-1807. [PubMed] [DOI] |
| 14. | Kawada K, Hosogi H, Sonoshita M, Sakashita H, Manabe T, Shimahara Y, Sakai Y, Takabayashi A, Oshima M, Taketo MM. Chemokine receptor CXCR3 promotes colon cancer metastasis to lymph nodes. Oncogene. 2007;26:4679-4688. [PubMed] [DOI] |
| 15. | Ocaña E, Delgado-Pérez L, Campos-Caro A, Muñóz J, Paz A, Franco R, Brieva JA. The prognostic role of CXCR3 expression by chronic lymphocytic leukemia B cells. Haematologica. 2007;92:349-356. [PubMed] [DOI] |
| 16. | Notohamiprodjo M, Segerer S, Huss R, Hildebrandt B, Soler D, Djafarzadeh R, Buck W, Nelson PJ, von Luettichau I. CCR10 is expressed in cutaneous T-cell lymphoma. Int J Cancer. 2005;115:641-647. [PubMed] [DOI] |
| 17. | Singh S, Singh UP, Stiles JK, Grizzle WE, Lillard JW Jr. Expression and functional role of CCR9 in prostate cancer cell migration and invasion. Clin Cancer Res. 2004;10:8743-8750. [PubMed] [DOI] |
| 18. | Letsch A, Keilholz U, Schadendorf D, Assfalg G, Asemissen AM, Thiel E, Scheibenbogen C. Functional CCR9 expression is associated with small intestinal metastasis. J Invest Dermatol. 2004;122:685-690. [PubMed] [DOI] |
| 19. | Ishida T, Ishii T, Inagaki A, Yano H, Kusumoto S, Ri M, Komatsu H, Iida S, Inagaki H, Ueda R. The CCR4 as a novel-specific molecular target for immunotherapy in Hodgkin lymphoma. Leukemia. 2006;20:2162-2168. [PubMed] [DOI] |
| 20. | Jöhrer K, Zelle-Rieser C, Perathoner A, Moser P, Hager M, Ramoner R, Gander H, Höltl L, Bartsch G, Greil R. Up-regulation of functional chemokine receptor CCR3 in human renal cell carcinoma. Clin Cancer Res. 2005;11:2459-2465. [PubMed] [DOI] |