修回日期: 2008-04-25
接受日期: 2008-05-24
在线出版日期: 2008-06-08
目的: 分析新凋亡促进因子-程序化细胞死亡分子5(programmed cell death 5, PDCD5)在肝细胞癌(hepatocellular carcinoma, HCC)发生发展中的作用.
方法: 用免疫组织化学法(immunohisto-chemistry, IHC)检测40例HCC及其癌旁组织(包括24例肝硬化和16例慢性肝炎)中的PDCD5和Fas蛋白表达. 用等级资料Kruskal-Wallis H检验方法进行统计学分析, 并用Spearman's等级资料的相关分析比较PDCD5和Fas的表达差异.
结果: PDCD5在肝癌组织中多呈阴性表达, 在癌旁肝组织中表达增加. 肝癌及其癌旁肝硬化肝炎各组间PDCD5表达具有显著性差异(χ2 = 46.03, P = 0.000). Fas在肝癌组织及其癌旁肝硬化或慢性肝炎组织中的表达分布与PDCD5相似, 各组间Fas表达有显著性差异(χ2 = 24.45 P = 0.000). PDCD5与Fas的相关性分析结果显示, 两者呈正相关(r = 0.839, P = 0.001).
结论: PDCD5是HCC发生、发展过程中的一个重要凋亡调控因子.
引文著录: 余康康, 刘顺爱, 李文凡, 沈冰, 兰孟东, 郎振为, 成军. 促凋亡因子PDCD5与Fas在肝癌及其癌旁组织中的表达. 世界华人消化杂志 2008; 16(16): 1820-1824
Revised: April 25, 2008
Accepted: May 24, 2008
Published online: June 8, 2008
AIM: To investigate expression of programmed cell death 5 (PDCD5) and Fas in hepatocellular carcinoma (HCC) tissues and its adjacent tissues and liver cirrhosis tissues and thereby to explore relationship between PDCD5 and HCC.
METHODS: Protein expression of PDCD5 and Fas from 40 HCC and its adjacent tissues (including 24 cases of liver cirrhosis, 16 cases of chronic liver hepatitis) were analyzed using immunohistochemistry. Positive protein expression rates and intensity of PDCD5 and Fas were investigated under microscopy. Statistics were analyzed using Kruskal-Wallis H test and Spearman's Rank correlation coefficient.
RESULTS: There was PDCD5 negative expression in HCC and raised expression rate in HCC adjacent tissues. There were significant difference in PDCD5 expression among HCC grpup, HCC adjacent tissue group and cirrhosis, chronic hepatitis group (χ2 = 46.03, P = 0.000). The same significance between HCC and cirrhosis or chronic hepatitis was detected for Fas expression (χ2 = 24.45, P = 0.000). Correlation analysis showed that PDCD5 was positively correlated with Fas (r = 0.839, P = 0.001).
CONCLUSION: PDCD5 is an important apoptosis-regulating factor in hepatocelluar carcinoma pathogenesis.
- Citation: Yu KK, Liu SA, Li WF, Shen B, Lan MD, Lang ZW, Cheng J. Elevated expression of PDCD5 and Fas in hepatocellular carcinoma and its adjacent tissues. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1820-1824
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1820.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1820
肝细胞肝癌(hepatocellular carcinoma, HCC)是我国发病率及死亡率均较高的恶性肿瘤, 其形成是一个多因素、多阶段长期相互作用的过程. 研究表明, 细胞凋亡与肝癌的发生发展密切相关. PDCD5是具有我国自主知识产权的凋亡相关新基因, 原名TFAR19(TF-1 cell apoptosis-related gene 19)[1], 后被国际人类基因命名委员会建议命名为PDCD5. PDCD5基因定位于染色体19q12-q13.1, cDNA全长为559 bp, 编码125个氨基酸. 多项研究表明, PDCD5分子在不同的种属之间高度保守, 提示他具有重要生物学功能的基因; PDCD5在人体多种组织中均有表达, 并促进多种细胞的凋亡. 目前已有报道PDCD5与多种疾病的发生发展相关[2-4], 尤其在肿瘤组织中PDCD5表达减弱[5-8], 但尚没有在大量肝炎、肝硬化及肝癌系列标本中的表达研究. 本文报道PDCD5和Fas在肝细胞癌及其癌旁组织中的表达, 通过PDCD5在其中的表达变化及其与Fas表达相关性分析, 拟阐明PDCD5在肝癌发生发展中的作用及意义.
2006-2007年北京地坛医院病理科肝癌组织标本40例, 其中包括高分化肝细胞癌4例; 中分化肝细胞癌26例; 低分化肝细胞癌10例. 癌旁组织是指离肝癌组织<1.5 cm的癌周围肝组织, 本文40例肝癌病例的癌旁组织包括肝硬化24例、慢性肝炎16例, 所有标本经过HE染色的病理诊断. 标本以蜡块形式保存, 实验前统一切成4 μm厚的连续石蜡切片. 小鼠抗人PDCD5 mAb由北京大学人类疾病基因研究中心提供; 小鼠抗人Fas mAb购自北京中杉金桥公司; 羊抗兔/鼠通用IgG-HRP和DAB显色液为DAKO公司产品.
免疫组织化学实验采用EnVision二步法, 具体操作步骤如下: 石蜡切片逐级脱蜡入水, PBS洗后3%过氧化氢室温孵育10 min以消除内源性过氧化物酶的活性; PBS洗后用高压修复法进行抗原修复(PDCD5为pH6.0枸橼酸, Fas为pH9.0 Tris/EDTA); PBS洗后滴加1:150稀释的抗PDCD5 mAb或1:50稀释的抗Fas抗体, 置湿盒内4℃孵育过夜; 第2天室温复温30 min并PBS洗后, 滴加EnVision抗体工作液, 置湿盒内37℃孵育30 min; PBS洗后滴加新鲜配置的DAB显色液显色, 自来水冲洗终止显色; 苏木素复染、封片之后显微镜下判定结果. 以上PBS洗涤均为5 min×3次; 每次实验设计阳性对照(已知阳性片)和阴性对照(PBS代替一抗). 每张片子分肿瘤部分及癌旁组织各随机取5个高倍视野, 每个视野计数100个细胞, 观察染色强度并计算阳性率. 结果按阳性细胞百分率(Y)分4级: Y = 0为0; 0<Y≤25%为1; 25%<Y≤50%为2; Y>50%为3, 按阳性细胞染色强度(X)分4级: 无染色细胞为0; 淡黄色为1; 棕黄色为2; 棕褐色为3. 把阳性细胞百分率Y分数和阳性细胞染色强度X分数相加后得出阳性积分, 积分0分为阴性(-); 2分为弱阳性(+); 3-4分为阳性(++); 5-6分为强阳性(+++).
统计学处理 采用SPSS13.0统计软件进行数据分析, 采用等级资料的Kruskal-Wallis H检验进行显著性分析, 采用Spearman等级相关分析进行相关性分析.
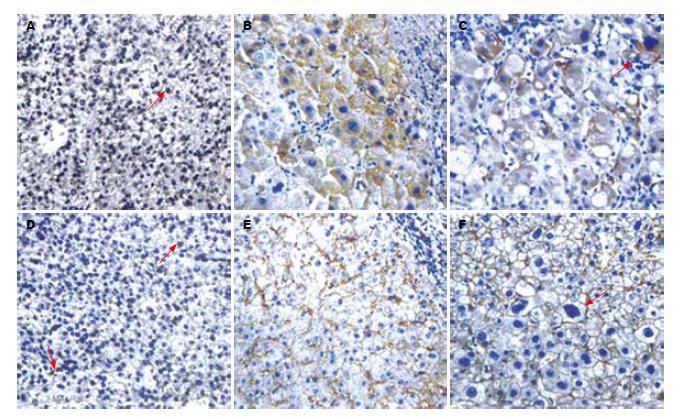
PDCD5的免疫组化结果显示, PDCD5在肝癌及癌旁肝硬化、肝炎组织中的肝细胞和部分浸润的淋巴细胞胞质内(在本文中淋巴细胞不算在结果之内), 阳性细胞以黄色、棕黄色及棕褐色细颗粒状均匀着色. PDCD5在肝癌组织中多呈阴性表达, 在癌旁肝组织中表达增加, 其中在癌旁肝炎组织中的表达细胞多呈均匀阳性, 而癌旁肝硬化组织多以假小叶为单位表达, 部分假小叶为均匀阳性, 而部分假小叶为全阴性. 肝癌细胞旁不典型性增生细胞(liver cell dysplasia LCD)-目前被认为是一种处于癌前不同演变阶段的异常增生的细胞群体, 其PDCD5呈点、灶状强表达. 各组织中的PDCD5表达见图1A-C. 各组织中的PDCD5表达数据见表1. 采用等级资料的Kruskal-Wallis H秩和检验统计结果表明, 各组间PDCD5表达具有显著性差异(χ2 = 46.03, P = 0.000), 并且, 任意两组间PDCD5表达均有统计学意义, 其中: 肝癌与肝硬化之间χ2 = 41.19, P = 0.000; 肝癌和肝炎之间χ2 = 21.95, P = 0.000; 肝硬化和肝炎之间χ2 = 7.76, P<0.005. 以上结果提示: PDCD5在肿瘤细胞中的表达相较于癌旁组织明显降低. 进一步分析不同分化程度肝癌组织中PDCD5表达, 表达阴性率分别为高分化肝癌75%(3/4); 中分化肝癌88%(23/26); 低分化肝癌100%(10/10), 显示随着肿瘤组织分化程度的降低PDCD5的表达也降低, 但没有统计学意义, 有可能与标本量不多有关.
| n | PDCD5 | Fas | |||||||
| 阴性 | 弱阳 | 阳性 | 强阳 | 阴性 | 弱阳 | 阳性 | 强阳 | ||
| 肝炎 | 16 | 4(25) | 2(12) | 7(44) | 3(19) | 5(31) | 5(31) | 4(25) | 2(13) |
| 肝硬化 | 24 | 1(4) | 0 | 10(42) | 13(54) | 3(13) | 2(8) | 11(46) | 8(33) |
| 肿瘤 | 40 | 36(90) | 0 | 3(7) | 1(3) | 30(75) | 2(5) | 5(13) | 3(7) |
Fas的免疫组化结果显示, Fas在肝癌及癌旁肝硬化、肝炎组织中的肝细胞和部分浸润的淋巴细胞细胞膜和胞质内, 以细胞膜表达为主, 阳性细胞呈现网格状(在本文中淋巴细胞不算在结果之内). Fas表达的分布特点与PDCD5类似, 癌旁肝硬化组织以假小叶为单位表达, 部分假小叶Fas呈比较较匀表达阳性, 部分假小叶Fas表达为全阴性. 各组织中的Fas表达见图1D-F. 等级资料的秩和检验统计结果表明, 各组间Fas表达有显著性差异(χ2 = 24.45 P = 0.000), 并且, 任一两组间比较均有统计学意义, 具体结果为: 肝癌和肝硬化之间χ2 = 22.58, P = 0.000; 肝癌与肝炎之间χ2 = 6.86, P = 0.009; 肝炎和肝硬化之间χ2 = 5.64, P = 0.017(表1).
肝癌及癌旁肝硬化、肝炎组织不同组间PDCD5与Fas表达Spearman等级相关分析结果显示, Spearman等级相关系数为r = 0.839, P = 0.001, PDCD5与Fas的表达之间存在正相关性.
随着人类基因组计划的完成, 目前我国在人类功能基因研究领域已经从大规模cDNA测序转向细胞水平的功能研究、疾病相关性研究、相互作用蛋白的研究及蛋白质组学研究等, 并已经获得一批具有源头创新的成果. 北京大学人类疾病基因研究中心重点开展细胞凋亡相关基因及新细胞因子基因的研究, 其中PDCD5是此中心克隆和研究的重要新基因[9]. 近几年的研究资料表明, PDCD5是一个重要的细胞凋亡正调控基因, 与多种疾病的发生发展相关, 有可能成为上述疾病的辅助诊断标志或治疗靶点[10].
原发性肝癌为我国常见恶性肿瘤之一, 其发生发展过程中, 凋亡起着至关重要的作用. 细胞凋亡与增殖之间的平衡失调, 是引起肿瘤形成的重要机制之一[11]. 凋亡不足, 清除携带变异基因的细胞减少并且在持续炎症环境下增生失调, 可以促使肿瘤的发生; 凋亡过度, 慢性凋亡的刺激因为引起组织频繁的再生也可诱发肿瘤; 另外, 肿瘤中免疫细胞凋亡增多也是肿瘤免疫逃避的机制之一[12-13]. 不同病因造成的肝炎引起肝细胞不断破坏和肝细胞异常增殖反复发生, 使肝脏病变由肝炎经肝硬化再向肝癌演变. 肝癌中的凋亡调控基因研究在阐明发病机制及寻找治疗靶点中具有重要意义. 目前, 已经清楚Fas介导的凋亡在急性肝炎病毒的清除、肝炎的慢性化、纤维化及癌变的发生、发展中起着至关重要的作用[14-18], Fas介导的细胞凋亡是清除肿瘤细胞的重要机制. 肝癌细胞上的Fas表达减少, 或sFas竞争性地与FasL结合, 阻断了Fas/FasL介导的细胞凋亡, 引起肝细胞凋亡耐受, 导致肝癌的发生. 我们在本文进行了新的促凋亡因子PDCD5和Fas在肝癌及其癌旁组织中的表达研究并进行了两者的比较分析.
我们的实验结果显示, PDCD5与Fas在肝癌及其癌旁组织中的表达类似, 两者在肝癌细胞中的表达与其癌旁肝细胞相比, 呈明显减弱甚至消失, 统计学结果显示两者呈正相关. 本次实验中同时观察到, 部分肝癌组织中浸润的淋巴细胞也表达PDCD5和Fas, 有可能PDCD5也参与肿瘤细胞诱导免疫细胞凋亡而逃避免疫清除. 在我们的结果中, LCD细胞的PDCD5表达与癌旁其他肝细胞相比有所不同. 一般, 癌旁肝炎、肝硬化多为片状阳性或弱阳性表达, 而LCD细胞上PDCD5阳性细胞数量减少, 但阳性信号增强, 呈点、灶状强表达. 虽然目前关于癌旁LCD是否为癌前病变仍有争议, 但至少由HBV病毒引起的LCD与肝癌的形成有密切关系[19-21]. LCD细胞显示PDCD5表达降低是否说明, 这些发生凋亡抑制的LCD细胞最终能发展为肿瘤细胞, 仍有待进一步证实. 总之, PDCD5有可能与Fas一样, 在肝炎-肝硬化-肝癌的发展演变中发挥重要作用.
我们除了进行肝癌及其癌旁组织中的PDCD5表达研究外, 已进一步进行了PDCD5在HBV感染后携带者、急性肝炎、慢性炎症、肝硬化、肝癌患者肝组织中的表达研究(未发表资料), 这些结果更有可能阐明PDCD5在肿瘤发生发展中的意义及其肝炎-肝硬化-肝癌演变的机制. 有关PDCD5在肝细胞中表达下调的机制有待进一步进行研究.
衷心感谢北京大学人类疾病基因研究中心马大龙教授及其他各位老师和北京地坛医院病理科各位工作人员给予本研究的大力支持.
程序化细胞死亡分子5(PDCD5), 是北京大学人类疾病基因研究中心于1998年克隆得到的新功能基因, 原名TFAR19.多项研究表明, PDCD5促进多种细胞的凋亡, 与多种疾病的发生发展相关, 尤其在肿瘤组织中PDCD5表达减弱. 本文进行肝癌组织及其癌旁组织中PDCD5表达变化研究, 拟阐明PDCD5在肝癌发生发展中的作用及意义.
范学工, 教授, 中南大学湘雅医院感染病科
肝细胞凋亡不仅与肿瘤的发生、发展有关, 而且与肿瘤的预后判定和治疗密切相关. PDCD5作为新的促凋亡因子, 其在肝细胞凋亡中所起作用及与其他凋亡相关基因的关系、以及能否作为新的肿瘤治疗靶点等, 是未来PDCD5的研究方向. PDCD5在肝癌的发病机制和肝癌生物治疗中的作用有待阐明.
已有报道PDCD5在髓性白血病、卵巢癌、宫颈癌、肾透明细胞癌和胃癌等肿瘤组织中表达均明显下调, 并随肿瘤的分化程度其表达递减.
本研究比较PDCD5及Fas在肝癌组织及其癌旁组织中的表达变化, 拟阐明肝癌的发病机制及PDCD5在其中的作用.
PDCD5可望成为辅助检测肝脏病理组织癌变的标志物, 并有可能成为判断肝癌的预后和生存时间的指标之一.
本文对临床医师了解PDCD5的功能及其病理学意义有一定意义, 但学术价值一般.
编辑: 李军亮 电编:何基才
| 1. | Liu H, Wang Y, Zhang Y, Song Q, Di C, Chen G, Tang J, Ma D. TFAR19, a novel apoptosis-related gene cloned from human leukemia cell line TF-1, could enhance apoptosis of some tumor cells induced by growth factor withdrawal. Biochem Biophys Res Commun. 1999;254:203-210. [PubMed] [DOI] |
| 2. | Spinola M, Meyer P, Kammerer S, Falvella FS, Boettger MB, Hoyal CR, Pignatiello C, Fischer R, Roth RB, Pastorino U. Association of the PDCD5 locus with lung cancer risk and prognosis in smokers. J Clin Oncol. 2006;24:1672-1678. [PubMed] [DOI] |
| 3. | Liu ZH, Zhang D, Li KM, Liao QP. Expression of PDCD5 in tissues of normal cervix, CIN I-III and cervical cancer. Beijing Daxue Xuebao. 2004;36:407-410. [PubMed] |
| 5. | 熊 林, 谭 万龙, 郁 兆存, 吴 元东, 黄 河, 赵 国志, 朱 文辉, 郑 少斌. TFAR19(PDCD5)蛋白在正常肾、肾透明细胞癌组织及正常膀胱、膀胱癌组织中的表达. 南方医科大学学报. 2006;26:805-809. |
| 6. | Yang YH, Zhao M, Li WM, Lu YY, Chen YY, Kang B, Lu YY. Expression of programmed cell death 5 gene involves in regulation of apoptosis in gastric tumor cells. Apoptosis. 2006;11:993-1001. [PubMed] [DOI] |
| 7. | Xu XR, Huang J, Xu ZG, Qian BZ, Zhu ZD, Yan Q, Cai T, Zhang X, Xiao HS, Qu J. Insight into hepatocellular carcinogenesis at transcriptome level by comparing gene expression profiles of hepatocellular carcinoma with those of corresponding noncancerous liver. Proc Natl Acad Sci U S A. 2001;98:15089-15094. [PubMed] [DOI] |
| 8. | Ruan GR, Qin YZ, Chen SS, Li JL, Ma X, Chang Y, Wang YZ, Fu JY, Liu YR. Abnormal expression of the programmed cell death 5 gene in acute and chronic myeloid leukemia. Leuk Res. 2006;30:1159-1165. [PubMed] [DOI] |
| 9. | 马 大龙. 我国人类功能基因研究进展. 北京大学学报(医学版). 2003;35:337-339. |
| 11. | Guicciardi ME, Gores GJ. Apoptosis: a mechanism of acute and chronic liver injury. Gut. 2005;54:1024-1033. [PubMed] [DOI] |
| 12. | Strand S, Hofmann WJ, Hug H, Muller M, Otto G, Strand D, Mariani SM, Stremmel W, Krammer PH, Galle PR. Lymphocyte apoptosis induced by CD95 (APO-1/Fas) ligand-expressing tumor cells--a mechanism of immune evasion? Nat Med. 1996;2:1361-1366. [PubMed] [DOI] |
| 13. | Fukuzawa K, Takahashi K, Furuta K, Tagaya T, Ishikawa T, Wada K, Omoto Y, Koji T, Kakumu S. Expression of fas/fas ligand (fasL) and its involvement in infiltrating lymphocytes in hepatocellular carcinoma (HCC). J Gastroenterol. 2001;36:681-688. [PubMed] [DOI] |
| 14. | Nakamoto Y, Kaneko S, Fan H, Momoi T, Tsutsui H, Nakanishi K, Kobayashi K, Suda T. Prevention of hepatocellular carcinoma development associated with chronic hepatitis by anti-fas ligand antibody therapy. J Exp Med. 2002;196:1105-1111. [PubMed] [DOI] |
| 15. | Oksuz M, Akkiz H, Isiksal YF, Saydaogluc G, Serin M, Kayaselcuk F, Abayli B, Tuncer I. Expression of Fas antigen in liver tissue of patients with chronic hepatitis B and C. Eur J Gastroenterol Hepatol. 2004;16:341-345. [PubMed] [DOI] |
| 16. | Kiyici M, Gurel S, Budak F, Dolar E, Gulten M, Nak SG, Memik F. Fas antigen (CD95) expression and apoptosis in hepatocytes of patients with chronic viral hepatitis. Eur J Gastroenterol Hepatol. 2003;15:1079-1084. [PubMed] [DOI] |
| 17. | Chen J, Su XS, Jiang YF, Gong GZ, Zheng YH, Li GY. Transfection of apoptosis related gene Fas ligand in human hepatocellular carcinoma cells and its significance in apoptosis. World J Gastroenterol. 2005;11:2653-2655. [PubMed] |
| 18. | Kawada N. Human hepatic stellate cells are resistant to apoptosis: implications for human fibrogenic liver disease. Gut. 2006;55:1073-1074. [PubMed] [DOI] |
| 19. | Park YN, Roncalli M. Large liver cell dysplasia: a controversial entity. J Hepatol. 2006;45:734-743. [PubMed] [DOI] |
| 20. | Libbrecht L, Desmet V, Roskams T. Preneoplastic lesions in human hepatocarcinogenesis. Liver Int. 2005;25:16-27. [PubMed] [DOI] |
| 21. | Koo JS, Seong JK, Park C, Yu DY, Oh BK, Oh SH, Park YN. Large liver cell dysplasia in hepatitis B virus x transgenic mouse liver and human chronic hepatitis B virus-infected liver. Intervirology. 2005;48:16-22. [PubMed] [DOI] |