修回日期: 2008-03-19
接受日期: 2008-05-02
在线出版日期: 2008-06-08
目的: 研究胃泌素(GAS)和生长抑素(SS)在卵巢癌患者胃轻瘫发生中的作用, 进而探讨卵巢癌的早期诊断与治疗.
方法: 我院2005-01/2007-01住院卵巢癌患者56例, 所有病例均经手术和病理证实, 并分为正常对照组, 卵巢良性肿瘤组和卵巢癌组. GAS和SS的放免测定及RT-PCR法检测血清及组织中GAS和SS表达, 统计学分析法分析GAS和SS与卵巢癌相关性.
结果: 卵巢癌组织和血清中GAS表达升高、SS表达降低, 与正常对照组比较差异非常显著(GAS: 146.6±28.8 ng/L vs 83.5±14.4 ng/L, SS: 16.2±3.9 ng/L vs 52.1±15.1 ng/L, 均P<0.01), 与卵巢良性肿瘤组(GAS: 102.2±21.5 ng/L, SS: 42.6±13.6 ng/L)比较, 差异显著(均P<0.05), 卵巢良性肿瘤组组织和血清中GAS和SS表达与正常对照组比较差异显著(P<0.05).
结论: 卵巢癌组织中GAS表达上升, SS表达下降, 其变化可能与腹腔因素和全身体液因素的作用有关, 其对卵巢癌的早期诊断和治疗有指导意义.
引文著录: 夏志军, 吴波, 谷艳萍, 胡清, 陈少夫, 赵晓东. 胃泌素和生长激素在卵巢癌患者胃轻瘫发生中的作用. 世界华人消化杂志 2008; 16(16): 1763-1767
Revised: March 19, 2008
Accepted: May 2, 2008
Published online: June 8, 2008
AIM: To determine roles of gastrin(GAS) and somatostatin(SS) in ovarian cancer with gastroparesis syndrome, and therefore to explore approaches to early diagnosis and treatment for ovarian cancer.
METHODS: Fifty-six patients with pathologically-confirmed ovarian cancer admitted to our hospital form January 2005 to January 2007 were divided into three groups: normal control group, ovarian benign tumor group and ovarian malignant tumor group. Radioimmunity method and RT-PCR were performed to measure expressions of GAS and SS in the serum and tissues. Their correlation with ovarian cancer were analyzed using t test.
RESULTS: In ovarian malignant tumor group, expression of serum GAS was elevated while serum SS was decreased. There was very significant difference between the malignant group and the control group (GAS: 146.6 ± 28.8 ng/L vs 83.5 ± 14.4 ng/L, SS: 16.2 ± 3.9 ng/L vs 52.1 ± 15.1 ng/L, both P < 0.01). There was significant difference between the malignant and benign tumor groups (GAS: 102.2 ± 21.5 ng/L, SS: 42.6 ± 13.6 ng/L, P < 0.05). There was significant difference between ovarian benign tumor group and normal control group (P < 0.05).
CONCLUSION: The expression level of GAS is increased, and SS is decreased in ovarian malignant tumor group. Celiac factors and body fluid factors may be responsible for these changes. This is helpful for the early diagnosis and treatments for ovarian cancer.
- Citation: Xia ZJ, Wu B, Gu YP, Hu Q, Chen SF, Zhao XD. Roles of gastrin and somatostatin in ovarian cancer with gastroparesis syndrome. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1763-1767
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1763.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1763
胃轻瘫[1](gastroparesis syndrome)是内科常见的慢性并发症, 其主要特点是胃动力下降、胃排空迟缓和胃节律紊乱, 从而导致胃潴留.症状包括早饱、恶心、腹胀、呕吐和食欲不振, 也可以仅有胃动力的障碍而无明显症状. 胃轻瘫的发病原因是多方面的, 确切的机制目前尚不十分清楚, 争论颇多. 除了与神经病变、血管病变、高血糖及代谢紊乱有关外, 胃肠激素对胃肠运动有非常广泛的调节作用, 特别是胃泌素[2](gastrin, GAS)及生长抑素[3](somatostatin, SS)在胃轻瘫的发生发展中有重要地位, 并受到人们的关注. 卵巢癌作为一种有全身综合表现的疾病, 即使在早期, 也会有最为早期的临床症状-轻重不同腹胀, 纳差等, 这些早期症状出现原因在不伴腹水的情况下很难解释清楚. 是否存在某些因子在卵巢癌早期即发挥作用, 而引起早期症状的出现, 探讨如下.
2005-01/2007-01住院卵巢癌患者56例, 符合1997年WHO诊断标准, 所有病例均经过手术和病理证实, 平均年龄53.6±14.7岁. 无糖尿病史, 无胃肠疾病史, 肝肾功能正常, 近期无服药史. 经核素标记胃半排时间测定分为正常对照组11例, 平均年龄47.1±6.7岁; 卵巢良性肿瘤组15例, 平均年龄45.6±11.3岁卵巢癌组30例, 平均年龄53.6±14.7岁. 受试者1 wk内未服用过制酸剂、H2受体阻滞剂、质子泵抑制剂及内分泌类药物等. 胃泌素和生长抑素等放免盒; FT-613型自动计数125I放免测量仪, 美国GE双探头Spect核素扫描仪, 日本Pentax-EG-2901电子胃镜等.
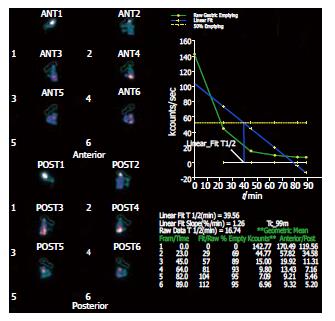
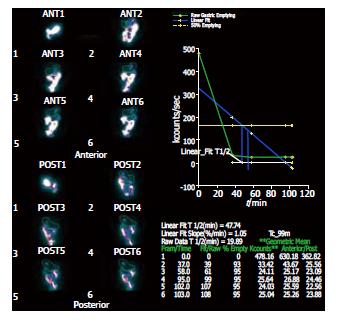
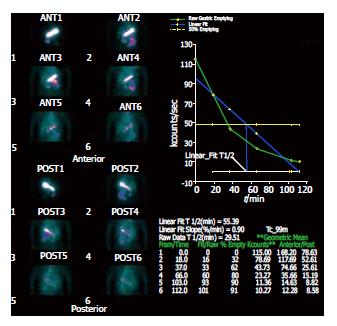
应用美国GE双探头Spect核素扫描仪, 采集距阵128×128, 准直器号LEHR. 受试者空腹10 h, 在2 min内吞下半固体放射性试餐(200 g面包粥+74 MBq99TC-DTPA), 仰卧于检查床上.探头对准胃区和上腹部, 启动采集程序, 每15 min采集1幅, 间断采集6次. 图象处理: 调用胃排空软件处理包, 依次画出各时间点胃感兴趣区, 程序自动计算胃排空率、胃排空时间、胃半排时间和胃排空曲线, 自动进行放射性时间矫正(图1-3). 晚餐后禁食, 次日晨空腹抽取静脉血4 mL, 分别将2 mL置于2个试管中, 一管分离血清待测GAS, 另一管内加入100 g/L EDTA-二钠30 μL及抑肽酶40 μL, 4℃离心10 min(3000 r/min), 取血清待测SS, 二者均贮存于-70℃冰箱保存.受试者在胃镜直视下于胃窦部(距幽门3 cm以内)取大弯侧黏膜活检1块, 放于-70℃冰箱保存待测.
1.2.1 GAS和SS的放免测定: 依据标准加样程序测定; 并绘制标准曲线测量标本含量. B/Bo% = [沉淀B(cpm)-NSB(cpm)]/[Bo(cpm)-NSB(cpm)] ×100%. 以标准管B/Bo%为纵坐标, 以标准浓度为横坐标, 在半对数表上绘制标准曲线, 样品管以同样方式计算B/Bo%, 在标准曲线上查出相应的GAS和SS浓度.
1.2.2 胃黏膜GAS和SS mRNA测定: 按TRIzol抽提试剂盒说明提取组织总RNA; 紫外分光光度计检测RNA纯度, 放置-70℃冰箱保存. 引物序列: GAST-human-Mrna, NM-000805(61-890): 230 bp, 55.9℃. GAST-F 5'-TCT TTG CAC TGG CTC TGG-3', GAST-R 5'-GGC TTC TTC TTC TTC CTC C-3'. SST-human-Mrna, NM-001048(306-562): 257 bp, 53.3℃. SST-F 5'-CAG ACG GAG AAT GAT GCC-3', SST-R 5'-TCG CTG AAG ACT TGG AGG-3'. 用β-actin 为内参照, 引物序列(498 bp)β-actin human F, 5'-GTG GGG CGC CCC AGG CAC CA-3', β-actin human R, 5'-CTC CTT AAT GTC ACG CAC GAT TTC-3'. 在逆转录反应体系20 μL中, 加入RNA 2 μL, 引物1 μL, 在设定条件下进行反应. 取cDNA 3 μL, 上下游引物各0.05 μL, Taq DNA聚合酶0.2 μL, 加入PCR反应体系中扩增.反应条件: 94℃预变性3 min, 然后94℃ 45 s, 52.5℃ 60 s, 72℃ 60 s, 72℃ 7 min共进行35个循环.
PCR产物用15 g/L琼脂糖电泳, 在紫外透射仪下鉴定. PCR产物采用20 g/L琼脂凝胶电泳检查, 紫外透射仪下观察, 拍照并记录. 经分析系统扫描后测定扩增带平均灰度值, 计算各基因mRNA表达指数(Ⅰ), 以β-actin为参照, 求出其相对值Ⅰ(GAS gene) = GAS gene/β-actin, Ⅰ(SS gene) = SS gene/β-actin. 提取的总RNA经检验A260nm/280nm = 1.916+0.118, 提示获得的RNA纯度高. RT-PCR产物经20 g/L琼脂糖凝胶电泳后, 紫外透射仪下可见扩增之特异产物条带, 且目的基因片段产物与引物设计之目的片段大小完全吻合.
统计学处理 GAS和SS的含量用mean±SD表示, 组间比较用t检验或t'检验.
正常对照组: GAS为83.5±14.4 ng/L, SS为52.1±15.1 ng/L. 卵巢良性瘤组: GAS为102.2±21.5 ng/L, 与正常对照组比较差异显著(P<0.05); SS为42.6±13.6 ng/L, 与正常对照组比较差异显著(P<0.05). 卵巢癌组: GAS为 146.6±28.8 ng/L, SS为16.2±3.9 ng/L, 与正常对照组比较差异非常显著(P<0.01); 与卵巢良性瘤组比较差异显著(P<0.05).
正常对照组: GASⅠ值0.338±0.313; SSⅠ值0.756±0.302. 卵巢良性瘤组: GASⅠ值0.408±0.439, 与正常对照组比较差异显著(P<0.05); SSⅠ值为0.521±0.232, 与正常对照组比较差异显著(P<0.05). 卵巢癌组: GASⅠ值0.662±0.301, SSⅠ值0.326±0.282, 与正常对照组比较差异非常显著(P<0.01); 与卵巢良性瘤组比较差异显著(P<0.05).
卵巢癌胃轻瘫表现多认为由癌性腹水或肿瘤组织直接侵袭所致, 但临床上早期卵巢癌无腹水, 无肿瘤侵袭者, 仍有消化道症状, 其原因尚不清楚. 这些症状除外消化道疾患可能因素有: (1)腹水对腹腔腹膜和内脏的作用; (2)自主神经受癌肿, 应激等异常因素影响; (3)业已证实胃肠激素及脑肠肽在消化道运动功能调节方面起重要作用, 如胃肠激素和肽类激素水平异常, 将会引起一系列胃肠道不良症状.
GAS为胃窦黏膜中G细胞分泌的激素, 是胃酸分泌的主要调节激素, 对胃黏膜具有生长促进功能. GAS作为神经递质, 通过迷走神经在中枢和外周水平上对胃肠活动和胃排空进行细致调节, 可刺激多种消化液(如, 胰液和胆汁等)的分泌及促进胃肠的收缩和运动, 其水平的高低在一定程度上反映了消化道的分泌、消化功能[4]. 生理量的GAS除可引起胃酸分泌外, 对胃的运动有中等程度的刺激作用, 并提高幽门泵的活动. GAS的主要作用有刺激胃酸分泌、对泌酸区胃黏膜的营养支持作用和刺激胃窦部运动[5].SS有多种分子形式, 主要有SS-14和SS-28.SS受体有5种亚型(SSt1-SSt5), 分布于7个跨膜区, 属于G-蛋白偶联受体超家族[6-7]. SS通过与这些特定的、高亲和力的膜结合受体相结合而发挥作用[8]. 卵巢癌是否有SS分泌减少, 从而减轻了对GAS的抑制作用, 使GAS的合成和分泌增加, 引起胃十二指肠不协调的收缩或反馈性抑制, 最终导致胃排空障碍. Yamamoyo et al[9]报道GAS可破坏自发和MTL诱发的MMCⅢ期活动, 使空腹样胃肠运动转变为食后样运动, 而使DGP患者胃窦部缺乏MMCⅢ期运动. SS的作用通过细胞膜上SS受体介导[10], SSTR通过G蛋白与腺苷酸环化酶、钾离子通道、钙离子通道偶联, 作用于细胞内相应的效应系统, 或者通过非偶联G蛋白途径调节酪氨酸蛋白磷酸激酶、Na+-H+交换和细胞增生等. SSTR家族共分5型, SSTR1是SSTR家族中较为独特的受体, 在胃肠道有分布, 他虽有类似G蛋白受体的跨膜结构, 但不与G蛋白偶联. SSTR1也能介导抑制AC活性, 通过cAMP传递跨膜信号, 在中枢神经系统还可协调锥体外系运动功能与感觉功能. SS在中枢神经系统和胃肠道中均有广泛的分布[3], 据现代免疫学研究证实, 免疫系统的细胞能释放上述因子并含有其高亲和力结合位点. 其对免疫系统的作用包括刺激淋巴细胞在体内体外的增殖. SS作为免疫调节递质, 作用于外周T细胞上的胃肠肽受体, 对细胞免疫功能发挥调节作用, 并通过SS间接影响多种细胞因子的变化, 从而达到对胃肠道免疫的调节, 实现对胃肠道疾病及功能的调整作用. 本实验结果表明有消化道症状的卵巢癌患者体内缺乏SS, 而抑制了胃肠道的功能及免疫调节, 使卵巢癌患者出现一系列胃肠道症状. SS的缺乏与卵巢癌的期别负呈相关, 可能与免疫系统受抑制程度不同而出现不同反应. GAS主要由小肠上部的G细胞释放, 还存在于神经组织及垂体、大脑皮层等部位, 因此胃动素也是一种脑肠肽. 卵巢癌患者血浆GAS变化机制尚不清楚. 本研究提示, 卵巢癌患者引起GAS的变化胃肠动力学的改变, 出现胃轻瘫临床表现. 引起其改变考虑可能与以下因素有关: (1)免疫系统或应激反应引起胃动素活性下降, 降低了对胃肠平滑肌的直接作用. 反馈性引起胃动素升高; (2)腹水、癌肿或癌性粘连引起机械性因素引发胃肠运动受阻; (3)胃肠道可能发生淤血、水肿, 迷走神经张力升高, 从而刺激胃动素的分泌; (4)腹腔植物神经受到影响, 使得胃动素通过胆碱能神经产生胃肠运动受阻; (5)精神、神经因素异常可能减少胃肠激素分泌的抑制, 而使胃动素升高.
可见卵巢癌患者血清中出现脑肠肽异常多由于免疫状态或免疫调节异常引起, 提示免疫系统异常变化与卵巢癌发生同步, 程度与期别相关. 其早期伴随发生的消化道症状是全身免疫系统异常的部分反应, 应引起重视. 肿瘤组织直接侵袭引起消化道症状是卵巢癌晚期表现的主要因素. 本实验结果表明, 血清GAS和SS与胃窦部组织RT-PCR检测GAS和SS的基因表达具有一致性: 卵巢癌组与对照组和卵巢瘤组比较的结果差异显著; 恶性肿瘤为全身疾病, 腹腔物理因素和全身体液因素的作用影响可能导致GAS和SS变化, 进而出现腹胀症状, 对卵巢癌的早期诊断与治疗有提实及指导意义.
卵巢癌是威胁女性生命的主要恶性肿瘤之一, 很多患者被发现患有卵巢癌, 大多处于晚期, 追问病史, 发现大多患者早期存在早饱、恶心、腹胀、呕吐和食欲不振等胃轻瘫症状, 且当时并无腹水存在, 由此推测是否存在某些因子在卵巢癌早期即发挥作用, 而引起早期症状的出现, 本研究分析了胃泌素和生长抑素在卵巢癌患者胃轻瘫发生中的作用, 进而探讨卵巢癌的早期诊断与治疗.
季国忠, 副教授, 南京医科大学第二附属医院消化科
卵巢癌早期诊断与治疗是目前国内外卵巢癌学者密切关注的问题.
Yamamoyo et al报道GAS可破坏自发和MTL诱发的MMCⅢ期活动, 使空腹样胃肠运动转变为食后样运动, 而使DGP患者胃窦部缺乏MMCⅢ期运动.
本研究首次进行卵巢癌早期腹胀与胃肠肽相关性研究.
本文做了大量卵巢癌患者中胃轻瘫以及两者相关性的研究工作, 有一定的学术价值和对临床的指导意义.
编辑: 师忠芳 电编:郭海丽
| 1. | Patrick A, Epstein O. Review article: gastroparesis. Aliment Pharmacol Ther. 2008;27:724-740. [PubMed] |
| 2. | Schafer J, Baumeister H, Lorenz A, Meyerhof W. Localization of somatostatin receptor subtype mRNA in the rat gastrointestinal tract and regulation of SSTR1 gene expression. Z Ernahrungswiss. 1998;37 Suppl 1:75-79. [PubMed] |
| 3. | Janson ET, Oberg K. Somatostatin receptor ligands and their use in the treatment of endocrine disorders. Curr Pharm Des. 1999;5:693-705. [PubMed] |
| 5. | Migdalis L, Thomaides T, Chairopoulos C, Kalogeropoulou C, Charalabides J, Mantzara F. Changes of gastric emptying rate and gastrin levels are early indicators of autonomic neuropathy in type II diabetic patients. Clin Auton Res. 2001;11:259-263. [PubMed] [DOI] |
| 6. | Patel YC. Molecular pharmacology of somatostatin receptor subtypes. J Endocrinol Invest. 1997;20:348-367. [PubMed] |
| 7. | Patel YC, Greenwood MT, Panetta R, Demchyshyn L, Niznik H, Srikant CB. The somatostatin receptor family. Life Sci. 1995;57:1249-1265. [PubMed] [DOI] |
| 8. | Patel YC, Greenwood M, Panetta R, Hukovic N, Grigorakis S, Robertson LA, Srikant CB. Molecular biology of somatostatin receptor subtypes. Metabolism. 1996;45:31-38. [PubMed] [DOI] |
| 9. | Yamamoto O, Matsunaga Y, Shiba Y, Haga N, Sano I, Itoh Z. Inhibition of motilin-induced phase III contractions by pentagastrin in Heidenhain pouch dogs. J Pharmacol Exp Ther. 1994;271:1471-1476. [PubMed] |
| 10. | Watt HL, Kharmate G, Kumar U. Biology of somatostatin in breast cancer. Mol Cell Endocrinol. 2008;. [PubMed] |