修回日期: 2008-04-10
接受日期: 2008-05-08
在线出版日期: 2008-06-08
目的: 探讨上皮型钙黏素(E-cadherin)、β-连环素(β-catenin)和组织蛋白酶D(CathepsinD)在食管鳞状细胞癌(ESCC)中的表达及其与临床病理特征的关系.
方法: 选取新疆医科大学第一附属医院2003-06/2007-07手术切除并经病理证实的ESCC标本60例, 同时选取15例正常食管组织作对照. 采用免疫组织化学EnVision二步法检测各组织中E-cadherin、β-catenin及CathepsinD的表达, 分析其与食管鳞状细胞癌临床病理特征的关系.
结果: ESCC组织中, E-cadherin和β-catenin异常表达率分别为61.67%和66.67%, CathepsinD的阳性表达率为60%, 分别高于正常食管组织(0%, 0%, 0%, 均P<0.01). 中低分化组、侵及肌层组及有淋巴结转移组中, E-cadherin和β-catenin的异常表达和CathepsinD的阳性表达均高于高分化组、未侵及肌层组及无淋巴结转移组, 差异有统计学意义(P<0.01). ESCC组织中E-cadherin和β-catenin的异常表达呈正相关(r = 0.679, P<0.01), CathepsinD的阳性表达与E-cadherin、β-catenin的异常表达呈正相关(r = 0.616, r = 0.505, P<0.01).
结论: ESCC中E-cadherin、β-catenin的异常表达和CathepsinD的阳性表达与肿瘤的浸润和发展有关, 联合检测E-cadherin、β-catenin和CathepsinD有可能成为判断ESCC恶性程度和预后的重要指标.
引文著录: 马红, 陈晓, 马海梅, 尼加提·热合木, 蒲红伟. E-cadherin、β-catenin和CathepsinD在食管鳞状细胞癌中的表达及其意义. 世界华人消化杂志 2008; 16(16): 1757-1762
Revised: April 10, 2008
Accepted: May 8, 2008
Published online: June 8, 2008
AIM: To investigate the correlation between expression of E-cadherin, β-catenin and CathepsinD, and to determine their clinicopa¡§thologic features in esophageal squamous cell carcinoma (ESCC).
METHODS: Sixty surgically excised and pathologically confirmed ESCC specimens were selected from preclinical medical college, Xinjiang Medical University from June 2003 to July 2007, while 15 cases of normal esophageal tissues were taken as the control group. Immunohistochemical EnVision method was used to determine the expression of E-cadherin, β-catenin and CathepsinD in 60 ESCC specimens and 15 specimens of normal esophageal tissues, and their correlation with the clinicopathologic characteristics of ESCC were analyzed.
RESULTS: Aberrant expression rates of E-cadherin and β-catenin were 61.67% and 66.67% respectively, and the positive expression rate of CathepsinD was 60% in ESCC, which were all higher than those in normal esophageal tissues (0%, 0%, 0%, all P < 0.01), respectively. Aberrant expression rates of E-cadherin and β-catenin and the positive expression rate of CathepsinD were significantly higher in the moderate-low differentiation group, infiltration into muscular layer group, lymphatic metastasis group than in the well-differentiated ESCC group, no infiltration into muscular layer group, non-metastatic group (P < 0.01). E-cadherin aberrant expression was positively correlated with β-catenin in ESCC (r = 0.679, P < 0.01). The positive expression of CathepsinD was positively correlated with aberrant expression of E-cadherin and β-catenin (r = 0.616, r = 0.505, both P < 0.01).
CONCLUSION: Aberrant expression of E-cadherin, β-catenin and positive expression of CathepsinD suggest their correlation with infiltration and development of ESCC. E-cadherin, β-catenin and CathepsinD can be used as valuable molecular markers for progression and prognosis of ESCC.
- Citation: Ma H, Chen X, Ma HM, Rehemu·Nijiati, Pu HW. Significance of E-cadherin, β-catenin and CathepsinD expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1757-1762
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1757.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1757
食管癌是世界上最常见的十大恶性肿瘤之一, 据世界范围内统计, 每年大约有30万的食管癌新发病例, 并且大多发生于发展中国家[1]. 我国新疆维吾尔自治区食管癌死亡率为13.05/10万, 在全国居第13位, 其中哈萨克族是食管癌高发民族之一, 其食管癌死亡率为68.88/10万, 且具有明显的地区性和家族聚集性[2-3]. 侵袭转移是食管癌患者死亡的首要原因[4]. 因此, 阐明食管癌浸润、转移机制显得尤为重要. 本研究采用免疫组织化学方法检测食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)中上皮型钙黏素(E-cadherin, E-cad)、β-连环素(β-catenin, β-cat)和组织蛋白酶D(CathepsinD, Cath-D)的表达, 探讨他们在ESCC发生发展及侵袭转移中的作用和意义[5-6].
选取新疆医科大学第一附属医院2003-06/2007-07手术切除并经病理证实ESCC标本60例, 男33例, 女27例, 年龄38-74(中位年龄62)岁. 所有病例术前未经任何放疗和化疗. 按照WHO分类标准进行病理分级: 高分化26例, 中低分化34例. 无淋巴结转移31例, 有淋巴结转移29例; 未侵及肌层15例, 侵及肌层45例. 汉族36例, 哈萨克族24例. 同时选取15例正常食管组织(距食管鳞癌原发灶3 cm)作对照. 标本均经40 g/L甲醛固定, 常规石蜡包埋, 连续4 μm厚度切片. 鼠抗人E-cad(MAB-0247)mAb、鼠抗人β-cat (MAB-0259)mAb和兔抗人Cath-D(RAB-0029) pAb均购自福州迈新生物技术开发有限公司.
按免疫组织化学EnVision法检测ESCC组织中E-cad、β-cat和Cath-D蛋白的表达. 用已知乳腺癌组织作为阳性对照, 0.01 mol/L PBS代替一抗作空白对照. E-cad和β-cat阳性染色为细胞膜出现棕黄色颗粒. 每张切片随机选择10个高倍视野, 每个视野计数100个细胞. 正常表达: 阳性细胞数≥90%; 异常表达: 切片内阳性细胞<90%. Cath-D以胞质有明显棕黄色颗粒为阳性, 无明显阳性细胞或阳性细胞小于25%为阴性, 阳性细胞大于25%为阳性.
统计学处理 采用SPSS13.0统计软件包进行χ2检验及Spearman相关分析, P<0.05为有统计学意义.
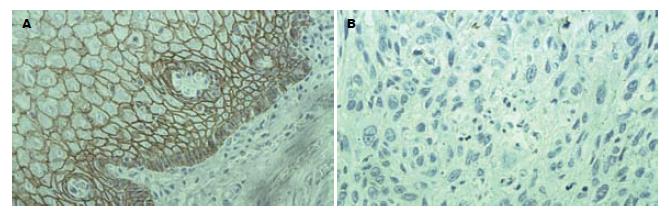
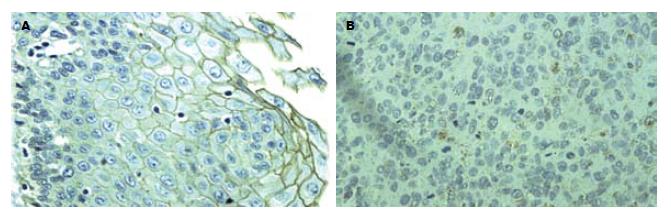
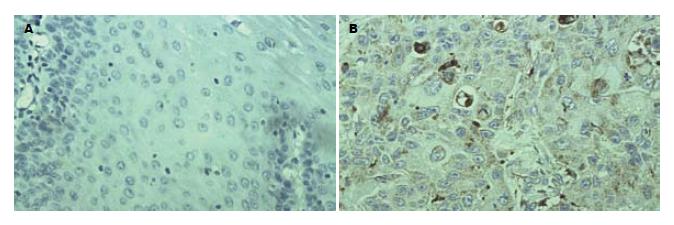
15例正常食管黏膜上皮中E-cad和β-cat均呈正常表达, 细胞膜为棕黄色, 胞质和胞核未见表达(图1A, 图2A), Cath-D呈阴性表达(图3A). 60例ESCC组织中, E-cad和β-cat细胞膜表达降低, β-cat部分出现细胞质阳性异常染色或以细胞质为主的混合性染色, 异常表达率分别为61.67%(37/60)和66.67%(40/60)(图1B, 图2B). Cath-D的阳性表达率为60%(36/60), 高于正常食管组织(0%)(P<0.01, 表1), 癌细胞胞质和部分间质细胞出现棕黄色颗粒(图3B).
| 分组 | n | E-cad | β-cat | Cat-D | |||
| 正常 | 异常 | 正常 | 异常 | 阴性 | 阳性 | ||
| 对照组 | 15 | 15(100) | 0(0) | 15(100) | 0(0) | 15(100) | 0(0) |
| ESCC | 60 | 23(38.33) | 37(61.67) | 20(33.33) | 40(66.67) | 24(40) | 36(60) |
E-cad在有淋巴结转移组中的异常表达率82.76%(24/29)高于无淋巴结转移组41.94%(13/31), 两组差异有统计学意义(P<0.01); E-cad在中低分化组和侵及肌层组中的异常表达率分别为85.29%、73.33%, 分别高于高分化组和未侵及肌层组, 差异有统计学意义(P<0.01). β-cat在中低分化组、侵及肌层组及有淋巴结转移组中异常表达率分别为88.23%、77.78%和86.21%, 分别高于高分化组、未侵及肌层组及无淋巴结转移组, 差异有统计学意义(P<0.01). Cath-D在中低分化组、侵及肌层组及有淋巴结转移组中异常表达率分别为76.47%、73.33%和89.66%, 分别高于高分化组、未侵及肌层组及无淋巴结转移组, 差异有统计学意义(P<0.01, 表2). E-cad、β-cat和Cath-D在汉族、哈萨克族食管癌中的表达, 差异无统计学意义(P>0.05, 表2).
| 临床病理特征 | n | E-cad | β-cat | Cat-D | ||||
| 异常表达(n) | % | 异常表达(n) | % | 阳性表达(n) | % | |||
| 分化程度 | 高 | 26 | 8 | 30.77 | 10 | 38.46 | 10 | 38.46 |
| 中/低 | 34 | 29 | 85.29 | 30 | 88.23 | 26 | 76.47 | |
| 浸润深度 | 未侵及肌层 | 15 | 4 | 26.67 | 5 | 33.33 | 3 | 20.00 |
| 侵及肌层 | 45 | 33 | 73.33 | 35 | 77.78 | 33 | 73.33 | |
| 淋巴结转移 | 有 | 29 | 24 | 82.76 | 25 | 86.21 | 26 | 89.66 |
| 无 | 31 | 13 | 41.94 | 15 | 48.39 | 10 | 32.26 | |
| 民族 | 汉族 | 36 | 21 | 58.33 | 22 | 61.11 | 21 | 58.33 |
| 哈萨克族 | 24 | 16 | 66.67 | 18 | 75.00 | 15 | 62.50 | |
在60例ESCC组织中, E-cad和β-cat均正常表达者17例, 均异常表达者34例, 两者的表达呈正相关(r = 0.679, P<0.01). 在E-cad正常表达的23例中, 5例Cath-D呈阳性表达; 而在E-cad异常表达的37例中, 31例Cath-D呈阳性表达, E-cad异常表达与Cath-D阳性表达呈正相关(r = 0.616, P<0.01). β-cat正常表达的20例中, 5例Cath-D呈阳性表达; 而在β-cat异常表达的40例中, 31例Cath-D呈阳性表达, β-cat异常表达与Cath-D阳性表达呈正相关(r = 0.505, P<0.01).
E-cad是一类介导细胞之间互相黏附的钙依赖性跨膜糖蛋白, E-cad胞质末端与连环蛋白(α-cat, β-cat, γ-cat)及肌动蛋白细胞骨架结合形成钙黏附素连环素复合体(E-cad/cat), 不仅介导细胞黏附, 还直接和间接的参与细胞内信号传导, 与肿瘤的侵袭和转移行为密切相关[7-8]. 已有研究认为在胃癌、乳腺癌、肺癌等肿瘤中E-cad表达缺失, 会触发癌细胞从原发癌巢释放并赋予肿瘤细胞侵袭特性[9-12]. 王斌 et al[13]研究表明, 随着食管鳞癌分化程度降低、浸润深度增加和临床分期加重及淋巴结转移的发生, E-cad阳性表达率下降, 且E-cad阴性表达患者术后复发转移机会增多, 存活率减低. 本研究结果显示, E-cad在正常食管黏膜上皮中呈正常表达, 而在ESCC中出现膜表达降低, 异常表达率为61.67%; 且随着ESCC分化程度的降低、浸润深度的增加及淋巴结转移的发生, E-cad异常表达率升高, 提示E-cad的异常表达促进ESCC去分化、侵袭和转移, 可作为肿瘤预后不良的分子标志. 基因突变、转录和翻译失常等导致E-cad异常表达, 使肿瘤细胞黏附功能降低, 肿瘤细胞易从原发部位脱落, 这一现象可能在肿瘤的扩散中起关键性的启动作用. 张友才 et al[14]研究表明E-cad基因启动子CpG岛甲基化可能参与胃肠腺癌的发生. 目前, 在对食管癌中E-cad调控的确切机制尚待深入研究.
在catenin家族中以β-cat与肿瘤的关系最为密切[15]. β-cat除与E-cad结合介导细胞黏附反应外, 还参与Wnt信号转导通路[16]. 当β-cat蛋白本身异常或降解途径异常时, 造成Wnt信号传导通路的异常激活, β-cat进入核内与转录调控因子TCF/LEF家族成员结合, 继而激活下游靶基因CyclinD1, c-mys等癌基因, 导致肿瘤的发生[17-18]. Kawasaki、Zhang et al报道β-cat与结直肠癌、乳腺癌和胃癌等多种肿瘤发生有关[19-21]. 吴永廉 et al[22]应用免疫组化SP法检测β-cat在100例食管癌组织中的表达, 研究结果表明, β-cat在分化程度低和浸润深的食管癌组织中异常表达率高, 淋巴结有转移的比无转移的异常表达率高, 且β-cat异常表达者5年生存率低, 认为β-cat异常表达与食管癌浸润转移存在一定关系. 本研究结果显示, β-cat在正常食管黏膜上皮中呈正常表达, 而在ESCC中出现膜表达降低, 部分出现细胞质阳性异常染色, 异常表达率为66.67%; 中低分化组、侵及肌层组和有淋巴结转移组中β-cat异常表达率明显高于高分化组、未侵及肌层组和无淋巴结转移组, 提示β-cat异常表达介导的Wnt信号通路异常激活导致ESCC发生可能是早期事件; 而β-cat异常表达导致E-cad/cat复合体结构破坏和功能障碍, 是肿瘤获得高侵袭、转移潜能的重要原因之一, 可能是ESCC发生发展过程中的晚期事件.
Cath-D是一种天门冬氨酸肽链内切酶, 广泛存在于不同的组织细胞和肿瘤细胞, 研究认为Cath-D能溶解基底膜、细胞外基质和结缔组织, 从而在恶性肿瘤细胞的浸润和转移机制上起着一种重要作用[23-24]. 关于Cath-D的表达在乳腺癌浸润转移中的意义, 目前尚存在一定争议, 绝大多数研究认为Cath-D高表达提示预后不良[25-26]. 吴凤云 et al[27]采用免疫组化法对160例乳腺癌标本进行分析, 发现Cath-D表达与临床分期、肿块大小和组织学分级有关, 提示Cath-D过度表达与乳腺癌细胞浸润性生长存在密切关系. 然而Cath-D表达与腋淋巴结转移无明显相关性, 认为Cath-D在影响癌细胞淋巴结转移上作用不大, 由于Cath-D对肿瘤血管基底膜具有溶解作用, 使肿瘤细胞能够进入血管, 故其诱发肿瘤细胞转移的主要途径很可能是血道转移. 本研究显示, ESCC中Cath-D的表达阳性率为60%, Cath-D在中低分化组、侵及肌层组及有淋巴结转移组中异常表达率分别为76.47%、73.33%和89.66%, 分别高于高分化组、未侵及肌层组及无淋巴结转移组, 且Cath-D在部分间质细胞亦有表达, 由此提示Cath-D阳性表达可能与ESCC的生长和分化有关, 是ESCC演进过程动态变化的形态和功能特征之一; 其机制可能与肿瘤细胞分泌Cath D降解基底膜和细胞外基质, 促进肿瘤细胞向外侵袭和转移有关.
另外, 实验结果显示ESCC中E-cad和β-cat的表达呈正相关, 提示在ESCC发展过程中E-cad 和β-cat可能具有协同作用, 对ESCC恶性转化及侵袭性生长具有重要意义. Cath-D的阳性表达与E-cad和β-cat的异常表达呈正相关(P<0.01), 提示在ESCC的发生发展、浸润转移过程中Cath-D与E-cad和β-cat可能具有协同作用. 其确切调控机制有待进一步探讨. 本研究发现在60例汉族和哈萨克族ESCC中, E-cad、β-cat和Cath-D的表达在不同民族之间无显著性差异, 提示在新疆的汉族和哈萨克族ESCC的发生发展中, E-cad、β-cat和Cath-D的表达具有共同性, 无民族间基因背景差异.
总之, 在肿瘤发生发展的多基因网络调节过程中, E-cad和β-cat异常表达导致细胞黏附复合体功能异常, Cath-D降解细胞外基质、破坏宿主屏障, 他们共同促进肿瘤的侵袭和转移. 因此, 联合检测E-cad、β-cat和Cath-D的表达在预测ESCC转移潜能、评价预后、指导临床处理等方面有重要意义.
食管癌是我国常见的消化系恶性肿瘤, 居肿瘤死亡的第4位, 且以鳞状细胞癌为主. 我国新疆维吾尔自治区是食管癌高发区之一, 且食管癌的发生有着显著的地域性和民族聚集性特征, 哈萨克族是食管癌高发民族之一. 侵袭转移是造成食管癌患者死亡的主要原因. 因此, 阐明食管癌浸润、转移机制显得尤为重要.
许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科
王斌 et al研究表明随着食管鳞癌分化程度降低、浸润深度增加和临床分期加重及淋巴结转移的发生, E-cad阳性表达率下降, 且E-cad阴性表达患者术后复发转移机会增多, 存活率减低.
本研究联合检测E-cad、β-cat和Cath-D在食管鳞状细胞癌中的表达及相关性, 对判断食管鳞状细胞癌恶性程度、预测侵袭转移趋势和预后具有重要意义.
E-cad、β-cat异常表达可能与食管鳞状细胞癌发生和发展有关, 联合检测E-cad和β-cat蛋白表达可能成为监测食管鳞状细胞癌恶性程度和转移潜能的重要指标.
钙黏附素连环素复合体: E-cad胞内区与连环素及肌动蛋白细胞骨架结合形成钙黏附素连环素复合体. 不仅介导细胞黏附, 还直接和间接的参与细胞内信号传导, 与肿瘤的侵袭和转移行为密切相关.
本文条理清晰, 实验技术方法成熟, 对照合理, 具有一定的参考价值和临床意义.
编辑: 李军亮 电编:郭海丽
| 1. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 2. | 陈晓, 张月明, 温浩, 阿孜古丽·吐尔逊江, 吴明拜, 张铸, 赵春芳, 冯晓辉, 王昊, 张亚楼, 伊力亚尔. 原代培养建立哈萨克族食管癌细胞系的研究. 新疆医科大学学报. 2002;25:20-21. |
| 5. | Wang K, Ma Q, Ren Y, He J, Zhang Y, Zhang Y, Chen W. Geldanamycin destabilizes HER2 tyrosine kinase and suppresses Wnt/beta-catenin signaling in HER2 overexpressing human breast cancer cells. Oncol Rep. 2007;17:89-96. [PubMed] |
| 6. | Dvalishvili I, Charkviani L, Charkviani T, Turashvili G, Burkadze G. Clinical prognostic factors and expression of cathepsin D in endometrioid adenocarcinoma. Georgian Med News. 2005;27-31. [PubMed] |
| 7. | Shih HC, Shiozawa T, Miyamoto T, Kashima H, Feng YZ, Kurai M, Konishi I. Immunohistochemical expression of E- cadherin and beta-catenin in the normal and malignant human endometrium: an inverse correlation between E-cadherin and nuclear beta-catenin expression. Anticancer Res. 2004;24:3843-3850. [PubMed] |
| 8. | Pelosi G, Scarpa A, Puppa G, Veronesi G, Spaggiari L, Pasini F, Maisonneuve P, Iannucci A, Arrigoni G, Viale G. Alteration of the E-cadherin/beta-catenin cell adhesion system is common in pulmonary neuroendocrine tumors and is an independent predictor of lymph node metastasis in atypical carcinoids. Cancer. 2005;103:1154-1164. [PubMed] [DOI] |
| 9. | Agnantis NJ, Goussia AC, Batistatou A, Stefanou D. Tumor markers in cancer patients. an update of their prognostic significance. Part II. In Vivo. 2004;18:481-488. [PubMed] |
| 10. | Ge J, Chen ZH, Chen ZK, Yuan WJ. Expressions of homeobox transcription factor-2 and E-cadherin in gastric carcinoma and their clinical significance. Nanfang Yike Daxue Xuebao. 2008;28:279-281. [PubMed] |
| 11. | Saha B, Chaiwun B, Imam SS, Tsao-Wei DD, Groshen S, Naritoku WY, Imam SA. Overexpression of E-cadherin protein in metastatic breast cancer cells in bone. Anticancer Res. 2007;27:3903-3908. [PubMed] |
| 12. | Weng MX, Wu CH, Yang XP. Expression and Significance of E-cadherin, CD44v6,and Proliferating Cell Nuclear Antigen in Non-small Cell Lung Cancer. Ai Zheng. 2008;27:191-195. [PubMed] |
| 15. | Sierra J, Yoshida T, Joazeiro CA, Jones KA. The APC tumor suppressor counteracts beta-catenin activation and H3K4 methylation at Wnt target genes. Genes Dev. 2006;20:586-600. [PubMed] [DOI] |
| 16. | Michaelson JS, Leder P. beta-catenin is a downstream effector of Wnt-mediated tumorigenesis in the mammary gland. Oncogene. 2001;20:5093-5099. [PubMed] [DOI] |
| 17. | Prasad CP, Gupta SD, Rath G, Ralhan R. Wnt signaling pathway in invasive ductal carcinoma of the breast: relationship between beta-catenin, dishevelled and cyclin D1 expression. Oncology. 2007;73:112-117. [PubMed] [DOI] |
| 18. | Ravindranath A, O'Connell A, Johnston PG, El-Tanani MK. The role of LEF/TCF factors in neoplastic transformation. Curr Mol Med. 2008;8:38-50. [PubMed] [DOI] |
| 19. | Kawasaki T, Nosho K, Ohnishi M, Suemoto Y, Kirkner GJ, Dehari R, Meyerhardt JA, Fuchs CS, Ogino S. Correlation of beta-catenin localization with cyclooxygenase-2 expression and CpG island methylator phenotype (CIMP) in colorectal cancer. Neoplasia. 2007;9:569-577. [PubMed] [DOI] |
| 20. | Zhang YG, Du J, Tian XX, Zhong YF, Fang WG. Expression of E-cadherin, beta-catenin, cathepsin D, gelatinases and their inhibitors in invasive ductal breast carcinomas. Chin Med J (Engl). 2007;120:1597-1605. [PubMed] |
| 21. | Udhayakumar G, Jayanthi V, Devaraj N, Devaraj H. Interaction of MUC1 with beta-catenin modulates the Wnt target gene cyclinD1 in H. pylori-induced gastric cancer. Mol Carcinog. 2007;46:807-817. [PubMed] [DOI] |
| 23. | Glondu M, Liaudet-Coopman E, Derocq D, Platet N, Rochefort H, Garcia M. Down-regulation of cathepsin-D expression by antisense gene transfer inhibits tumor growth and experimental lung metastasis of human breast cancer cells. Oncogene. 2002;21:5127-5134. [PubMed] [DOI] |
| 24. | Naora H, Montell DJ. Ovarian cancer metastasis: integrating insights from disparate model organisms. Nat Rev Cancer. 2005;5:355-366. [PubMed] [DOI] |
| 25. | Kristek J, Dmitrovic B, Kurbel S, Sakic K, Krajinovic Z, Blazicevic V, Has B, Marjanovic K. Tumor growth fraction, expression of estrogen and progesterone receptors, p53, bcl-2 and cathepsin D activity in primary ductal invasive breast carcinoma and their axillary lymph node metastases. Coll Antropol. 2007;31:1043-1047. [PubMed] |