修回日期: 2008-03-18
接受日期: 2008-04-21
在线出版日期: 2008-06-08
目的: 阐明携带肝细胞生长因子(HGF)基因的减毒沙门氏菌在大鼠胃溃疡治疗中的组织分布规律, 为HGF在胃溃疡基因治疗中的实际应用提供依据.
方法: 乙酸诱发80只大鼠胃溃疡模型, 随机分成2组: HGF灌胃组(40只)和绿色荧光蛋白(GFP)灌胃组(40只). 将携带HGF和GFP基因真核表达质粒的减毒沙门氏菌分别给予大鼠灌胃, 每只0.2 mL, 隔日1次, 共3次. GFP灌胃组第1、3、5、7、9天分别处死大鼠3只, 取胃、肠、肝、脾及肾组织制备成冰冻切片, 荧光显微镜下观察目的基因组织分布; HGF灌胃组第1、3、5、7、9、11、13、15、17、19、21天分别处死大鼠3只, ELISA方法检测HGF在各组织中的表达; PCR方法检测真核表达载体在组织中的分布.
结果: GFP组大鼠在荧光显微镜下观察到胃、肠组织有较强的荧光, 在肝、脾、肾组织有微弱的荧光, 荧光强度在第5、7天达到峰值; HGF组大鼠胃、肝、脾、肾、大肠、小肠组织, 均检测到有HGF表达, 但胃、肠组织中表达较高; 大鼠胃、肝、脾、肾、大肠、小肠均可检测到真核表达载体的启动子CMV片段.
结论: 在大鼠胃溃疡治疗中, 减毒沙门氏菌作为细胞载体以po方式可将携带目的基因的真核表达载体相对靶向性转入胃、肠组织中.
引文著录: 蒋泽斌, 哈小琴, 高鹏. 携带肝细胞生长因子基因的减毒沙门氏菌在大鼠胃溃疡治疗中的组织分布. 世界华人消化杂志 2008; 16(16): 1722-1727
Revised: March 18, 2008
Accepted: April 21, 2008
Published online: June 8, 2008
AIM: To highlight tissue distribution of attenuated salmonellae carrying hepatocyte growth factor (HGF) genes in murine gastric ulcers and thereby to provide a basis for HGF application in gene therapy for gastric ulcers.
METHODS: Eighty acetic acid-induced gastric ulcer rats were randomly divided into two groups: HGF treatment group (n = 40 rats) and green fluorescent protein (GFP) treatment group (n = 40 rats). Intragastric administration of attenuated salmonellae carrying HGF and GFP was performed on rats, each one with 0.2 mL, and once every two days for totally 3 times. Three rats in GFP group were killed each time on day 1, 3, 5, 7, 9 and frozen sections were made from stomach, liver, intestines, spleen and kidney to observe tissue distribution of target genes under fluorescence microscopy; 3 rats in HCF group were killed each time on day 1, 3, 5, 7, 9, 11, 13, 15, 17, 19 and 21 to obverse tissue expression using ELISA and to detect tissue distribution of eukaryotic expression vector using PCR.
RESULTS: In GFP group, some strong fluorescence was observed in the stomach and intestines under fluorescence microscopy, and weak fluorescence in liver, spleen and kidneys. The intensity of fluorescence reached its peak on day 5 and day 7. In HGF group, high-level HGF gene expression by ELISA was detected in stomach, liver, spleen, kidney and intestines with higher expression in the intestines and stomach. CMV promoter fragment of eukaryotic expression vectors was detected in stomach, liver, spleen, kidney, large intestine and small intestine.
CONCLUSION: As a cellular vector, orally-administrated attenuated salmonellae could transfer target genes eukaryotic expression vector into stomach and intestinal tissues for gastric ulcer treatment in rats.
- Citation: Jiang ZB, Ha XQ, Gao P. Distribution of attenuated salmonellae carrying hepatocyte growth factor genes in murine gastric ulcers. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1722-1727
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1722.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1722
胃溃疡是全球性多发病, 在不同的国家、不同地区, 其发病率相差悬殊. 据国外报道, 自然人群中约10%的人患过此病. 国内住院患者资料统计中, 本病占0.80%-3.08%, 而且80%溃疡患者发病年龄在40岁以下[1]. 但目前现有的各种疗法尚不能改变消化性溃疡的自然病程和彻底根治溃疡. 肝细胞生长因子(hepatocyte growth factor, HGF)是1984年Nakamura从肝部分切除的鼠血浆中分离和部分纯化并命名的[2]. HGF是一种多功能生物因子, 在体内广泛分布, 存在于肝、肾、脾、肺、脑、胸腺、 胰腺、甲状腺和唾液腺等处. 他是多效性因子, 具有多种生物学活性[3-6], 研究表明, HGF可促进胃肠上皮细胞增殖, 抑制细胞凋亡, 加快胃肠上皮重建[7-8], 减轻炎症细胞浸润, 减轻症状及黏膜损伤, 促进局部血管形成, 加快胃肠道黏膜损伤愈合[9-10]. HGF被证明还具有免疫调节作用, 对自身免疫性疾病具有治疗潜能[11-12], 而且HGF已证明可抑制瘢痕形成[13]. 上皮化和血管形成是胃溃疡愈合必不可少的过程, HGF能促进胃上皮细胞增殖, 因此, HGF具有促进胃溃疡愈合的作用. 但直接应用HGF蛋白治疗胃溃疡存在一些缺陷, 比如HGF蛋白制剂存在半衰期较短, 需要大剂量、反复给药才能维持局部较高的浓度. 有时即使重复应用也难以达到有效浓度, 应用蛋白制剂花费较高, 另外目前的纯化工艺对于人药用级生长因子蛋白的纯化还不是很成熟, 给临床治疗带来很大不便, 所以我们利用减毒沙门氏菌作为基因表达传递载体的优势及对黏膜组织强嗜性的特性, 将HGF基因的真核表达载体转入减毒沙门氏菌中, 制备成一种以减毒沙门氏菌为载体的po基因治疗药物, 本文就是观察po携带肝细胞生长因子基因真核表达质粒的减毒沙门氏菌在胃溃疡模型大鼠各主要脏器中的表达水平和组织分布, 为HGF在胃溃疡病和其他疾病的基因治疗实际应用提供实验依据.
携带HGF基因真核表达质粒的减毒沙门氏菌和携带绿色荧光蛋白(GFP)基因真核表达质粒的减毒沙门氏菌, 均由中国人民解放军兰州军区总医院医学实验中心提供. Taq酶、PCR Buffer、dNTP购自宝生物公司. 抗人HGF mAb(R&D)、重组人HGF蛋白(R&D)、辣根过氧化酶标记羊抗小鼠IgG(北京中杉生物公司), 邻苯二胺(OPD); 组织DNA提取试剂盒(优晶生物工程有限公司); 100%冰乙酸(白银化学试剂厂); 引物合成: CMV启动子上游引物5'-CCCAGTACATGACCTTATGGG-3', 下游引物为: 5'-GGAGACTTGGAAATCCCCGT-3', 由上海生工生物有限公司合成; Wistar大鼠80只, 年龄6-7 wk, 雌雄各半, 平均体质量180±10 g. 由中国人民解放军兰州军区总院实验动物中心提供.
1.2.1 胃溃疡大鼠动物模型的制备: 大鼠术前禁食不禁水24 h, 30 g/L戊巴比妥钠溶液40 mg/kg体质量ip麻醉, 剑突下0.5 cm纵向切开腹壁约2 cm, 自肝后找出胃, 轻轻移出腹腔, 用微量注射器在胃前壁胃窦部浆膜下近肌层处注射0.03 mL冰乙酸, 生理盐水冲洗表面后关腹, 其后单笼饲养.
1.2.2 模型组大鼠分组及基因药物转移: 将模型组大鼠随机分为2组: 携带HGF基因真核表达质粒的减毒沙门氏菌组(HGF组40只)和携带GFP基因真核表达质粒的减毒沙门氏菌组(GFP组40只). 将携带HGF基因的减毒沙门氏菌菌株及携带GFP基因的减毒沙门氏菌菌株分别接种于2 mL含卡那霉素的LB培养液中, 震荡过夜, 次日取50 μL加入50 mL含卡那霉素的LB培养液中, 2 h后收集菌体, PBS清洗后, 用100 g/L的NaHCO3悬浮, 调整细菌数为1×1012 cfu/L, 每只ig 0.2 mL, 隔日1次, 共3次.
1.2.3 目的基因分布的观察和HGF在组织中表达: GFP组ig 3次后第1、3、5、7和9天分别处死3只大鼠, 取胃、肠、肝、脾和肾组织制备成冰冻切片, 荧光显微镜下观察GFP表达分布情况. HGF组ig 3次后第1、3、5、7、9、11、13、15、17、19和21天分别处死3只大鼠, 取主要脏器(胃、肝、脾、肾、大肠和小肠), 将不同大鼠的同一脏器取同一质量在冰上冷匀浆后离心收集上清, 用ELISA方法检测HGF蛋白的表达水平. 因为HGF在生理情况下各组织即有, 故所有实验数据是以GFP组同时间处死大鼠的各组织匀浆为对照检测, 即生理值为0的情况下的值, 也就是外源基因HGF在体内的表达. 过程如下: 用包被液1:1稀释上清包被酶联免疫吸附板中的各孔, 每孔100 μL, 4℃过夜; 弃包被液体每孔加入120 μL封闭液, 4℃过夜; PBS-T洗3次, 每次5 min; 分别加入工作浓度的抗HGF mAb和抗VEGF多克隆抗体, 每孔100 μL, 37℃孵育1 h; PBS-T洗之; 分别加入辣根过氧化酶标记羊抗鼠IgG及辣根过氧化酶标记羊抗兔IgG, 每孔100 μL. 37℃孵育45 min; PBS-T洗之; 加入新鲜配制的OPD底物显色液, 每孔100 μL, 5-10 min避光显色后, 用2 mol/L H2SO4终止反应, 测波长490 nm处吸光度值. 同时用重组人HGF标准蛋白作一标准曲线, 以计算HGF的表达量.
1.2.4 组织基因组中真核表达载体启动子CMV: HGF组3次ig后, 第3天处死大鼠取肝、脾、肾、胃、小肠和大肠脏器, 用组织DNA提取试剂盒提取基因组DNA进行PCR反应, 上游引物为: 5'-CCCAGTACATGACCTTATGGG-3', 下游引物为: 5'-GGAGACTTGGAAATCCCCGT-3', 反应条件为: 94℃, 5 min, 94℃, 30 s, 55℃, 30 s, 72℃, 1 min, 72℃, 4 min, 30个循环, 15 g/L琼脂糖凝胶电泳观察.
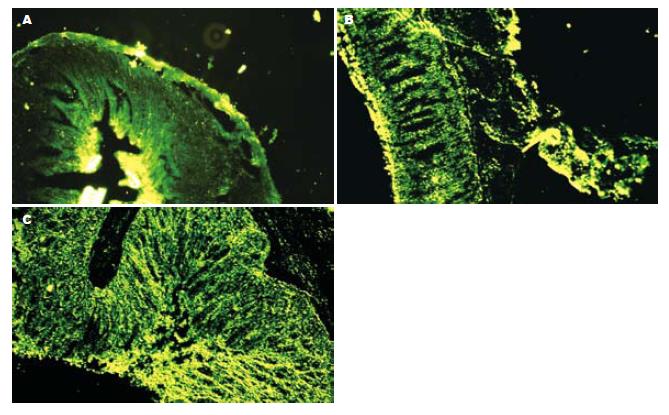
GFP组在ig后第1、3、5、7和9天大鼠的肝脏、肾脏、脾脏、胃、大肠和小肠中均可观察到GFP的表达, 其中以肝脏、胃、肠中表达较强(图1), 荧光强度在第5、7天较强, 第1、9天次之.
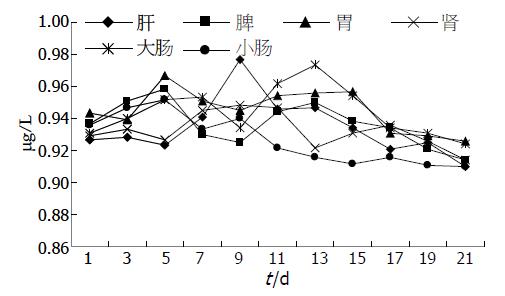
组织匀浆后用ELISA检测HGF水平, 结果如图2. 可以看到HGF蛋白在各组织均有表达, 但各组织的HGF蛋白表达水平略有不同: 肝、肾在第9天时表达量达到高峰, 胃、脾和小肠在第5天时表达量达到高峰, 大肠在第13天时表达量达到高峰. 随着时间推移表达量开始逐步下降, 直至第21天仍有少量表达.
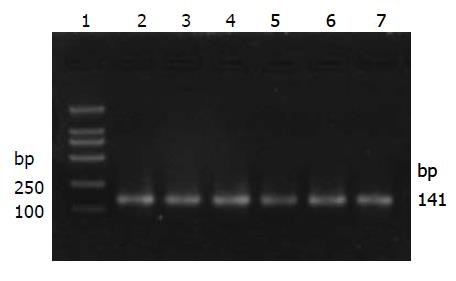
HGF实验组第1、3、5、7、9、11、13、15和17天大鼠主要脏器(胃、肝、脾、肾、大肠和小肠)组织基因组DNA中均可扩增出一个141 kb大小的片段, 第15天各组织基因组DNA中CMV的PCR扩增如图3, 与引物设计时所预计的扩增片段CMV大小相符, 说明减毒沙门氏菌将携带HGF基因的真核表达质粒转入了大鼠组织细胞的基因组中. 第19、21天大鼠各主要脏器中未扩增出的CMV片段.
本实验中, HGF治疗组大鼠各主要脏器组织(胃、肝、脾、肾、大肠和小肠)中可扩增出CMV片段, 表明减毒沙门氏菌可将外源HGF基因转入大鼠各组织器官中. 并且在胃、肠组织中具有较好的组织靶向性, 结合ELISA检测结果可以看出po后第5天表达量达到高峰, 正好与GFP组的表达和强度实验结果一致. 可以说明在大鼠胃溃疡治疗中, 减毒沙门氏菌作为细胞载体以po方式可将携带目的基因的真核表达载体相对靶向性转入胃、肠组织中. 为HGF基因药物的实际应用奠定实验基础和实验依据: (1)证明po给药的可行性; (2)证明了减毒沙门氏菌作为载体可以将HGF基因携带并转移到靶组织(胃、肠、肝和肾)发挥其治疗作用; (3)在胃肠组织中的表达量于第5天达到高峰, 为后续实验起到指导作用.
沙门氏菌是肠道病原菌, 是一种侵袭性胞内菌, 他与宿主之间的反应通过Ⅲ型分泌机制介导, 这种机制使细菌的效应蛋白转移到真核细胞[14-15], 沙门氏菌可以侵入肠上皮进入淋巴系统, 通过血液循环, 定居在脾脏和肝脏等器官[16], 诱发全身性针对外源抗原的体液免疫和细胞免疫. 通过基因工程方法减毒可降低其对宿主的致病性, 但仍保持良好的侵袭能力, 对黏膜组织有强嗜性. 减毒沙门氏菌已被实验性的用做外源抗原基因载体, 并已初步证明能直接将真核表达质粒携带进入动物细胞内, 表达相应的蛋白而诱发免疫反应. 由于已减毒最终被宿主清除.
近年来研究表明生长因子在细胞的增殖、运动、损伤修复、细胞外基质形成、血管形成、溃疡愈合及免疫调节等方面起重要作用. 已有研究表明, 表皮生长因子(epidermal growth factor, EGF)在溃疡病发病、治疗和抗复发方面均有一定意义, 国外已有基因重组的用于治疗溃疡病和烧伤的EGF制剂, 是一个有希望的新型黏膜保护剂[17]. 研究表明HGF: (1)可促进肠上皮细胞增殖, 减轻炎症细胞浸润, 促进胃肠道黏膜损伤愈合[9,18]; (2)HGF有强的促血管形成的功能, 局部应用HGF可促进胃肠局部血液供应, 减少氧自由基的产生, 从而减轻黏膜损伤, 促进损伤黏膜修复[19]; (3)HGF具有免疫调节作用, 通过诱导Th2细胞分泌细胞因子、抑制树突状细胞功能等来治疗自身免疫性疾病, 如系统性红斑狼疮、移植排斥反应和自身免疫性心肌炎等[20-21]. 肝细胞生长因子至今尚未批准用于任何一种疾病的治疗, 但他在病毒性肝炎、肿瘤、心血管疾病、组织黏膜修复、创伤愈合、胃肠道溃疡和神经保护等方面的作用已有较多的报道, 尤其是其在免疫性疾病治疗中的实验研究已是近年来研究的热点之一[9,18,22].
GFP是来自水母的一种基因报告分子也是一种全新的生物发光报告因子[23]. 他的生色团是包埋于完整GFP序列中重复出现的三肽Ser-Thyr-Gly组成的. 由于这个重组菌能够表达肉眼可见的绿色荧光蛋白, 所以菌落及菌液颜色均呈绿色. 同时由于GFP能够在紫外光或蓝光激发下发出明亮的绿色荧光, 因此可用FACS技术(流式细胞技术)、荧光显微镜等方法进行检测, 为此, 我们将GFP插入载体中构建重组质粒, 最后转入减毒鼠伤寒沙门氏菌中, 建立表达系统. 荧光强度是GFP在靶细胞中的表达量, 与感染靶细胞的病毒颗粒的多少呈正比关系. 目的基因HGF蛋白的表达与GFP荧光强度的表达变化基本一致.
大鼠乙酸性胃溃疡是一种慢性溃疡模型, 持续时间长, 短则10余天, 长则半年, 一般第60天左右可自然愈合, 大量研究表明此模型方法可靠, 重复性好, 溃疡深而大, 肉眼观和组织形态学观察均与人类的消化性溃疡非常相似[24], 所以我们采用王英[25]的乙酸致大鼠胃溃疡模型方法建立动物模型, 通过观察在大鼠胃溃疡基因治疗中, 减毒沙门氏菌作为细胞载体以po方式可以将携带目的基因HGF的真核表达载体相对靶向性转入胃肠组织中从而发挥其治疗作用. 有学者认为大鼠胃黏膜HGF mRNA分布于再生腺体与黏膜下组织动脉血管之间的基质细胞中, 其受体c-met mRNA则位于再生腺体上皮细胞, 提示HGF可能通过旁分泌机制在胃溃疡修复中发挥重要作用. HGF能使正常大鼠胃黏膜上皮细胞环氧化酶-2 mRNA和蛋白表达分别增加至236%和175%[25]. 环氧化酶-2系前列腺素合酶, 能促进前列腺素的合成, 而前列腺素对胃黏膜细胞具有保护作用, 能增加黏膜的血液循环, HGF也可能通过增加前列腺素合成促进胃溃疡的愈合.
基因治疗可能成为一些重大疾病如恶性肿瘤、心血管疾病、消化系统、神经系统疾病、传染病包括艾滋病等的有效治疗手段[26]. 而基因治疗用于临床所面临的最大问题就是如何建立一个安全、高效、实用、可重复的基因转移系统. 转移系统中基因转移载体的选择十分重要, 减毒沙门氏菌载体是基因治疗中广为应用的一种基因转移载体, 本实验中我们没有直接用HGF蛋白, 而是采用HGF基因治疗的方法, 并利用减毒沙门氏菌作为细胞载体, 目的是: (1)能够解决HGF蛋白直接应用存在的缺陷: 细胞因子蛋白制剂存在半衰期较短, 需要大剂量、反复给药才能维持局部较高的浓度. 有时即使重复应用也难以达到有效浓度, 应用蛋白制剂花费较高, 另外目前的纯化工艺对于人药用级生长因子蛋白的纯化还不是很成熟, 给临床治疗带来很大不便; (2)减少给药次数使损伤快速修复. 将基因携带在真核表达载体上, 并将其转移到损伤器官组织部位, 使组织成为"微型的药物工厂", 持续分泌一定时间的重组蛋白, 以达到治疗疾病的目的. 一次服用可以表达一定的时间, 从而减少用药次数缩短用药时间. (3)是利用减毒沙门氏菌可以po及提高机体免疫力的优势.
总之, 10多年的基因治疗临床试验已表明, 基因治疗不仅作为一个新的生物医学概念为人们所接受, 而且作为一种新的治疗手段和方法被广大研究人员和临床工作者所实践. 而且到目前为止所进行的多数研究表明, 基因治疗临床试验总体上是安全、有效和易于操作的.
胃溃疡是全球性多发病, 但目前各种疗法尚不能改变消化性溃疡的自然病程和彻底根治溃疡. 随着现代分子生物学技术的进步, 基因治疗各种疾病的可能性逐渐受关注. HGF是一种重要的靶基因之一, 有望利用其多种功能治疗各种疾病.
唐文富, 副主任医师, 四川大学华西医院中西医结合科
肝细胞生长因子至今尚未批准用于任何一种疾病的治疗. 但他在病毒性肝炎、肿瘤、心血管疾病, 胃溃疡和神经保护等方面的作用是近年研究的热点之一.
近年来研究表明生长因子在细胞的增殖、运动、损伤修复、细胞外基质形成、血管形成、溃疡愈合及免疫调节等方面起重要作用.
本实验没有直接用HGF蛋白, 而是采用HGF基因治疗的方法, 并利用减毒沙门氏菌作为细胞载体.
本实验为临床治疗胃溃疡提供一个可靠的方法, 即利用减毒沙门氏菌为细胞载体, 以口服方式将HGF基因携带并转移至损伤部位. 从而为HGF基因药物的实际应用奠定实验基础和依据.
本文有很强的创新性和可读性, 是目前研究的热点之一.
编辑: 程剑侠 电编:何基才
| 3. | Zahm JM, Debordeaux C, Raby B, Klossek JM, Bonnet N, Puchelle E. Motogenic effect of recombinant HGF on airway epithelial cells during the in vitro wound repair of the respiratory epithelium. J Cell Physiol. 2000;185:447-453. [PubMed] [DOI] |
| 4. | Awasthi V, King RJ. PKC, p42/p44 MAPK, and p38 MAPK are required for HGF-induced proliferation of H441 cells. Am J Physiol Lung Cell Mol Physiol. 2000;279:L942-L949. [PubMed] |
| 5. | van Adelsberg J, Sehgal S, Kukes A, Brady C, Barasch J, Yang J, Huan Y. Activation of hepatocyte growth factor (HGF) by endogenous HGF activator is required for metanephric kidney morphogenesis in vitro. J Biol Chem. 2001;276:15099-15106. [PubMed] [DOI] |
| 6. | Nakamura T, Mizuno S, Matsumoto K, Sawa Y, Matsuda H, Nakamura T. Myocardial protection from ischemia/reperfusion injury by endogenous and exogenous HGF. J Clin Invest. 2000;106:1511-1519. [PubMed] [DOI] |
| 7. | Murai R, Kanbe T, Mukoyama T, Shimomura T, Hashiguchi K, Yoshida Y, Tsuchiya H, Hoshikawa Y, Kurimasa A, Shiota G. Effect of rectal administration of rebamipide on dextran sulfate sodium-induced colitis: role of hepatocyte growth factor. Inflamm Res. 2007;56:240-245. [PubMed] [DOI] |
| 8. | Nanakin A, Fukui H, Fujii S, Sekikawa A, Kanda N, Hisatsune H, Seno H, Konda Y, Fujimori T, Chiba T. Expression of the REG IV gene in ulcerative colitis. Lab Invest. 2007;87:304-314. [PubMed] [DOI] |
| 9. | Kanbe T, Murai R, Mukoyama T, Murawaki Y, Hashiguchi K, Yoshida Y, Tsuchiya H, Kurimasa A, Harada K, Yashima K. Naked gene therapy of hepatocyte growth factor for dextran sulfate sodium-induced colitis in mice. Biochem Biophys Res Commun. 2006;345:1517-1525. [PubMed] [DOI] |
| 10. | Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi K, Tsubouchi H. Hepatocyte growth factor facilitates colonic mucosal repair in experimental ulcerative colitis in rats. J Pharmacol Exp Ther. 2003;307:146-151. [PubMed] [DOI] |
| 11. | Okunishi K, Dohi M, Fujio K, Nakagome K, Tabata Y, Okasora T, Seki M, Shibuya M, Imamura M, Harada H. Hepatocyte growth factor significantly suppresses collagen-induced arthritis in mice. J Immunol. 2007;179:5504-5513. [PubMed] |
| 12. | Kuroiwa T, Iwasaki T, Imado T, Sekiguchi M, Fujimoto J, Sano H. Hepatocyte growth factor prevents lupus nephritis in a murine lupus model of chronic graft-versus-host disease. Arthritis Res Ther. 2006;8:R123. [PubMed] [DOI] |
| 13. | Ha XQ, Yuan B, Li YM, Lao MF, Wu ZZ. Gene therapy for pathological scar with hepatocyte growth factor mediated by recombinant adenovirus vector. Science in China. 2003;46:320-327. |
| 14. | Kitamura S, Kondo S, Shinomura Y, Isozaki K, Kanayama S, Higashimoto Y, Minami T, Kiyohara T, Yasunaga Y, Ishikawa H. Expression of hepatocyte growth factor and c-met in ulcerative colitis. Inflamm Res. 2000;49:320-324. [PubMed] [DOI] |
| 15. | Figueroa-Bossi N, Uzzau S, Maloriol D, Bossi L. Variable assortment of prophages provides a transferable repertoire of pathogenic determinants in Salmonella. Mol Microbiol. 2001;39:260-271. [PubMed] [DOI] |
| 16. | Platt J, Sodi S, Kelley M, Rockwell S, Bermudes D, Low KB, Pawelek J. Antitumour effects of genetically engineered Salmonella in combination with radiation. Eur J Cancer. 2000;36:2397-2402. [PubMed] [DOI] |
| 17. | Sinha A, Nightingale J, West KP, Berlanga-Acosta J, Playford RJ. Epidermal growth factor enemas with oral mesalamine for mild-to-moderate left-sided ulcerative colitis or proctitis. N Engl J Med. 2003;349:350-357. [PubMed] [DOI] |
| 18. | Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi K, Tsubouchi H. Hepatocyte growth factor facilitates colonic mucosal repair in experimental ulcerative colitis in rats. J Pharmacol Exp Ther. 2003;307:146-151. [PubMed] [DOI] |
| 19. | Kuenzler KA, Pearson PY, Schwartz MZ. Hepatocyte growth factor pretreatment reduces apoptosis and mucosal damage after intestinal ischemia-reperfusion. J Pediatr Surg. 2002;37:1093-1097; discussion 1093-1097. [PubMed] [DOI] |
| 20. | Okunishi K, Dohi M, Nakagome K, Tanaka R, Mizuno S, Matsumoto K, Miyazaki J, Nakamura T, Yamamoto K. A novel role of hepatocyte growth factor as an immune regulator through suppressing dendritic cell function. J Immunol. 2005;175:4745-4753. [PubMed] |
| 21. | Skibinski G. The role of hepatocyte growth factor/c-met interactions in the immune system. Arch Immunol Ther Exp (Warsz). 2003;51:277-282. [PubMed] |
| 22. | Murai R, Kanbe T, Mukoyama T, Shimomura T, Hashiguchi K, Yoshida Y, Tsuchiya H, Hoshikawa Y, Kurimasa A, Shiota G. Effect of rectal administration of rebamipide on dextran sulfate sodium-induced colitis: role of hepatocyte growth factor. Inflamm Res. 2007;56:240-245. [PubMed] [DOI] |
| 25. | 展 玉涛, 王 宇. 肝细胞生长因子在一些疾病中的变化及意义. 国外医学·内科学分册. 2004;31:163-167. |