修回日期: 2008-03-29
接受日期: 2008-05-20
在线出版日期: 2008-05-28
目的: 探讨黄疸婴儿HCMV感染的诊断.
方法: FQ-PCR检测248例黄疸婴儿和50例对照组患儿尿液中HCMV DNA, 化学发光免疫分析法(CLIA)检测黄疸婴儿血清HCMV IgM抗体, 在尿液HCMV DNA阳性黄疸婴儿中, 比较血清HCMV IgM抗体阳性与阴性组HCMV DNA拷贝数的差异.
结果: 黄疸婴儿尿液HCMV DNA的阳性率为41.5%, 对照组患儿阳性率为2.0%, 两者有统计学意义(P<0.01). CLIA检测黄疸婴儿血清HCMV IgM抗体的阳性率为19.8%. 在尿液HCMV DNA检测阳性的黄疸患婴儿中, IgM抗体阳性组的尿液HCMV DNA拷贝数显著高于阴性组(t = 5.51, P<0.01).
结论: FQ-PCR检测尿液HCMV DNA是早期诊断婴儿HCMV感染的敏感有效的方法.
引文著录: 马艳萍, 吉耀华, 刘庆, 王继东, 何蓉, 齐莹, 孙峥嵘, 阮强. 黄疸婴儿人巨细胞病毒的检测. 世界华人消化杂志 2008; 16(15): 1704-1707
Revised: March 29, 2008
Accepted: May 20, 2008
Published online: May 28, 2008
AIM: To investigate the diagnosis of human cytomegalo virus (HCMV) infection in infants with jaundice.
METHODS: Urine specimens were collected from 248 infants with jaundice and 50 control infants without jaundice to detect HCMV DNA using fluorescence quantitative polymerase chain reaction (FQ-PCR). Blood samples were collected from infants with jaundice to detect HCMV IgM antibody using chemi-luminescent immunoassay(CLIA). Among HCMV DNA positive infants, quantitative levels of HCMV DNA were compared between HCMV IgM positive group and the negative group.
RESULTS: The FQ-PCR positive rate of the infants with jaundice (41.5%) was significantly higher than that of control infants (2.0%)(P < 0.01). CLIA positive rate of the infants with jaundice was 19.8%. HCMV DNA of the HCMV IgM positive group were significantly higher than that of the negative group (t = 5.51, P < 0.01).
CONCLUSION: FQ-PCR is a sensitive and effective test for early diagnosis of HCMV infection in infants.
- Citation: Ma YP, Ji YH, Liu Q, Wang JD, He R, Qi Y, Sun ZR, Ruan Q. Detection of human cytomegalo virus in infants with jaundice. Shijie Huaren Xiaohua Zazhi 2008; 16(15): 1704-1707
- URL: https://www.wjgnet.com/1009-3079/full/v16/i15/1704.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i15.1704
婴儿黄疸根据发生的机制和部位分为肝前性黄疸、肝细胞性黄疸和肝后性黄疸. 后两者主要是肝细胞和肝内外胆管的病变, 造成直接胆红素或间接胆红素增高[1]. 临床上多种因素引起婴儿黄疸, 研究表明, 人巨细胞病毒(human cytomegalo virus, HCMV)可侵犯肝细胞和肝内外胆管系统, 是婴儿黄疸的重要病原之一[2-4], 因此早期诊断黄疸患儿是否为HCMV感染, 是正确实施治疗, 减轻黄疸症状的前提. 本研究采用荧光定量PCR方法检测婴儿尿液HCMV DNA含量, 结合血清HCMV IgM抗体检测, 探讨黄疸婴儿HCMV感染的诊断.
2005-07/2007-06中国医科大学附属盛京医院住院的黄疸患儿248例, 50例来自小儿外科无黄疸症状的住院患儿作为对照, 所有患儿年龄为3 wk-12 mo. HCMV DNA荧光定量试剂盒为中山医科大学达安基因诊断公司产品, 包括DNA提取液, 单人单管反应液, HCMV标准阳性模板, 阴性对照. 荧光定量检测仪(PE-7700)为美国PE公司生产. 化学发光免疫分析法(CLIA)试剂为意大利Sorin公司原装进口. 意大利Sorin公司生产Liaison化学发光免疫分析仪.
1.2.1 标本采集: 在知情同意的情况下, 采集所有被检验者静脉血2 mL, 离心分离血清, 4℃保存, 24 h内进行HCMV IgM检测. 同时, 留取所有被检验者尿液5-10 mL, -20℃保存, 24 h内进行HCMV DNA检测.
1.2.2 化学发光免疫分析法: 异鲁米诺-抗体复合物与结合在固相载体上的HCMV IgM反应. 加入启动试剂, 引发化学发光反应, 产生光信号. 异鲁米诺-抗体数量和光单位成正比. 通过计算, 得到校准品、样品或质控品中HCMV IgM的浓度.
1.2.3 FQ-PCR测定: 选用HCMV AD169株基因组中编码即刻早期转录调节蛋白的IE1基因的一段高度保守的非编码区为扩增靶序列, 长度为86 bp. 引物: P1 5'TGGGCTAACTATGCAGAGCA 3', P2 5'AGCCATTGGTGGTCTTAGGG3'. 在PCR反应中, 利用Taq酶5'-3'外切酶活性将荧光探针切断, 通过荧光值的变化, 利用阳性标准品制成的标准曲线进行定量. 反应体系50 µL, 同时设置不加模板的阴性对照. 扩增条件: 93℃ 2 min, 93℃ 45 s, 55℃ 1 min, 10个循环; 93℃ 30 s, 55℃ 45 s, 30个循环. 计算机对整个PCR反应过程中荧光量进行实时检测, 当反应结束时自动绘制出每个被检对象的PCR扩增曲线, 通过与标准品的扩增曲线比较进行定量.
统计学处理 SPSS13.0软件进行χ2检验, 偏态分布中位数、四分位数比较和正态分布t检验, P值取0.01.
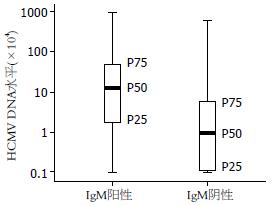
248例患儿尿液中HCMV DNA定量检测阳性103例, 阳性率为41.5%. 50例对照组患儿尿液中HCMV DNA定量检测阳性仅有1例, 阳性率为2.0%. 两组患儿阳性率比较具有显著差异(χ2 = 30.51, P<0.01). 248例患儿血清中HCMV IgM抗体检测阳性49例, 阳性率为19.8%. HCMV IgM抗体检测阳性患儿中有47例尿液HCMV DNA定量检测阳性, 2例阴性. 根据血清HCMV IgM抗体结果, 将FQ-PCR方法检测尿液HCMV DNA阳性的103例患儿分为IgM阳性组与阴性组. IgM阳性组患儿47例, 尿液HCMV DNA拷贝数为1.00×103-95.78×106, 中位数(P50)为1.23×105, 下四分位数(P25)为1.72×104, 上四分位数(P75)为5.41×105, IgM阴性组患儿56例, 尿液HCMV DNA拷贝数为1.00×103-6.04×106, 中位数P50为9.43×104, P25为1.11×103, P75为5.94×104. 与IgM阴性组比较, IgM阳性组患儿尿液HCMV DNA拷贝数分布在较高水平(图1). 两组尿液HCMV DNA拷贝数对数值log10X呈正态分布, IgM阳性组均值为5.04±1.01, IgM阴性组均值为4.23±0.99. 两组对数值均值比较具有显著差异(t = 5.51, P<0.01, 表1).
| 分组 | n | 均值 | 标准差 | 标准误 | 最小值 | 最大值 |
| IgM阳性组 | 47 | 5.04 | 1.03 | 0.12 | 3.00 | 6.99 |
| IgM阴性组 | 56 | 4.23 | 0.99 | 0.11 | 3.00 | 6.79 |
本研究采用FQ-PCR法检测黄疸婴儿尿液中的HCMV DNA. 结果在248例黄疸婴儿中103为阳性, 阳性率达到41.5%. 而来自对照组患儿的阳性率仅为2%, 两者比较具有非常显著的统计学差异(P<0.001), 从而进一步支持CMV感染是婴儿黄疸的重要病因之一.
由于HCMV感染后在体内长期存在, 具有潜伏和再活化的生物学特性[5]. 因此区分HCMV潜伏感染与活化感染临床治疗和判断预后至关重要. 目前我国主要以间接ELISA法检测血清 HCMV IgM抗体为实验室诊断指标[6-7]. IgM阳性提示近期有HCMV活动性感染或潜伏的病毒可能被激活. 本研究采用的CLIA方法检测血清HCMV IgM抗体, 阳性率为19.8%, 敏感性高于ELISA法[8]. 但是, HCMV抗体的产生有一段"窗口期", 由于IgM抗体产生本身具有滞后性, 当患者被病原体感染约2 wk后IgM抗体才能达到被检测到的水平, 而依据患者机体免疫力的不同, 此时病原体有可能已被机体免疫反应抑制而处于潜伏感染状态. 另一方面, 有些患者, 尤其是部分婴幼儿, 免疫系统发育尚不完善, 不能产生被测数量的特异性IgM抗体或滞后产生IgM抗体, 易造成假阴性结果. 因此, 不能单独依靠血清IgM抗体检测判断是否存在HCMV活动性感染.
FQ-PCR是目前最为准确和快速的微生物定量方法[9-10], 能更早检测到病毒感染, 甚至比出现临床症状的时间提前3-10 d[11]. 有研究采用定量PCR技术检测外周血细胞和脑脊液中HCMV DNA含量, 能够从HCMV DNA水平的多少来鉴别潜伏性感染和活动性感染, 对诊断活动性HCMV感染及潜伏性HCMV感染有确诊意义[12-15]. 而HCMV感染后, 局部排毒量与机体内病毒量密切相关, 检测尿中HCMV量可很好反映机体内HCMV病毒量[11-13], 而且取材方便, 无创, 易为家长和小儿接受. 在本研究, 49例患儿HCMV IgM检测阳性, 表明存在HCMV活动性感染, 期中47例患儿FQ-PCR检测尿HCMV DNA为阳性, 说明FQ-PCR检测对于HCMV活动性感染的诊断具有很好的敏感性; 2例阴性可能与HCMV尿液间歇排毒有关, 也可能感染已被抑制, 而抗体消除滞后. 有56例患儿尿液HCMV DNA检测阳性, 而血清HCMV IgM抗体检测阴性. 其中有3例患儿2 wk后复查IgM抗体结果转为阳性. 由于IgM阴性组存在较低水平的HCMV DNA, 排除个别免疫应答异常者外, 这些患者中大多数尚处于感染早期, 说明FQ-PCR检测对于HCMV感染的早期诊断和HCMV性疾病预防具有重要意义. 两组患儿尿HCMV DNA拷贝数对数值呈正态分布, 对数值的均值比较具有统计学意义, IgM阳性患儿显著高于IgM阴性患儿, 符合活动性HCMV感染者的病毒量显著高于非活动性感染者这一事实. 但是, 由于两组患儿尿HCMV DNA拷贝数重叠范围很大, 尚不能确定明确的DNA拷贝数界限来预测HCMV活动性感染. 本研究结果显示血清HCMV IgM阳性患儿中75%的患儿大于1.72×104, 血清HCMV IgM检测阴性患儿中75%的患儿小于5.94×104, IgM阳性患儿尿HCMV DNA拷贝数分布在较高水平. 因此, FQ-PCR检测尿液中HCMV DNA量对于判断是否为HCMV活动性感染能够具有一定意义. 对于血清HCMV IgM抗体检测阴性而尿HCMV DNA拷贝数较高的黄疸患儿, 应间隔一段时间重复检测血清HCMV IgM抗体, 或根据临床症状判断是否存在HCMV活动性感染.
人巨细胞病毒可造成感染患儿的多器官、多系统受累. 黄疸是消化系统受累的最常见的临床表现, 抗病毒治疗可以有效地改善病情. 因此检测黄疸患儿的人巨细胞病毒, 对于临床治疗具有重要意义.
张明辉, 副主任医师, 河北医科大学第一医院肝病中心(传染病).
人巨细胞病毒在感染患儿中的致病机制一直是该研究领域的热点. 病毒的基因及编码产物的功能以及与致病性的关系尚在研究当中.
本文比较了荧光定量PCR方法检测黄疸患儿活动性巨细胞病毒感染和非活动性感染尿液中的病毒拷贝数, 就荧光定量PCR方法对黄疸患儿巨细胞病毒感染的检测进行了较深入的分析评价.
本文材料组织较好, 语言流畅, 统计合理、规范, 但学术价值一般.
编辑: 李军亮 电编:何基才
| 2. | Munro SC, Trincado D, Hall B, Rawlinson WD. Symptomatic infant characteristics of congenital cytomegalovirus disease in Australia. J Paediatr Child Health. 2005;41:449-452. [PubMed] [DOI] |
| 4. | Leung AK, Sauve RS, Davies HD. Congenital cytomegalovirus infection. J Natl Med Assoc. 2003;95:213-218. [PubMed] |
| 7. | Zhang C, Shen K, Jiang Z, He X. Early diagnosis and monitoring of active HCMV infection in children with systemic lupus erythematosus. Chin Med J (Engl). 2001;114:1309-1312. [PubMed] |
| 8. | 吉 耀华, 王 岳平, 阮 强, 王 继东, 刘 庆, 陈 淑荣, 孙 峥嵘, 何 蓉, 齐 莹, 马 艳萍. CLIA和ELISA检测婴儿肝病综合征患者人巨细胞病毒特异性IgM抗体的比较. 临床儿科杂志. 2007;25:532-536. |
| 9. | Mackay IM. Real-time PCR in the microbiology laboratory. Clin Microbiol Infect. 2004;10:190-212. [PubMed] [DOI] |
| 10. | Gokahmetoglu S, Deniz E. Comparison of real-time, and qualitative polymerase chain reaction assays in detection of cytomegalovirus DNA in clinical specimens. Saudi Med J. 2007;28:1658-1661. [PubMed] |
| 11. | Risatti GR, Callahan JD, Nelson WM, Borca MV. Rapid detection of classical swine fever virus by a portable real-time reverse transcriptase PCR assay. J Clin Microbiol. 2003;41:500-505. [PubMed] [DOI] |
| 12. | Wildemann B, Haas J, Lynen N, Stingele K, Storch-Hagenlocher B. Diagnosis of cytomegalovirus encephalitis in patients with AIDS by quantitation of cytomegalovirus genomes in cells of cerebro-spinal fluid. Neurology. 1998;50:693-697. [PubMed] |
| 13. | Schäfer P, Laufs R. Experience with quantitative PCR for the management of HCMV disease. Intervirology. 1996;39:204-212. [PubMed] |
| 14. | Ferreira-Gonzalez A, Fisher RA, Weymouth LA, Langley MR, Wolfe L, Wilkinson DS, Garrett CT. Clinical utility of a quantitative polymerase chain reaction for diagnosis of cytomegalovirus disease in solid organ transplant patients. Transplantation. 1999;68:991-996. [PubMed] [DOI] |
| 15. | Fox JC, Griffiths PD, Emery VC. Quantification of human cytomegalovirus DNA using the polymerase chain reaction. J Gen Virol. 1992;73:2405-2408. [PubMed] [DOI] |