修回日期: 2008-04-07
接受日期: 2008-05-20
在线出版日期: 2008-05-28
目的: 探讨小檗碱对高果糖饲养诱导胰岛素抵抗大鼠肝细胞核因子(hepatocyte nuclear factor-4α, HNF-4α)表达的影响以及其改善胰岛素抵抗的分子机制.
方法: 高果糖饲料喂养SD大鼠6 wk, 建立胰岛素抵抗模型; 大鼠分为4组: 正常对照组(普通饮食)、普通饮食+小檗碱处理组、高果糖饮食组及高果糖饮食+小檗碱组; 小檗碱按187.5 mg/(kg•d)灌服4 wk; 测定血糖、血清胰岛素、胰岛素抵抗指数及甘油三酯的变化; 用RT-PCR法及免疫印迹法观察肝脏HNF-4α基因及蛋白的表达.
结果: 高果糖饮食组胰岛素、胰岛素抵抗指数HOMA及甘油三酯水平较正常对照组均明显升高(均P<0.01), 而高果糖饮食+小檗碱组与高果糖饮食组比较上述指标明显下降(51.62±5.68 vs 64.91±7.87, P<0.01; 12.40±1.76 vs 16.06±3.32, P<0.01; 11.16±1.58 vs 14.46±2.99, P<0.05), 小檗碱可促使肝脏表达下降的HNF-4α恢复.
结论: 小檗碱可改善胰岛素抵抗, 其机制可能与促进HNF-4α的表达有关.
引文著录: 高志强, 陆付耳, 冷三华, 谢美娟, 徐丽君, 王开富, 邹欣. 小檗碱对高果糖饲养诱导胰岛素抵抗大鼠肝组织HNF-4α表达的影响. 世界华人消化杂志 2008; 16(15): 1681-1684
Revised: April 7, 2008
Accepted: May 20, 2008
Published online: May 28, 2008
AIM: To investigate the effects of berberine on the expression of hepatocyte nuclear factor-4α (HNF-4α) in rats with fructose-induced insulin resistance.
METHODS: SD rats were given high-fructose diet for 6 wk, All rats were divided into 4 groups: control group, common diet + berberine group, high-fructose diet group and high-fructose diet + berberine group. Berberine was given (187.5 mg/kg per day). After the experimental period of 10 wk, Plasma glucose, insulin and triglyceride levels were measured. HOMA insulin resistance index (HOMA-IR) was assayed. Furthermore, RT-PCR and Western Blot were used to detect and analyze the expression of HNF-4α and protein in liver.
RESULTS: Compared with control diet, fructose feeding induced hyperinsulinemia, higher HOMA-IR and raised triglyceride (all P < 0.01). Compared with fructose-fed rats, indicators above decreased significantly in the high-fructose diet + berberine group (51.62 ± 5.68 vs 64.91 ± 7.87, P < 0.01; 12.40 ± 1.76 vs 16.06 ± 3.32, P < 0.01; 11.16 ± 1.58 vs 14.46 ± 2.99, P < 0.05). The mRNA and protein expression of HNF-4a was decreased in the fructose-fed rats, while berberine promoted its expression.
CONCLUSION: Berberine improves fructose-induced insulin resistance probably by increasing HNF-4a expression.
- Citation: Gao ZQ, Lu FE, Leng SH, Xie MJ, Xu LJ, Wang KF, Zou X. Effects of berberine on the expression of hepatocyte nuclear factor-4α in rats with fructose-induced insulin resistance. Shijie Huaren Xiaohua Zazhi 2008; 16(15): 1681-1684
- URL: https://www.wjgnet.com/1009-3079/full/v16/i15/1681.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i15.1681
肝细胞核因子4α(hepatocyte nuclear factor-4α, HNF-4α)是一种具有锌指结构的转录因子, 在肝脏高水平表达, 参与糖脂代谢及胰岛素分泌的调控[1]. HNF-4α与2型糖尿病关系密切, 且胰岛素抵抗(insulin resistance, IR)大鼠肝脏HNF-4α表达减少[2]. 小檗碱又名黄连素, 是一类异喹啉类生物碱, 作为抗菌药用于临床多年, 近年发现他还有降压、降血糖、调脂及改善IR等药理作用, 而受到医学界的重视, 但对其改善IR作用机制研究尚少, 本实验拟在前期实验的基础上进一步研究其对肝组织HNF-4α表达的影响[3-6].
清洁级SD大鼠, ♂, 32只, 周龄6 wk, 体质量180±10 g, 购自华中科技大学同济医学院实验动物中心. 小檗碱购自中国药品生物制品检定所(批号: 1107132200218), 用5 g/L羧甲基纤维素的PBS溶液配制的混悬液溶解成含药混悬液, 果糖为美国ADM公司产品(批号: IL62525); 猪油为市售; 酪蛋白、蛋氨酸、维生素及矿物质等购自武汉医药公司, 血糖与血脂测定试剂盒均购自南京建成生物工程研究所; 胰岛素试剂盒购自北京原子能生物研究所. Tri Reagent试剂购自Molecular Research Center, RT-PCR试剂为Fermentas公司产品. 免疫印迹主要试剂: HNF-4α多克隆抗体(Santa Cruze, USA), Rabbit anti Goat IgG-HRP(武汉博士德生物工程有限公司), GAPDH多克隆抗体(北京博奥森科技发展有限公司), Goat anti mouse IgG-HRP(武汉博士德生物工程有限公司), ECL试剂盒(Sigma, USA).
1.2.1 分组及造模: 大鼠适应性饲养1 wk后, 随机分为普通饮食组和高果糖饮食组, 每组16只, 喂以普通饲料(碳水化合物60%, 粗蛋白20%-21%,粗脂肪5%, 质量比); 后者喂以高果糖饲料(果糖60%, 酪蛋白20%, 脂肪5%, 质量比, 造模方法参考文献[7]), 第7周后, 普通饮食组随机分为正常对照组(C组)和小檗碱处理组(B组), 继续普通饮食; 高果糖饮食组分为高果糖饮食组(F组)和小檗碱处理组(FB组)继续高果糖饮食. 以上每组均8只. 所有大鼠均全程自由饮水. 所有小檗碱处理组均以小檗碱187.5 mg/(kg•d)(配制成10 mL/kg体质量)ig; 所有对照组均按体质量以同等体积5 g/L羧甲基纤维素PBS溶液ig. 第11周, 禁食12 h后以10 g/L戊巴比妥钠45 mg/kg体质量ip进行麻醉, 腹主动脉取血, 分离血清, 用于检测各项生化指标, 另取肝脏迅速冻存于液氮中, 24 h后置于-80℃冰箱以待测其他指标, 并处死所有大鼠.
1.2.2 血糖、胰岛素及甘油三酯检测: 血糖(Glu)用葡萄糖氧化酶法测定, 血清胰岛素(Fins)用放免法测定, 甘油三酯(TG)用酶学方法检测, 具体操作步骤按试剂盒说明书严格操作. 胰岛素抵抗指数[8]: HOMA-IR = 空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22.5.
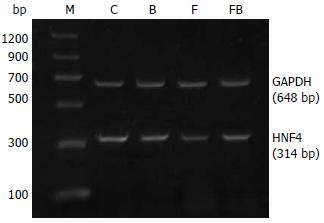
1.2.3 RT-PCR: 取大鼠肝脏标本, 使用Tri Reagent试剂盒, 一步法提取总RNA, 以紫外分光光度仪检测RNA含量与纯度, 取A260/A280在1.8-2.0之间的RNA进行实验. 引物由上海生物工程公司合成, 序列设计如下: HNF-4α上游5'GGTGCCAACCTCAACTCA 3'; 下游5'AGGCTGCTGTCCTCGTAG 3', 扩增片段长度为314 bp. 为相对定量mRNA的表达量, 采用GAPDH为内参照, 上游: 5' GATCCCGCTAACATCAAAT 3'; 下游: 5' ATCAAAGGTGGAAGAATGG 3', 扩增片段长度为648 bp. 取1 μg RNA经逆转录合成单链cDNA后, 继以PCR, HNF-4α扩增条件为94℃变性5 min后进行30个循环, 每个循环94℃变性1 min, 57℃退火50 s, 72℃延伸50 s, 72℃终末延伸10 min. GAPDH扩增条件为94℃变性5 min后进行28个循环, 每个循环94℃变性1 min, 54℃退火1 min, 72℃延伸1 min. 72℃终末延伸10 min. 扩增产物以20 g/L琼脂糖电泳, 紫外透射分析仪观察结果, 凝胶成像分析系统进行光密度扫描. 结果以HNF-4α/GAPDH mRNA灰度比值为指标进行统计分析.
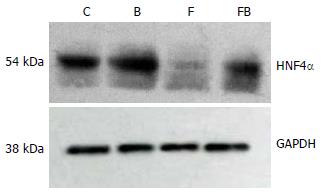
1.2.4 免疫印迹法: 组织蛋白提取与蛋白定量: 参照Santa Cruz公司提供的方法, 应用三去污裂解液裂解组织, 提取蛋白行考马斯亮蓝G-250染色法定量; 每例标本经120 g/L聚丙烯凝胶电泳分离后, 根据预染Marker指示按HNF-4α和GAPDH分子量大小分别取相应凝胶电转移至硝酸纤维素膜膜上, 置于5%脱脂奶粉封闭液, 室温摇床温育2 h, 再相应分别置于HNF-4α多克隆抗体稀释液(工作浓度1:1000)和GAPDH多克隆抗体稀释液(工作浓度1:300)4℃孵育过夜, 次日TBS-T洗膜后分别置于Goat anti rat IgG-HRP二抗(工作浓度1:5000)和Goat anti mouse IgG-HRP二抗(工作浓度1:5000)摇床温育2 h和进行杂交ECL化学发光, 活体凝胶成像系统分析每条带的吸光度值, 将HNF-4α/GAPDH的比值作为HNF-4α蛋白的相对表达量.
统计学处理 采用SPSS11.0统计软件进行分析, 各组计量资料以mean±SD表示.
各组之间Glu差异没有显著性意义, F组Fins、HOMA-IR及TG均比C组显著增高; B组及FB组上述指标比F组显著降低; B组与C组比较, 各指标差异无显著性(表1).
C组、B组、F组及FB组的HNF-4α吸光度值比分别为: 1.39±0.27, 1.25±0.12, 0.68±0.24, 1.04±0.14; F组mRNA表达水平明显低于C组(P<0.01), FB组明显高于F组(P<0.05, 图1).
利用高果糖饮食诱导大鼠IR的造模方法被国外实验室广泛应用, 模型稳定, 被国外同行所接受. 该方法诱导的大鼠具有显著的高胰岛素血症与高甘油三酯血症, 外周胰岛素敏感性明显下降, 是研究药物改善IR机制的良好实验模型[9-13]. 本实验证实果糖组大鼠具有明显的高胰岛素血症, HOMA-IR较正常对照组明显升高, 血清TG显著增加, 成功复制出IR模型, 为研究小檗碱作用机制提供可靠的基础.
HNF-4α属类固醇激素受体超家族的孤儿受体, 其特征是含有2个高度保守的区域, 即位于氨基端的含2个"锌指基序"的DNA结合区和位于羧基端的配体结合区, 分子量约54 kDa, 在肝脏、肾脏、消化道上皮均有较多表达, 在胰岛较低水平表达. HNF-4α是肝脏最重要的转录因子之一, 具有脂溶性激素受体的特性, 直接进入细胞核, 调节基因转录, 从而调控机体的各种生理活动. 他是葡萄糖转运蛋白2、醛缩酶B、丙酮酸激酶基因表达所必需的; HNF-4α还可与糖异生途径中限速酶之一的丙酮酸羧激酶基因启动子区的糖皮质激素反应单元相互作用; HNF-4α可抑制肝糖异生, 促进葡萄糖摄取以及促进糖酵解等作用参与血糖调节. 成人体内HNF-4α的缺乏还影响脂类合成, 且与血清TG和脂蛋白水平改变有关. 故HNF-4α在肝脏IR的发生机制中有重要的作用[14-17]. 肝脏作为调节血糖平衡的主要外周器官, 研究HNF-4α在肝脏的表达具有科学意义.
本实验首次研究HNF-4α在小檗碱改善IR中的作用. 实验数据显示, 长期高果糖饮食诱导实验大鼠产生IR; 同时伴有HNF-4α在肝脏mRNA及蛋白水平的表达明显降低, 这与文献报道IR大鼠HNF-4α表达降低相一致[2,18-19]. 而小檗碱可增强IR大鼠肝脏HNF-4α mRNA及蛋白表达, 改善IR大鼠的高胰岛素血症, 胰岛素抵抗指数明显降低, 提示了HNF-4α是小檗碱的药理效应中的重要一环, 有资料表明, 小檗碱能上调或下调大鼠多种肝脏代谢相关基因表达变化[20-21], 故推测HNF-4α很可能是小檗碱直接作用的一个新靶点.
有文献报道小檗碱可进入细胞核内[22], 与靶因子结合, 产生生物学效应, 至于小檗碱在细胞核内的具体作用方式, 从而引发诸如增强外周胰岛素敏感性, 抗氧化、清除自由基的功能, 尚有待进一步研究.
HNF-4α具有脂溶性激素受体的特性, 能够直接进入胞核调节基因转录, 从而对机体的各种生理活动进行调控, 是糖及脂类等能量物质代谢所必需的调控因子, 其基因突变可诱发青少年发病型成人糖尿病.
周霞秋, 主任医师, 上海瑞金医院感染科.
小檗碱具有多重生物学功能, 但其机制尚不清楚. 在分子水平对转录因子HNF-4α的研究, 有望将目前国内外研究成果与其功能进行一定的衔接.
国外Daphna et al报道, HNF-4α基因变异患者常伴发高脂血症, 糖耐量异常和(或)胰岛素抵抗; 国内吴静 et al报道, 胰岛素抵抗大鼠存在肝脏HNF-4α表达降低, 充分提示了HNF-4α在胰岛素抵抗病理生理学机制中的重要地位.
本实验以高果糖饲养诱导胰岛素抵抗, 模型稳定, 国际认可度高. 重点研究小檗碱对HNF-4α的作用, 能较好的解释其改善胰岛素抵抗效应.
对小檗碱分子改善胰岛素抵抗机制的深入研究, 有助于彻底阐明其作用机制, 对推动中医药的发展具有重要意义.
本文发现小檗碱能够上调高果糖饲养诱导胰岛素抵抗大鼠肝脏HNF-4a表达, 可能是其改善胰岛素抵抗的主要机制, 是其药理作用研究的新进展, 有较好的学术价值.
编辑: 李军亮 电编:郭海丽
| 3. | Leng SH, Lu FE, Xu LJ. Therapeutic effects of berberine in impaired glucose tolerance rats and its influence on insulin secretion. Acta Pharmacol Sin. 2004;25:496-502. [PubMed] |
| 4. | 刘 锋, 冷 三华, 陆 付耳, 官 纯寿, 高 志强, 徐 丽君, 王 开富. 小檗碱对HepG2细胞肝细胞核因子基因表达的影响. 中国中西医结合消化杂志. 2007;15:141-144. |
| 7. | Hsieh PS. Reversal of fructose-induced hypertension and insulin resistance by chronic losartan treatment is independent of AT2 receptor activation in rats. J Hypertens. 2005;23:2209-2217. [PubMed] |
| 8. | Olatunji LA, Soladoye AO. Increased magnesium intake prevents hyperlipidemia and insulin resistance and reduces lipid peroxidation in fructose-fed rats. Pathophysiology. 2007;14:11-15. [PubMed] |
| 9. | Prieto PG, Cancelas J, Moreno P, Villanueva-Penacarrillo ML, Malaisse WJ, Valverde I. Effects of diet supplementation with olive oil and guar upon fructose-induced insulin resistance in normal rats. Endocrine. 2007;31:294-299. [PubMed] |
| 10. | Lin HJ, Loh CH, Liao MT, Liu TT, Hsieh PS. Attenuation of hypertriglyceridemia-induced pressor effect in rats with fructose-induced insulin resistance. Chin J Physiol. 2007;50:16-21. [PubMed] |
| 11. | Hsieh PS, Cheng WT, Liu TT, Loh CH, Chang BC. Diminution of hypertriglyceridemia-induced pressor effect under hyperinsulinemic condition in normal and fructose-induced insulin resistant rats. Chin J Physiol. 2007;50:99-104. [PubMed] |
| 12. | Suganthi R, Rajamani S, Ravichandran MK, Anuradha CV. Effect of food seasoning spices mixture on biomarkers of oxidative stress in tissues of fructose-fed insulin-resistant rats. J Med Food. 2007;10:149-153. [PubMed] |
| 13. | Ai J, Wang N, Yang M, Du ZM, Zhang YC, Yang BF. Development of Wistar rat model of insulin resistance. World J Gastroenterol. 2005;11:3675-3679. [PubMed] |
| 14. | Love-Gregory L, Permutt MA. HNF4α genetic variants: role in diabetes. Curr Opin Clin Nutr Metab Care. 2007;10:397-402. [PubMed] |
| 15. | Roth U, Curth K, Unterman TG, Kietzmann T. The transcription factors HIF-1 and HNF-4 and the coactivator p300 are involved in insulin-regulated glucokinase gene expression via the phosphatidylinositol 3-kinase/protein kinase B pathway. J Biol Chem. 2004;279:2623-2631. [PubMed] |
| 16. | Prieur X, Schaap FG, Coste H, Rodriguez JC. Hepatocyte nuclear factor-4αlpha regulates the human apolipoprotein AV gene: identification of a novel response element and involvement in the control by peroxisome proliferator-activated receptor-gamma coactivator-1alpha, AMP-activated protein kinase, and mitogen-activated protein kinase pathway. Mol Endocrinol. 2005;19:3107-3125. [PubMed] |
| 17. | Sanguino E, Roglans N, Alegret M, Sanchez RM, Vazquez-Carrera M, Laguna JC. Atorvastatin reverses age-related reduction in rat hepatic PPARalpha and HNF-4. Br J Pharmacol. 2005;145:853-861. [PubMed] |
| 18. | Xu C, Arinze IJ, Johnson J, Tuy TT, Bone F, Ernsberger P, Massillon D. Metabolic dysregulation in the SHROB rat reflects abnormal expression of transcription factors and enzymes that regulate carbohydrate metabolism. J Nutr Biochem. 2008;19:305-312. [PubMed] |
| 20. | 辛 华雯, 吴 笑春, 李 罄, 余 爱荣, 张 勤, 仲 明远, 朱 敏, 刘 幼英. 盐酸小檗碱致大鼠肝脏代谢相关基因表达变化的基因芯片研究. 中国药理学通报. 2004;20:1122-1126. |
| 21. | Brusq JM, Ancellin N, Grondin P, Guillard R, Martin S, Saintillan Y, Issandou M. Inhibition of lipid synthesis through activation of AMP kinase: an additional mechanism for the hypolipidemic effects of berberine. J Lipid Res. 2006;47:1281-1288. [PubMed] |
| 22. | Ovadekova R, Jantova S, Letasiova S, Stepanek I, Labuda J. Nanostructured electrochemical DNA biosensors for detection of the effect of berberine on DNA from cancer cells. Anal Bioanal Chem. 2006;386:2055-2062. [PubMed] |