修回日期: 2008-04-02
接受日期: 2008-05-20
在线出版日期: 2008-05-28
目的: 研究胃泌素及胃泌素受体拮抗剂丙谷胺对肝癌细胞株的增殖的影响, 并探讨肝癌患者非细胞毒内分泌治疗的可能性.
方法: 采用MTT比色分析法研究在不同浓度胃泌素和其受体拮抗剂丙谷胺的干预下, 4种人肝癌细胞株的增殖情况, 选取1种细胞株, 用流式细胞仪分析在胃泌素及丙谷胺作用下的周期分布.
结果: 胃泌素在接近生理浓度下促进QGY-7701和Bel-7402的增殖, 丙谷胺对胃泌素的作用有抑制作用. 过量的胃泌素对QGY-7701有抑制效果. 胃泌素对HepG2和SMMC-7721无明显促增殖作用. 丙谷胺在高浓度下对所有细胞株皆有明显的抑制作用. 胃泌素可促使Bel-7402 G0/G1期细胞向S、G2/M期转化, 加用丙谷胺后胃泌素的上述作用消失.
结论: 胃泌素对肝癌细胞株有促增殖作用及促进DNA合成, 丙谷胺对其有抑制作用, 可能成为肝癌内分泌辅助治疗的一个新的途径.
引文著录: 江春平, 孔诚, 丁义涛. 胃泌素及其受体拮抗剂丙谷胺对肝癌细胞株生长的影响. 世界华人消化杂志 2008; 16(15): 1677-1680
Revised: April 2, 2008
Accepted: May 20, 2008
Published online: May 28, 2008
AIM: To determine the effects of gastrin and its receptor antagonist proglumide on the proliferation of hepatoma cell lines, and to evaluate the possibility of non-cytotoxic therapy for liver cancers.
METHODS: The vitality and cycle distribution of 4 liver cancer cell lines treated with gastrin and proglumide were analyzed using MTT colorimetric assay and flow cytometry.
RESULTS: Gastrin significantly stimulated the proliferation of QGY-7701 and Bel-7402 at a concentration approximate to physiological levels, and shifted G0/G1 phase to S, G2/M phase of Bel-7402 ,which could be blocked by gastrin receptor antagonist proglumide. And excessive gastrin exerted inhibitory effect on QGY-7701. However, Gastrin had no effect on HepG2 and SMMC-7721 cell lines. Proglumide at a high concentration significantly inhibited all cell lines.
CONCLUSION: Gastrin can promote proliferation of liver cancer cells and DNA synthesis while Proglumide inhibit gastrin. Gastrin receptor antagonist may become a new endocrine approach to some liver cancers.
- Citation: Jiang CP, Kong C, Ding YT. Effects of gastrin and its antagonist proglumide on proliferation of human hepatoma cell lines. Shijie Huaren Xiaohua Zazhi 2008; 16(15): 1677-1680
- URL: https://www.wjgnet.com/1009-3079/full/v16/i15/1677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i15.1677
胃泌素是一种多肽激素. 主要由胃窦和十二指肠黏膜的G细胞分泌, 与胃泌素受体特异性结合, 具有刺激胃酸分泌和营养胃肠黏膜的作用. 近年发现, 胃泌素对消化系肿瘤及胰腺癌具有生长促进作用, 这种作用可被其受体拮抗剂所阻断. 而在肝癌中胃泌素是否具有类似的促增殖作用文献报道较少. 为进一步了解胃泌素及其受体拮抗剂对肝癌生长的影响, 我们选取SMMC-7721、HepG2、QGY-7701和Bel-7402 4种人HCC细胞株, 研究胃泌素及其受体拮抗剂丙谷胺对肝癌细胞株增殖活性的影响, 并观察胃泌素及丙谷胺对Bel-7402细胞周期的影响.
17肽胃泌素(G17)购自AnaSpec公司. 丙谷胺购自Sigma公司. MTT(四甲基偶氮唑盐)与DMSO, 南京大治生物科技有限公司. 碘化丙啶RNA酶试剂盒, 联科生物技术有限公司. 4种人肝癌细胞株HepG-2、SMMC-7721、QGY-7701、Bel-7402购自南京凯基生物公司. RPMI 1640培养基, GIBCO公司. 新生牛血清, 民海生物工程有限公司. 2.5 g/L胰蛋白酶(trypsin), Gibco公司.
1.2.1 细胞培养: HepG-2、QGY-7701、Bel-7402、SMMC-7721均采用含100 mmol/L新生牛血清的RPMI 1640培养基(添加2 mmol/L L-谷氨酰胺)在37℃, 50 mL/L CO2, 饱和湿度条件下细胞常规培养, 隔天换液, 2-3 d传代, 采用2.5 g/L胰酶消化贴壁细胞.
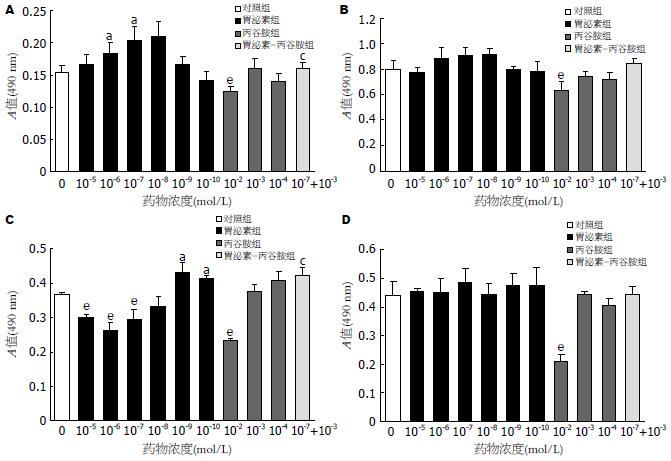
1.2.2 细胞增殖实验: MTT比色分析法, 选择对数生长期细胞, 经2.5 g/L胰蛋白酶消化后, 用RPMI 1640培养基调整细胞浓度为1×108个/L, 接种于96孔板. 每孔加细胞悬液90 μL(本底对照组加无血清培养基90 μL), 采用无血清培养基培养24 h, 以使细胞周期同步化后分组进行以下实验: (1)本底对照组, 不含细胞. 加无血清培养基10 μL; (2)细胞对照组, 不含药物. 加无血清培养基10 μL; (3)胃泌素组, 加RPMI 1640培养基配制胃泌素溶液(下同)10 μL, 使其终浓度为10-5-10-10 mol/L, 设6个浓度段; (4)丙谷胺组, 加丙谷胺溶液10 μL, 使其终浓度为10-2-10-4 mol/L, 设3个浓度段; (5)胃泌素+丙谷胺组, 加胃泌素和丙谷胺溶液各10 μL, 使其终浓度为分别为10-7和10-3 mol/L. 每个浓度5个复孔, 继续培养48 h后每孔加MTT液(5 g/L)15 μL, 继续孵育4 h. 去上清, 每孔加入150 μL DMSO, 振荡, 30 min内在酶标仪上测定A490 nm值. 每种细胞重复3次以上.
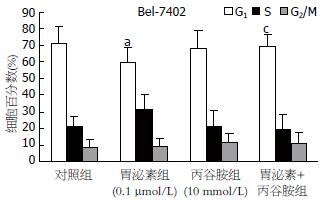
1.2.3 细胞周期分析: 选取Bel-7402的单细胞悬液, 调整细胞浓度为5×108/L, 接种于24孔培养板, 每孔500 μL, 每组设3个复孔, 无血清培养24 h, 以同步化. 待细胞贴壁, 弃去培养基, 每孔加含5 mol/L小牛血清的培养液450 μL, 对照组加无血清的培养液50 mL, 胃泌素组加胃泌素液50 μL, 使其终浓度为10-7 mol/L, 丙谷胺组加丙谷胺液50 μL, 使其终浓度为10-2 mol/L, 胃泌素加丙谷胺组加胃泌素液及丙谷胺液各25 μL, 使其终浓度为分别约为10-7和10-2 mol/L. 置37℃, 50 mL/L CO2恒温培养箱中培养, 每日换液. 培养48 h后以1 g/L的胰蛋白酶消化, 收集细胞, PBS洗涤2次后用2 mL PBS制成细胞悬液, 充分打匀, 缓慢加入1.5 mL冷乙醇固定24 h, RNA酶孵育15 min, 碘化丙啶染色, 流式细胞仪测定细胞各周期分布.
统计学处理 所有数据以mean±SD表示, 经student-t检验或ANOVA, P<0.05有统计学意义.
Bel-7402显示出胃泌素在10-7和10-8 mol/L时, 具有明显的刺激增殖作用. QGY-7701中, 胃泌素在较高浓度10-5、10-6、10-7 mol/L时, 具有抑制生长作用, 在接近生理浓度10-9和10-10 mol/L时, 具有促增殖作用. 对于HepG2、SMMC-7721, 未观察到胃泌素有明显的促增殖作用. HepG2、QGY7701、SMMC-7721、Bel-7402四种肝癌细胞株, 在丙谷胺浓度为10-2 mol/L时, 皆有显著的抑制作用, 但10-3 mol/L和10-4 mol/L时, 丙谷胺未观察到明显的抑制作用. Bel-7402在胃泌素(10-7 mol/L)+丙谷胺(10-3 mol/L)联合用药组与同浓度单用胃泌素组相比, 增殖作用明显变小, 显示丙谷胺对胃泌素促增殖作用有拮抗作用. QGY7701在胃泌素(10-7 mol/L)+丙谷胺(10-3 mol/L) 联合用药组相对于同浓度单用胃泌素组, 其抑制作用得以逆转, 显示丙谷胺对胃泌素在较高浓度下的抑制增殖作用亦有拮抗作用. HepG2、SMMC-7721在胃泌素(10-7 mol/L)+丙谷胺(10-3 mol/L)联合用药组未观察到与相同浓度胃泌素组有明显的差别(图1).
应用流式细胞仪进行Bel-7402细胞各周期分析. 结果显示, 胃泌素组G0期细胞比例明显减少, S期及G2/M期细胞比例增加, 表明胃泌素可促进细胞DNA合成, 使G0/G1期细胞向S、G2/M期转化, 加丙谷胺后胃泌素的上述作用消失(图2).
对于肝癌细胞株Bel-7402, QGY-7701, 胃泌素在生理浓度或接近生理浓度的条件下, 是一种营养性的多肽, 可以显著性促进肝癌的生长. 已经知道, G17是通过GR起作用的, 两者结合通过磷脂酶C[1-2], 非受体络氨酸激酶[3-4], 蛋白络氨酸磷酸化[4-5], 细胞分裂素活化蛋白激酶[5-6]等重要信号传导途径最终调节基因转录表达. 我们同时也观察到在QGY-7701细胞株中过高的胃泌素的浓度, 导致细胞生长的抑制, 可能因为负反馈作用使得GR基因的下调表达有关[7]. 而观察到的胃泌素受体拮抗剂丙谷胺对胃泌素的增殖效果的抑制作用, 则是通过竞争性结合胃泌素受体, 或阻断了支配性的胃泌素自分泌途径所导致的.
在进行MTT增殖实验及流式细胞分析细胞周期前都对细胞进行周期同步化处理, 这可以增加细胞短期增殖的敏感性[8]. 流式细胞周期分析显示了胃泌素明显减少Bel-7402 G0/G1期细胞比例, 使G0/G1期细胞向S、G2/M期转化. 联合应用胃泌素受体拮抗剂丙谷胺后细胞增殖减慢, G0/G1期细胞比例增加. 可见胃泌素起到类似生长因子的作用. 而丙谷胺对其作用有拮抗作用.
本研究显示, 在SMMC-7721和HepG2细胞株中, 没有显示出胃泌素的促进作用, 可能的解释有: (1)两种细胞株均为我科一直培育传代的细胞株, 在细胞株反复传代过程中, 可能丧失某些生物特性. (2)非酰胺化形式的胃泌素在SMMC-7721和HepG2细胞中可能是更重要的受体激动剂. 文献也表明, 非酰胺化形式的胃泌素可能是更重要的促有丝分裂剂, 甘氨酸延展胃泌素[9-11]以及前胃泌素多肽[12-13]可以促进肿瘤生长. (3)在肝癌细胞系中胃泌素的促生长作用可能通过GR的突变体CCK-C受体作用, 这种突变体的作用与GR没有关联. 有文献报道CCK2受体的突变存在在胰腺、结直肠和胃癌[14-16], 在这些肿瘤中已经被检测到的CCK2受体的一种错剪接形式具有组成性的活性和营养性的效果[14-15]. (4)在胃肠道肿瘤中, 不同形式的胃泌素是以自分泌的方式来促进肿瘤生长的[17-19], 并且已达最大激活效力[20], 可能不依赖于循环中的胃泌素[21-22].
近年来, 小分子多肽靶向治疗为肿瘤的内分泌治疗提供的新的思路. 放射标记或细胞毒多肽结合受体蛋白可用于过表达相应受体的肿瘤的诊断和靶向治疗. 体外GR在肝癌发生发展中发挥促进作用的证实, 暗示了未来GR可能的应用价值: 检测相应蛋白或因子表达用于肿瘤的诊断, 利用配基受体的高亲和力, 高特异性的结合, 给予GR特异性拮抗剂或抗胃泌素抗体, 或干扰下游相关位点, 阻断胃泌素受体作用途径, 用于肝癌的分子靶向治疗(包括预防性干预治疗). 鉴于此类药物相对于化疗药物副作用较小, 可以长期较大量使用, 具有一定的临床应用潜力. 胃泌素及其特异性的拮抗剂将来有可能作为肝癌综合治疗的辅助性药物[23-24].
近10多年来, Gas和CCK-2R与肿瘤的关系引起关注. 大量体外研究表明, Gas可刺激胃、结肠、小细胞肺癌、甲状腺髓样癌等肿瘤细胞侏生长, 细胞株过表达或异位表达CCK-2R, 在加有Gas的培养基中其细胞增殖加快, DNA、蛋白质合成旺盛. 在过表达Gas基因小鼠及Gas基因敲除小鼠的体内研究也充分证实Gas能调节肿瘤细胞增殖、迁移、分化.
李方儒, 教授, 天津市南开医院(天津市中西医结合医院)内科; 戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科.
针对Gas或CCK-2R的靶向治疗已成为开辟肿瘤新治疗途径中充满希望的方法之一.
Gas/CCK-2R靶向治疗可为原发性肝癌的内分泌及基因治疗提供新的思路.
本研究思路清晰, 设计合理, 方法得当, 具有一定的科学意义与参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Yassin RR, Clearfield HR, Little KM. Gastrin's trophic effect in the colon: identification of a signaling pathway mediated by protein kinase C. Peptides. 1993;14:1119-1124. [PubMed] [DOI] |
| 2. | Yassin RR, Murthy SN. Possible involvement of protein kinase C in mediating gastrin-induced response in rat colonic epithelium. Peptides. 1991;12:925-927. [PubMed] [DOI] |
| 3. | Yassin RR, Abrams JT. Gastrin induces IP3 formation through phospholipase C gamma 1 and pp60c-src kinase. Peptides. 1998;19:47-55. [PubMed] [DOI] |
| 4. | Singh P, Narayan S, Adiga RB. Phosphorylation of pp62 and pp54 src-like proteins in a rat intestinal cell line in response to gastrin. Am J Physiol. 1994;267:G235-G244. [PubMed] |
| 5. | Seva C, Kowalski-Chauvel A, Blanchet JS, Vaysse N, Pradayrol L. Gastrin induces tyrosine phosphorylation of Shc proteins and their association with the Grb2/Sos complex. FEBS Lett. 1996;378:74-78. [PubMed] [DOI] |
| 6. | Seufferlein T, Withers DJ, Broad S, Herget T, Walsh JH, Rozengurt E. The human CCKB/gastrin receptor transfected into rat1 fibroblasts mediates activation of MAP kinase, p74raf-1 kinase, and mitogenesis. Cell Growth Differ. 1995;6:383-393. [PubMed] |
| 7. | Seva C, Scemama JL, Bastie MJ, Pradayrol L, Vaysse N. Lorglumide and loxiglumide inhibit gastrin-stimulated DNA synthesis in a rat tumoral acinar pancreatic cell line (AR42J). Cancer Res. 1990;50:5829-5833. [PubMed] |
| 8. | Kusyk CJ, McNiel NO, Johnson LR. Stimulation of growth of a colon cancer cell line by gastrin. Am J Physiol. 1986;251:G597-G601. [PubMed] |
| 9. | Pannequin J, Delaunay N, Buchert M, Surrel F, Bourgaux JF, Ryan J, Boireau S, Coelho J, Pélegrin A, Singh P. Beta-catenin/Tcf-4 inhibition after progastrin targeting reduces growth and drives differentiation of intestinal tumors. Gastroenterology. 2007;133:1554-1568. [PubMed] [DOI] |
| 10. | Seva C, Dickinson CJ, Yamada T. Growth-promoting effects of glycine-extended progastrin. Science. 1994;265:410-412. [PubMed] [DOI] |
| 11. | Singh P, Xu Z, Dai B, Rajaraman S, Rubin N, Dhruva B. Incomplete processing of progastrin expressed by human colon cancer cells: role of noncarboxyamidated gastrins. Am J Physiol. 1994;266:G459-G468. [PubMed] |
| 12. | Singh P, Owlia A, Varro A, Dai B, Rajaraman S, Wood T. Gastrin gene expression is required for the proliferation and tumorigenicity of human colon cancer cells. Cancer Res. 1996;56:4111-4115. [PubMed] |
| 13. | Van Solinge WW, Nielsen FC, Friis-Hansen L, Falkmer UG, Rehfeld JF. Expression but incomplete maturation of progastrin in colorectal carcinomas. Gastroenterology. 1993;104:1099-1107. [PubMed] |
| 14. | Hellmich MR, Rui XL, Hellmich HL, Fleming RY, Evers BM, Townsend CM Jr. Human colorectal cancers express a constitutively active cholecystokinin-B/gastrin receptor that stimulates cell growth. J Biol Chem. 2000;275:32122-32128. [PubMed] [DOI] |
| 15. | Ding WQ, Kuntz SM, Miller LJ. A misspliced form of the cholecystokinin-B/gastrin receptor in pancreatic carcinoma: role of reduced sellular U2AF35 and a suboptimal 3'-splicing site leading to retention of the fourth intron. Cancer Res. 2002;62:947-952. [PubMed] |
| 16. | Laghi L, Ranzani GN, Bianchi P, Mori A, Heinimann K, Orbetegli O, Spaudo MR, Luinetti O, Francisconi S, Roncalli M. Frameshift mutations of human gastrin receptor gene (hGARE) in gastrointestinal cancers with microsatellite instability. Lab Invest. 2002;82:265-271. [PubMed] |
| 17. | Smith JP, Verderame MF, Ballard EN, Zagon IS. Functional significance of gastrin gene expression in human cancer cells. Regul Pept. 2004;117:167-173. [PubMed] [DOI] |
| 18. | Wang X, Wei DP, Cai MY. Expression of gastrin in human gastric cancer cell line and effect of anti-gastrin mAb on the cell growth. Zhonghua Zhongliu Zazhi. 2005;27:276-278. [PubMed] |
| 19. | Zhou JJ, Chen ML, Zhang QZ, Hu JK, Wang WL. Coexpression of cholecystokinin-B/gastrin receptor and gastrin gene in human gastric tissues and gastric cancer cell line. World J Gastroenterol. 2004;10:791-794. [PubMed] |
| 20. | Baldwin GS, Zhang QX. Measurement of gastrin and transforming growth factor alpha messenger RNA levels in colonic carcinoma cell lines by quantitative polymerase chain reaction. Cancer Res. 1992;52:2261-2267. [PubMed] |
| 21. | Hoosein NM, Kiener PA, Curry RC, Brattain MG. Evidence for autocrine growth stimulation of cultured colon tumor cells by a gastrin/cholecystokinin-like peptide. Exp Cell Res. 1990;186:15-21. [PubMed] [DOI] |
| 22. | Negre F, Fagot-Revurat P, Bouisson M, Rehfeld JF, Vaysse N, Pradayrol L. Autocrine stimulation of AR4-2J rat pancreatic tumor cell growth by glycine-extended gastrin. Int J Cancer. 1996;66:653-658. [PubMed] [DOI] |