修回日期: 2008-02-23
接受日期: 2008-05-20
在线出版日期: 2008-05-28
目的: 探讨1H-MRS在鉴定大鼠非酒精性脂肪肝模型建立中的作用.
方法: 以高脂高胆固醇饮食喂养Wistar大鼠(n = 24)构建非酒精性脂肪肝模型, 正常饮食喂养大鼠(n = 8)作为对照组. 使用1H-MRS 第0、4、8和12周检查肝脏的脂肪含量, 并对肝组织进行脂肪肝病理分析. 在处死大鼠前收集大鼠血液作血清ALT、AST、TC、TG和HDL-C分析.
结果: 大鼠肝细胞内从第4周即出现脂滴空泡, 程度较轻, 以小泡性脂滴为主, 随着时间的增加, 脂肪肝程度明显加重, 第12周时多为中重度脂肪肝, 细胞内出现较多大泡性脂滴空泡. 24只实验大鼠中, 除1只在第4周时未造模成功外, 其他均造模成功, 按照病理分级, 1级3只, 2级14只, 3级6只. 实验组肝指数、肝功能及血脂检查均高于对照组. 使用1H-MRS分析, 对照组的脂肪相对含量为13.0%±7.1%, 均小于21%, 实验组平均56.7%±16.4%, 均大于28%, 两组间有统计学意义(t = 5.78, P<0.001).
结论: 使用高脂高胆固醇配方饮食可成功构建大鼠非酒精性脂肪肝模型, 1H-MRS在脂肪肝模型建立的鉴定中有重要的价值.
引文著录: 刘再毅, 梁长虹, 王秋实, 刘于宝, 徐莉, 郑君惠. 1H-MRS在鉴定大鼠非酒精性脂肪肝模型构建中的作用. 世界华人消化杂志 2008; 16(15): 1612-1616
Revised: February 23, 2008
Accepted: May 20, 2008
Published online: May 28, 2008
AIM: To investigate the use of 1H magnetic resonance spectroscopy (1H-MRS) in the evaluation of nonalcoholic fatty liver model in rats.
METHODS: Nonalcoholic fatty liver disease model in Wistar rats (n = 24) was induced with high-fat diet. Eight rats fed with normal diet were used as controls. 1H-MRS was performed to confirm fatty liver at 0, 4, 8 and 12 wk. Degrees of fatty liver were evaluated pathologically. Blood of the rats were collected before sacrifice to analyze the liver function and serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), total cholesterol (TC), triglyceride (TG) and high-density lipoprotein cholesterol (HDL-C).
RESULTS: Mild fatty liver was observed at 4 wk with predominantly microvesicular steatosis. The degree of fatty liver progressed with the time, and moderate to severe fatty liver was induced at 12 wk. Except for 1 rat at 4 wk, fatty liver was successful induced in the rest 23 rats (grade 1 in 3, grade 2 in 14 and grade 3 in 6 rats according to the pathological grading system). Liver index, liver function and serum TC, TG and HDL-C were higher in experiment group than those in control group. Relative liver fat content measured by 1H-MRS in control group was 13.0% ± 7.1%, lower than 21%, and it was 56.7% ± 16.4% in experiment group, higher than 28%. There was significant difference between the above groups (t = 5.78, P < 0.001).
CONCLUSION: Nonalcoholic fatty liver model can be induced with high-fat and high-cholesterol diet in rats, and 1H-MRS can be used to evaluate the fatty liver noninvasively.
- Citation: Liu ZY, Liang CH, Wang QS, Liu YB, Xu L, Zheng JH. Evaluation of nonalcoholic fatty liver model in rats using 1H magnetic resonance spectroscopy. Shijie Huaren Xiaohua Zazhi 2008; 16(15): 1612-1616
- URL: https://www.wjgnet.com/1009-3079/full/v16/i15/1612.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i15.1612
随着生活水平的提高, 非酒精性脂肪肝(nonalcoholic fatty liver, NAFL)在人群中的发病率逐渐增高, 也受到越来越多的重视. 在不同的国家, 人群的NAFL发生率约为10%-24%. 约有67%的肥胖者存在单纯的肝脂肪变性, 有90%的病态肥胖患者存在肝脂肪变性. 小孩的发生率约为2.6%, 肥胖的小孩的发生率则高达22.5%-52.8%[1-6]. 为此, 国内外研究者使用多种方法构建了NAFL动物模型以满足对其发病机制和临床干预实验的需要[7-12]. 但由于很多方法费时、操作复杂、成本高, 限制了其在科学研究中的应用. 并且传统判断模型是否构建成功的方法是随机处死动物作肝脏病理学分析, 该方法既耗费动物, 又不精确, 因此迫切需要一种新的模型鉴定方法. 氢质子磁共振波谱(proton magnetic resonance spectroscopy, 1H-MRS)可以无创、在体分析组织中代谢产物的含量[13-19]. 本研究拟采取改良高脂高胆固醇饮食的方式构建NAFL模型, 并探讨1H-MRS在判断模型是否构建成功中的价值.
健康♀清洁级Wistar大鼠32只, 由中山大学北校区动物实验中心提供, 体质量150-180 g, 平均165±15 g. 分笼饲养, 自然光照, 可自由进食饮水. 适应性饲养1 wk后随机分为实验组(n = 24)和对照组(n = 8). 实验组以高脂高胆固醇配方饮食喂养, 对照组以普通饮食喂养. 实验组饮食配方: 基础饲料(875 g/kg)+猪油(100 g/kg)+胆固醇(20 g/kg)+胆酸纳(50 g/kg). 其中, 基础饲料由中山大学北校区动物实验中心提供, 猪油为市售, 胆固醇及胆酸纳购至广州南方化波公司. 1H-MRS采集仪器: GE 1.5 T超导核磁共振仪; 线圈: 50 mm正交鸟笼动物线圈.
在喂养开始前(即第0周), 从对照组中随机抽取2只进行肝脏1H-MRS脂肪定量分析和病理分析. 于4、8、12 wk分别从对照组中随机抽取2只、在实验组中分别随机抽取4、8、12只大鼠进行肝脏1H-MRS脂肪定量分析和脂肪肝病理分析. 波谱采集完毕, 称大鼠体质量, 然后过量麻醉法处死大鼠, 抽取血液作肝功能ALT, GGT, AST和血清血脂水平(包括总胆固醇TC; 三酰甘油TG; HDL-C)检查. 检验均用Bechman全自动生化分析仪, 试剂由Bechman提供. 所有检验均在我院中心实验室完成. 摘取肝脏并测量质量, 计算肝/体质量指数.
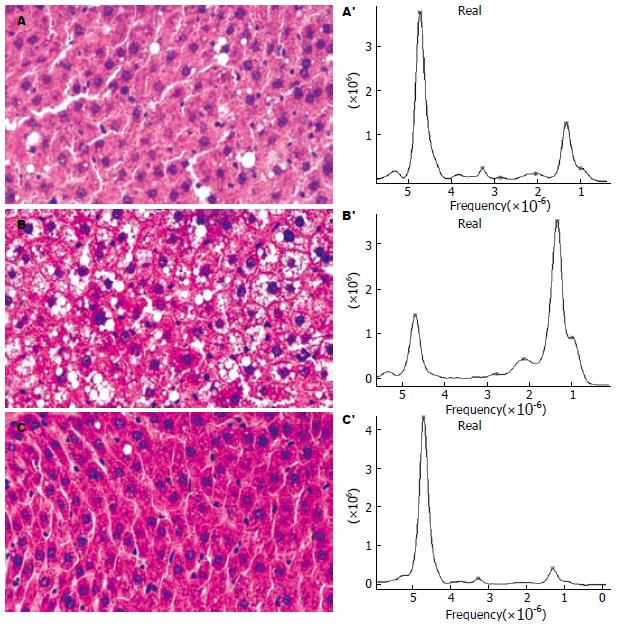
1.2.1 肝脏1H-MRS检查: 使用水合氯醛(0.3 mL/kg)ip, 将大鼠俯卧位置于线圈内, 肝脏置于线圈中心位置, 于大鼠周围适当填塞以固定大鼠尽可能抑制呼吸动度. 扫描定位相, 序列: 3-pl T2* SPGR(TR/TE: 84.7/1.6 ms, 层厚/层间距: 5/2 mm), 并扫描轴位T2WI图像(FSE, TR/TE: 3000/85.2 ms, ETL: 15; 层厚/层间距: 3/1 mm; FOV: 8 mm×8 mm; 矩阵: 192×160). 使用T2WI轴位图像作为定位相, 结合3-pl T2* SPGR的冠状位和矢状位图像, 在肝左叶上方层面放置感兴趣容积(VOI), 大小: 5-6 mm×5-6 mm×5-6 mm. 尽量避开皮下脂肪、肝裂和较为粗大的血管及胆管. 在VOI上、下、左、右、前、后放置饱和带, 以减少VOI外的组织的信号污染. 采集序列为点分辩波谱法(PRESS), 参数: TR/TE: 1500/35 ms; 点阵: 2048; 采集次数: 192; 自动匀场及抑水. 1H-MRS波谱分析及脂肪含量定量分析: 使用SAGE 7.3(GE Medical system). 步骤: 数据零填充1倍→3 Hz的Gaussian函数处理→傅立叶变换→谱线基线校正→谱线相位校正→确定水和脂肪波峰位置→函数拟合积分得到水及脂肪波峰下面积. 以水峰作为内参照, 定位于4.7×10-6处, 其波谱下面积积分为s水; 脂肪峰则包括位于1.3×10-6处的亚甲基峰、0.9×10-6处的甲基峰、2.0×10-6和2.8×10-6处的邻近羧基和烯属基团的亚甲基峰, 积分四者的面积和为s脂, 则肝脏的脂肪含量定义为: 脂% = s脂/(s脂+s水)×100%[13,15].
1.2.2 脂肪肝程度病理分级: 在肝左叶取组织于40 g/L中性甲醛固定, 取样位置尽可能位于1H-MRS的VOI区域, 石蜡包埋, 常规切片, 行HE染色, 光镜下常规病理学观察. 观察脂肪浸润的肝细胞数量占肝细胞总数的比例进行分级, 标准为: 0级为<5%的肝细胞受累, 即正常肝组织; 1级为5%-33%的肝细胞受累; 2级为34%-66%的肝细胞受累; 3级为>66%的肝细胞受累.
统计学处理 使用SPSS分析实验组和对照组体质量、肝/体质量指数、肝功能和血清血脂水平的差别(由于正常对照组大鼠在各时间点数量较小, 因此在比较上述指标时, 不在各时间点分别比较, 而是采取对照组和试验组总体均数之间进行比较). P<0.05被认为具有统计学意义.
实验组动物喂养2 wk后, 出现皮毛蓬乱无光泽, 食欲减低, 但实验组和对照组体重均增加, 二者间无统计学意义(t = 1.21, P>0.05). 实验组肝/体质量指数、肝功能及血脂检查均高于对照组(表1).
| 指标 | 实验组 | 对照组 |
| 肝/体质量指数(%) | 3.37±0.40 | 1.96±0.20 |
| AST(μkat/L) | 10.93±4.85 | 5.58±1.18 |
| ALT(μkat/L) | 2.49±0.98 | 1.33±0.29 |
| GGT(μkat/L) | 0.37±0.22 | 0.17±0.04 |
| TC(mmol/L) | 2.07±0.63 | 1.22±0.36 |
| TG(mmol/L) | 1.59±0.58 | 1.11±0.13 |
| HDL-C(mmol/L) | 1.13±0.33 | 0.63±0.16 |
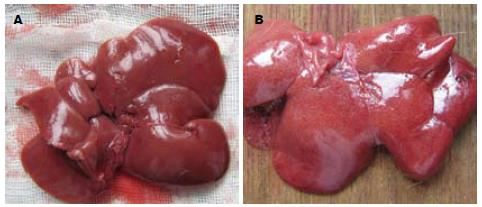
对照组大鼠肝脏色泽鲜红, 边缘锐利(图1A); 实验组大鼠肝脏体积增大, 呈淡黄色, 可见较明显的脂肪颗粒样物质(图1B). 光镜观察实验组大鼠肝细胞内从在第4周检查时即出现脂滴空泡, 程度较轻, 以小泡性脂滴为主, 随着时间的增加, 脂肪肝程度明显加重, 第12周时多为重度脂肪肝, 细胞内大泡性脂滴空泡增多. 同时, 肝细胞索排列紊乱, 肝窦变窄, 并有少量炎性细胞浸润(图2). 而对照组大鼠肝脏肝小叶结构清晰, 肝细胞索排列整齐, 肝窦正常, 未有炎性细胞浸润(图2). 实验组按照病理分级轻度3只、中度14只、重度6只. 4 wk时检测1只造模未成功(表2).
| 4 wk | 8 wk | 12 wk | 合计 | |
| 0级 | 1 | 0 | 0 | 1 |
| 1级 | 2 | 1 | 0 | 3 |
| 2级 | 1 | 5 | 8 | 14 |
| 3级 | 0 | 2 | 4 | 6 |
| 合计 | 4 | 8 | 12 | 24 |
使用1H-MRS分析(图2), 对照组的脂肪相对含量为13.0%±7.1%, 均小于21%, 实验组平均56.7%±16.4%, 均大于28%, 两组间有统计学意义(t = 5.78, P<0.001).
NAFL模型的建立有多种方法, 包括营养法、药物中毒法、高脂饮食加药物中毒法和物理刺激法. 其中最常用的方法是营养法. 营养法中又以高脂饮食配方常用, 主要是在基础饲料中增加不同比例的猪油或其他植物油. 高脂饮食配方法由于简单易行、构建成功率高、与人类饮食结构接近等优点深得研究者青睐[7-12]. 在复习文献的基础上, 本研究对配方作了改进. 食物中加入较多的猪油, 摄入的过多脂肪堆积在细胞内, 从而导致脂肪肝. 加入的胆固醇和胆盐易导致细胞内发生过氧化反应, 产生自由基和醛类物质, 产生的醛类物质又可与谷胱甘肽、过氧化酶等抗氧化剂的活性部位结合, 减少对自由基的清除, 会引起所谓的二次攻击, 会加速NAFL的形成[7]. 据文献报道, 使用高脂饮食法在12 wk时可以成功构建脂肪肝[8-9]. 但我们添加了胆固醇和胆盐, 故理论上会加速脂肪肝的形成, 因此本组实验将实验组的检测时间点定为4、8、12 wk. 预计到4 wk时脂肪肝可能程度很轻, 因此在第4周只对4只实验组大鼠作相应处理, 而在第8、12周分别为8和12只动物. 本研究结果表明, 本配方可以成功构建不同程度大鼠脂肪肝模型, 在本组中除了在第4周时1只大鼠没有形成脂肪肝外, 其他均形成不同程度的脂肪肝, 其中轻、中、重度脂肪肝分别为3、14、6只. 同时, 实验组大鼠的肝/体重指数、肝功能和血脂水平均高于对照组. 大体外观和光镜观察结果均与文献报道类似[6,8-11].
在NAFL的实验中, 确定造模成功与否对实验进行具有重要的指导意义. 传统的方法是根据经验, 在特定时间点随机抽取动物处死后对肝脏作病理学检查[7,9,11-12]. 但此方法不能保证所有的动物均造模成功, 不能对每个动物进行脂肪肝程度的分级, 并且耗费试验动物. 从表2可以看出, 在第8周和12周时均有中、重度模型构建成功, 因此单纯依靠构建时间来判断是否构建成功或者程度不够精确, 不能确保NAFL研究的试验组和对照组具有可比性. 因而需要一种无创、准确的方法来进行模型的鉴定. 研究证实, 1H-MRS是一种功能强大的分析工具, 可以无创、定量分析肝细胞中脂肪的含量(主要是三酰甘油, TG), 因此非常适用于肝脏脂肪的活体定量分析及纵向随访研究[13-19].
1H-MRS是医学影像学近年来发展的新的检查手段, 作为一种无创伤性研究活体器官组织的代谢、生化变化及化合物定量分析的方法, 被众多学者用来进行脂肪肝的定量分析[13-14]. 其基本原理是, 在同一外部磁场中, 各代谢产物中的氢质子所处的局部化学环境却不同(核外电子云密度不同和所受屏蔽作用的不同造成), 从而引起相同氢质子在磁共振波谱中吸收信号的位置差异, 通常用化学位移的大小(以磁共振频率的百万分之一)来表示. 在MRS波谱中, 横坐标表示化学位移, 纵坐标代表代谢产物的信号强度, 波峰下面积则代表该代谢产物在组织中的含量. 在肝脏的典型波谱谱线中, 可以见到位于4.7×10-6处的水峰, 通常作为内参照标准来衡量肝内脂肪的相对含量. 脂肪峰则根据脂肪中氢质子所处的基团位置不一样出现4个不同的波峰, 包括位于1.3×10-6处的亚甲基峰、0.9×10-6处的甲基峰、2.0×10-6和2.8×10-6处的邻近羧基和烯属基团的亚甲基峰, 通常以亚甲基峰最明显, 甲基峰其次[17,20]. 在后处理波谱数据时, 分别积分水峰(s水)和脂肪峰下面积(s脂), 根据公式: 脂% = s脂/(s脂+s水)×100%就可以得到肝脏脂肪的相对含量[20]. 我们首次使用1H-MRS来判断脂肪肝动物模型是否构建成功, 结果得到轻度脂肪肝的脂肪相对比(脂%)均大于28%, 平均56.7%±16.4%. 而对照组的相对含量则多小于20%, 平均13.0%±7.1%. 从试验结果可以看出, 如果1H-MRS测得的脂肪相对含量大于28%, 则可以大致判断脂肪肝模型建立成功. 但是, 本研究中只有9例正常大鼠肝脏, 轻度NAFL只有3例, 准确判断正常肝脏和NAFL的分界线还需要扩大样本含量.
总之, 采用本研究的饮食配方饮食, 在8-12 wk时即可构建出中至重度大鼠NAFL模型, 且1H-MRS可无创、准确判断构建NAFL模型是否成功及其程度.
随着饮食结构的改变, 非酒精性脂肪肝(NAFL)的发病率逐渐增高. 众多学者构建了NAFL动物模型来研究其发病机制和评价治疗效果. 过去判断构建模型是否成功依赖于病理学检查, 具有一定的局限性, 因此需要发展可以在体、无创的分析方法来判断是否构建模型成功.
张锦生, 教授, 复旦大学上海医学院病理学系.
肝细胞内脂肪异常蓄积往往与胰岛素抵抗及各种代谢综合征有十分密切的关系. 准确测量肝细胞内脂肪含量的含量对NAFL的各种研究具有十分重要的意义.
1H-MRS能准确判断脂肪肝的程度, 可以用来判断NAFL模型是否构建成功.
氢质子磁共振波谱(1H-MRS): 磁共振技术发展的新应用, 其基本原理是根据代谢物质内氢质子所处的局部化学环境不同引该氢质子在磁共振波谱中吸收信号的位置不同, 即化学位移来判断组织中代谢产物的性质和数量. 该技术具有无创、在体及动态检测组织内代谢产物浓度的优势.
本文为非酒精性脂肪肝动物模型的研究提供了一种新的非损伤性评价方法, 内容新颖, 具有一定的参考价值.
编辑: 潘伯荣 电编:吴鹏朕
| 1. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 2. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Bugianesi E, Lenzi M, McCullough AJ, Natale S, Forlani G, Melchionda N. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes. 2001;50:1844-1850. [PubMed] [DOI] |
| 3. | Mayerson AB, Hundal RS, Dufour S, Lebon V, Befroy D, Cline GW, Enocksson S, Inzucchi SE, Shulman GI, Petersen KF. The effects of rosiglitazone on insulin sensitivity, lipolysis, and hepatic and skeletal muscle triglyceride content in patients with type 2 diabetes. Diabetes. 2002;51:797-802. [PubMed] [DOI] |
| 4. | Schrauwen P. High-fat diet, muscular lipotoxicity and insulin resistance. Proc Nutr Soc. 2007;66:33-41. [PubMed] [DOI] |
| 5. | Schrauwen-Hinderling VB, Hesselink MK, Schrauwen P, Kooi ME. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 2006;14:357-367. [PubMed] [DOI] |
| 7. | Polavarapu R, Spitz DR, Sim JE, Follansbee MH, Oberley LW, Rahemtulla A, Nanji AA. Increased lipid peroxidation and impaired antioxidant enzyme function is associated with pathological liver injury in experimental alcoholic liver disease in rats fed diets high in corn oil and fish oil. Hepatology. 1998;27:1317-1323. [PubMed] [DOI] |
| 13. | Chan DC, Watts GF, Ng TW, Hua J, Song S, Barrett PH. Measurement of liver fat by magnetic resonance imaging: Relationships with body fat distribution, insulin sensitivity and plasma lipids in healthy men. Diabetes Obes Metab. 2006;8:698-702. [PubMed] [DOI] |
| 14. | De Feyter HM, Schaart G, Hesselink MK, Schrauwen P, Nicolay K, Prompers JJ. Regional variations in intramyocellular lipid concentration correlate with muscle fiber type distribution in rat tibialis anterior muscle. Magn Reson Med. 2006;56:19-25. [PubMed] [DOI] |
| 15. | Hadigan C, Liebau J, Andersen R, Holalkere NS, Sahani DV. Magnetic resonance spectroscopy of hepatic lipid content and associated risk factors in HIV infection. J Acquir Immune Defic Syndr. 2007;46:312-317. [PubMed] |
| 16. | Hwang JH, Stein DT, Barzilai N, Cui MH, Tonelli J, Kishore P, Hawkins M. Increased intrahepatic triglyceride is associated with peripheral insulin resistance: in vivo MR imaging and spectroscopy studies. Am J Physiol Endocrinol Metab. 2007;293:E1663-E1669. [PubMed] [DOI] |
| 17. | Ishii M, Yoshioka Y, Ishida W, Kaneko Y, Fujiwara F, Taneichi H, Miura M, Toshihiro M, Takebe N, Iwai M. Liver fat content measured by magnetic resonance spectroscopy at 3.0 tesla independently correlates with plasminogen activator inhibitor-1 and body mass index in type 2 diabetic subjects. Tohoku J Exp Med. 2005;206:23-30. [PubMed] [DOI] |
| 18. | Kotronen A, Seppälä-Lindroos A, Bergholm R, Yki-Järvinen H. Tissue specificity of insulin resistance in humans: fat in the liver rather than muscle is associated with features of the metabolic syndrome. Diabetologia. 2008;51:130-138. [PubMed] [DOI] |
| 19. | Liska D, Dufour S, Zern TL, Taksali S, Calí AM, Dziura J, Shulman GI, Pierpont BM, Caprio S. Interethnic differences in muscle, liver and abdominal fat partitioning in obese adolescents. PLoS ONE. 2007;2:e569. [PubMed] [DOI] |
| 20. | Szczepaniak LS, Nurenberg P, Leonard D, Browning JD, Reingold JS, Grundy S, Hobbs HH, Dobbins RL. Magnetic resonance spectroscopy to measure hepatic triglyceride content: prevalence of hepatic steatosis in the general population. Am J Physiol Endocrinol Metab. 2005;288:E462-E468. [PubMed] [DOI] |