修回日期: 2008-05-07
接受日期: 2008-05-20
在线出版日期: 2008-05-28
近年来, 随着免疫学的不断发展, 肿瘤的免疫疗法已成为当前研究的热点, 而多肽疫苗因其化学性质稳定、易于制备、无潜在致癌性等优点, 更是受到广泛关注. 研究发现, 应用免疫佐剂、多抗原分支肽、全长或多表位叠加抗原肽、融合穿膜肽, 增加Th表位及联合树突状细胞等方法, 可提高免疫原性, 增强抗肿瘤作用. 多肽疫苗临床治疗一些恶性肿瘤也已取得一定效果, 但尚存在免疫原性欠佳、免疫应答、临床疗效不尽一致及受HLA表型限制等问题, 还需进一步深入研究解决.
引文著录: 余彤, 杨建民. 超肿瘤多肽疫苗的研究进展. 世界华人消化杂志 2008; 16(15): 1597-1601
Revised: May 7, 2008
Accepted: May 20, 2008
Published online: May 28, 2008
Immunotherapy for tumor has been a hotspot in recent research. The peptide vaccines are now drawing extensive attention since it is chemically stable, easily prepared and devoid of oncogenic potential. Research showed that antitumor effect of peptide vaccines was closely related to its immunogenicity which can be enhanced by immunoadjuvant, multiple-antigen peptides, multiple-epitope peptides or combination with adjuvant, dendritic cells, Th epitopes or cell-penetrating peptides. Although peptide vaccines were somewhat effective for some malignant tumors, there existed such problems as unsatisfying immunogenicity, inconsistency between intensity of immune response and clinical results, and HLA type restriction, which require further investigation.
- Citation: Yu T, Yang JM. Progress in peptide vaccines for tumors. Shijie Huaren Xiaohua Zazhi 2008; 16(15): 1597-1601
- URL: https://www.wjgnet.com/1009-3079/full/v16/i15/1597.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i15.1597
肿瘤传统治疗包括手术、化疗、放疗或是这些方法的联合. 手术因无法彻底清除残存的肿瘤细胞而致复发; 放疗和化疗在杀伤肿瘤细胞的同时也杀伤正常细胞而致患者难以坚持. 随着对肿瘤发生、发展分子机制研究的深入和生物技术的迅速发展, 生物治疗已经成为肿瘤治疗的第四种模式, 包括体细胞疗法与细胞因子疗法、放射靶向治疗、基因治疗、分子靶向治疗及肿瘤疫苗等[1]. 其中, 肿瘤多肽疫苗已成为近年研究的热点, 与当前研究的另一大热点分子靶向治疗相比, 两者均具有治疗特异性高、不损伤机体正常细胞、毒副作用低、患者治疗依从性好、生活质量高等优点, 但分子靶向治疗也存在仅对靶分子表达阳性的部分肿瘤细胞有效、肿瘤型别专一性强、临床有效率低、价格昂贵等问题, 而肿瘤多肽疫苗则具有化学性质稳定、制作方便、无需细菌病毒等载体、肿瘤型别通用性强、有效率高、治疗费用相对较低等优势[2-3]. 本文就多肽疫苗的作用机制, 增强疫苗免疫原性的途径, 及其在临床肿瘤治疗中的应用作一简要叙述.
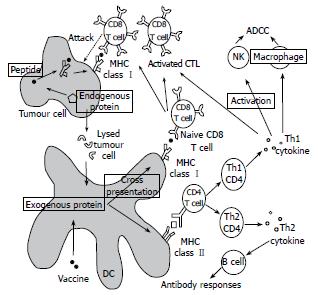
T细胞的活化是多肽疫苗抗肿瘤免疫反应的关键步骤(图1). 抗原特异性T细胞反应由抗原递呈细胞(antigen presenting cell, APC)对抗原多肽的递呈开始. 肿瘤抗原多肽必需经APC加工处理后形成主要组织相溶性分子复合物(major histocompatibility complex, MHC), 才能被T细胞受体(T cell receptor, TCR)识别, 产生抗原特异性激发信号. 树突状细胞(dendritic cell, DC)是递呈作用最强的APC, 大量表达诸如CD80、CD86等共刺激分子和CD83等特异性标志物的MHC Ⅰ类和Ⅱ类分子. DC吞噬多肽疫苗中的多肽后迁移到外周淋巴结, 并将8-10个氨基酸长度的抗原肽和MHC-Ⅰ类分子的结合物递呈给以CD8作为细胞表面标志的细胞毒T淋巴细胞(cytotoxic T lymphocyte, CTL). 幼稚的T细胞在APC递呈的多肽-MHC分子复合物和共刺激分子双信号的作用下转化为成熟的效应细胞, 迁移到炎症、肿瘤部位从而启动了有效的杀伤反应, 通过穿孔素/颗粒酶和(或)Fas/Fas-L途径溶解靶细胞. 不同细胞毒T淋巴细胞亚群的杀伤靶细胞机制略有不同: CD8+ CTL主要通过颗粒依赖性途径杀伤靶细胞和病原, DN CTL(CD8-CD4-)主要是通过FasL-Fas介导但无法杀伤病原体, 而CD4+ CTL则可通过任一途径杀伤靶细胞.
那些长度约为14-25个氨基酸的抗原肽则和MHC-Ⅱ类分子结合, 然后递呈给以CD4作为细胞表面标志的辅助T淋巴细胞(helper T lymphocyte, HTL, Th). Th细胞在激发和维持抗肿瘤免疫的过程中起到了重要的作用. 许多研究已经证实, CD4 Th细胞和DC的CD40-CD40L之间的相互作用是激发和活化CD8 CTL的关键. CD4 Th细胞通过CD40-CD40L信号途径和分泌IL-2的方法激活幼稚DC以辅助CD8 CTL反应. CD4 Th细胞识别了DC递呈的抗原后, 反过来激活载有抗原的DC, 一旦被活化, 这些DC就可以有效的激发CD8 CTL对肿瘤抗原做出反应. CD4 Th细胞分为Th1和Th2两种类型. 活化的Th1 CD4细胞分泌IL-2等细胞因子来激活CD8 CTL、自然杀伤细胞(natural killer cell, NK)和巨噬细胞以作为抗体依赖细胞介导的细胞毒作用的效应细胞. Th2 CD4细胞分泌IL-4、I-L5、IL-6等细胞因子来激活B细胞以介导体液免疫. 另外, 记忆性CD4 Th细胞还在维持保护性免疫中起关键性作用. 同时, CD4 Th细胞还可以释放出如IFN-γ、TNF之类的细胞因子来维持CD8 CTL的生长和增殖并协助其发挥抗肿瘤的作用[4-6].
活化的T细胞对肿瘤细胞的杀伤始于机体的免疫系统对肿瘤抗原性物质的识别. 肿瘤抗原是肿瘤特异性免疫应答的重要靶抗原, 分为肿瘤特异性抗原(tumor specific antigen, TSA)和肿瘤相关性抗原(tumor-associated antigen, TAA)两种[7-8]. TSA是只在肿瘤细胞表达, 而在正常细胞中不表达的抗原分子, 因此不存在宿主免疫耐受和发生自身免疫的可能. 这些抗原多来源于病毒抗原, 变异蛋白或是融合蛋白. 相对于TSA, TAA在正常组织和肿瘤组织中均有表达, 但肿瘤细胞的表达量明显高于正常组织, 如CEA、AFP、CA19-9等. 发生免疫耐受和自身免疫反应是此类疫苗可能潜在的问题, 因此如何提高人体免疫系统对TAA特异性CTL和HTL表位的识别是多肽疫苗研究中的关键所在, 而肿瘤抗原表位鉴定的发展使这个问题能得以有效的解决.
肿瘤多肽疫苗因制作工序简单、费用低廉、化学性质稳定、无致癌性等优点而成为肿瘤免疫治疗的新方法. 理想的多肽疫苗免疫原性强, 能激活抗原特异性CTL和HTL反应, 有效杀伤肿瘤细胞而对正常细胞无毒害作用. 但是普通的多肽抗原因其表位单一、分子量小易降解等原因而致免疫原性弱, 只能激发低水平的CTL反应, 不能获得理想的抗肿瘤效果. 故在多肽疫苗设计过程中需重点解决提高免疫原性的问题.
佐剂属于非特异性免疫原性增强剂, 其本身不能引起有效的抗肿瘤免疫反应, 但可以模拟病原体制造的危险信号, 刺激免疫系统, 参与刺激淋巴细胞增殖与分化, 引起机体炎症反应, 另外还可以保护抗原肽不被蛋白酶降解, 并缓慢释放到细胞外. 佐剂包括福氏完全佐剂(complete Freund's adjuvant, CFA)、福氏不完全佐剂(incomplete Freund's adjuvant, IFA)、粒巨噬细胞集落刺激因子(granulocyte macrophage colony-stimulating factor, GM-CSF)、IL-2、热休克蛋白(heat shock protein, HSP)等[3,9]. 目前免疫佐剂的使用没有一个特定的规则, 但其选择可能和抗原肽种类、注射方法、肿瘤类型等有关. Scheibenbogen et al[10]以GM-CSF和KLH作为MHC-Ⅰ限制性酪氨酸酶多肽疫苗的佐剂对43名高危黑色素瘤患者进行免疫接种实验以比较不同佐剂对多肽疫苗作用的影响, 结果表明单独以GM-CSF为佐剂的9名患者中有4名出现特异性T细胞反应, 单独以KLH为佐剂的患者中未出现类似反应, 而GM-CSF和KLH联合作为佐剂则可增强多肽的免疫原性. 说明不同的佐剂对多肽产生不同的影响, 而联合使用佐剂可以增强多肽的免疫原性.
DC是目前发现的体内功能最强的T细胞刺激物, 其最大的特点是能显著刺激初始型T-淋巴细胞增殖, 是机体免疫反应的始动者. DC能高水平的表达与抗原递呈有关的MHC-Ⅰ类和MHC-Ⅱ类分子, 摄取肿瘤相关抗原后递呈给T细胞, 激活相应的CD4+ T细胞和CD8+ T细胞, DC还可以借助表达的粘附分子与T细胞膜表面的相应配体CD28和CTL A-4的相互作用而活化Th细胞, 使Th细胞产生大量的细胞因子, 进一步调节活化的Th细胞, 以增强机体的细胞免疫和体液免疫功能, 发挥主动免疫的抗肿瘤作用, 在抗肿瘤免疫中具有重要的作用. 故把成熟的DC和多肽联合制成疫苗免疫机体也是提高多肽疫苗免疫原性的一种有效的方法[11-13].
单体肽抗原表位成分简单, 引发的免疫反应针对性强, 但其表位肽的分子量小, 在体内易降解, 从而不能激发满意的保护性免疫反应, 因而有免疫原性低的缺陷. 1988年Tam实验室提出了多抗原肽(multiple antigen peptides, MAPs)的设计方案, 采用分子量小且免疫原性弱的赖氨酸为核心基质, 将若干条(一般为4条或8条)抗原表位相同的单体肽耦联在一起, 形成树枝状结构. 这种设计模式在加强了抗原优势表位的肽链结构特异性的同时还增大了抗原的分子质量, 不但很好的模拟了天然表位构象, 而且无需再耦联载体蛋白便能诱生高滴度、高亲和力的抗体, 改善了其抗原抗体反应的活性, 从而加强了抗原性, 在疫苗开发和肿瘤免疫治疗上有着巨大的应用前景[14]. Ciesielski et al[15]以赖氨酸桥连接8条EGFRvⅢ单体肽形成的八分枝肽来免疫恶性神经胶质瘤小鼠, 同时用或不用GM-CSF作为佐剂, 结果表明MAPs联合GM-CSF效靶比20:1组杀伤率超过40%, 单用MAPs组杀伤率10%, 未免疫组杀伤率为0%, 各组间有显著差异(P<0.05).
当前研究的单表位肽疫苗多是经过预测筛选的HLA表型限制性疫苗, 只适用于特定HLA表型的患者, 应用范围相对较窄. 全长抗原蛋白制成的疫苗或多表位叠加的疫苗存在多个已知或未知的受不同MHC限制的抗原表位, 他们负载DC后能以多抗原表位的形式递呈到DC表面, 从而可以产生多个克隆的CTL细胞, 针对不同HLA Ⅰ类和Ⅱ类表型均能引起有效的T细胞反应, 其杀伤效果明显高于单抗原表位疫苗[16]. Slingluff et al[17]在一项前瞻性随机临床研究中比较了多表位肽疫苗与单一表位肽疫苗应用于黑色素瘤患者时的免疫原性. 多表位肽疫苗由12肽的黑色素细胞分化蛋白和肿瘤-睾丸抗原混合而成, 而单一表位肽疫苗仅含4肽的黑色素细胞分化蛋白, 结果显示12肽的多表位肽疫苗在所有患者均产生了免疫性, 并较对照组诱导出了更为广泛且更强烈的免疫反应.
如前所述, CD4+ Th细胞在激发和维持抗肿瘤免疫的过程中起到了重要的作用. 单一表位多肽因主要组织相溶性复合物多态性原因, 使其免疫应答因缺乏适当的辅助T淋巴细胞而无法引导出充分的细胞毒性T淋巴细胞和抗体反应. 故在多肽疫苗中增添Th表位成为提高疫苗免疫原性、增强T细胞反应的又一个有效的途径. Dechamma et al[18]在研究中以PPRV来源的MAP1-MAP6等6条多分支肽为抗原, 分别单独及联合通用Th表位免疫新西兰兔, 以研究Th表位对多肽免疫原性的影响, 结果表明联用Th表位免疫组抗体效价比单独免疫组明显增高.
一些多肽疫苗穿透力不强, 不易进入APC细胞, 难以形成"抗原肽-MHCⅠ类分子"复合物, 最终表现为弱免疫原性, 因而不能有效的激发特异性免疫反应. 如何使免疫原有效的进入APC细胞的MHC-Ⅰ类系统, 是肿瘤免疫治疗研究中急需解决的一个难题. 近年来, 一些具有细胞膜穿透能力的多肽相继被发现, 他们可穿过细胞膜进入细胞质甚至细胞核, 而细胞膜却完好无损. 这些多肽具有水溶性、低裂解性并通过非吞噬作用进入各种细胞膜, 称之为穿膜肽(cell-penetrating peptides, CPP). 其可介导如DNA、多胺类, 甚至比自身分子量大很多倍的寡聚核苷酸进入细胞. 该分子可以作为一种全新的载体, 他不需要能量, 可以挂载的分子类型多且分子质量大. 有研究报道, 将肿瘤抗原或CTL表位与一些可穿透细胞膜的短肽序列融合后, 可以使其更快速、更有效地进入活细胞胞质, 且明显增强其免疫原性[19-21]. 借助穿膜肽的作用增强多肽疫苗的免疫原性及穿膜能力, 在肿瘤疫苗开发及药物体内转运等方面具有诱人的前景, 值得进一步的研究.
黑色素瘤通常对常规全身治疗耐受, 且被认为是一种具有高免疫原性的肿瘤, 非常适合进行免疫治疗, 因此目前大部分的肿瘤多肽疫苗临床研究都集中于该疾病. Letsch et al[22]运用多肽疫苗治疗9名至少进行过3次黑色素瘤切除术后又再次复发的患者, 并进行长期随访, 其中2名在随访期内(分别27 mo, 42 mo)未见复发, 另2名仅出现单处或多处早期复发(均可经手术切除)并在其后随访期内(分别18 mo, 65 mo)未见复发, 且4名停止复发的患者均对疫苗产生了免疫应答, 该研究小组认为应用多肽疫苗可以延长恶性黑色素瘤复发间隔时间. Atzpodien et al[23]以黑色素瘤抗原MelanA/MART1, MAGE-1, gp100及酪氨酸酶联合GM-CSF构建多肽疫苗治疗24名恶性黑色素瘤复发切除术后的患者, 结果显示2年内未出现转移者占8.6%, 2年内未出现远处转移者占68%, 2年总的生存率为85%, 且治疗过程中患者耐受良好, 未见严重副反应.
与黑色素瘤相比, 多肽疫苗应用于其他肿瘤的临床研究报道相对较少. Yamanaka et al[24]分析神经胶质瘤治疗的相关文献后, 认为基于多肽的免疫疗法可以成功诱导抗胶质瘤免疫反应, 且能延长神经胶质瘤患者的生存期而没有明显的副反应. Noguchi et al[25]将个性化的多肽疫苗用于局限性前列腺癌患者根治术(RRP)前治疗, 以单纯行RRP的患者作为对照, 结果表明多肽疫苗安全且无严重副作用, 实验组CTL反应和抗多肽IgG滴度增加, CD45RO(+)浸润细胞的强度明显高于对照组, 并且CD8(+)T细胞浸润仅在实验组出现, 提示应用多肽疫苗后增强了免疫反应. Bolonaki et al[26]以多肽TERT572Y免疫22名进展期非小细胞性肺癌患者, 第2次免疫后有16(76.2%)个患者出现TERT572Y特异性T细胞反应, 而此比率在第6次免疫后上升到90.9%, 整个实验过程中, 病情稳定率达36.4%(8/22). 并且研究者在其后的随访中发现, 出现早期免疫应答的患者比无应答的患者中位生存期明显延长(分别为30.0 mo和4.1 mo), 提示免疫应答率和生存时间成正相关. Sato et al[27]用多肽疫苗治疗HLA-A24限制性进展期大肠癌患者, 每名患者在14个候选肽中选择4种作为多肽疫苗进行免疫治疗, 免疫应答监测使用不同的检测方法. 结果用标准51Gr释放实验检测有56%的患者出现特异性CTL反应, 用DTH反应检测有30%的患者出现阳性反应, 用抗多肽抗体检测有70%的患者出现血清抗多肽抗体. 然而临床反应和免疫应答并不完全一致, 完成实验的10例患者中只有1例部分缓解, 1例病情稳定, 而其他的病情继续进展.
随着计算机模拟信息学和免疫学的发展, 各种新的肿瘤相关抗原的CTL表位不断被预测和鉴定并应用至临床, 使人工合成多肽疫苗治疗恶性肿瘤的方法得以成为现实. 多肽疫苗因其合成简单、成本低廉、无明显副作用、免疫针对性强等优点而较其他治疗方法更具有竞争性, 因而具有更广泛的应用前景. 但是其本身也存在一些问题, 如人工合成多肽疫苗免疫原性欠佳, 受HLA表型限制, 在一些临床研究中免疫应答和临床反应不一致等, 需要进一步的研究以不断完善和解决.
随着对肿瘤发生、发展分子机制研究的深入和生物技术的迅速发展, 生物治疗已经成为肿瘤治疗的第四种模式, 包括体细胞疗法与细胞因子疗法、放射靶向治疗、基因治疗、分子靶向治疗及肿瘤疫苗等.
张凤春, 教授, 上海交通大学医学院附属仁济医院肿瘤中心.
随着免疫学的不断发展, 肿瘤的免疫疗法已成为当前研究的热点, 而多肽疫苗因其许多优点, 更受到广泛的关注.
Slingluff et al在一项前瞻性随机临床研究中比较了多表位肽疫苗与单一表位肽疫苗应用于黑色素瘤患者时的免疫原性. 结果显示12肽的多表位肽疫苗在所有患者均产生了免疫性, 并较对照组诱导出了更为广泛且更强烈的免疫反应.
肿瘤多肽疫苗因制作工序简单、费用低廉、化学性质稳定、无致癌性等优点而成为肿瘤免疫治疗的新方法.
本文选题先进, 层次清楚, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Yang JM, Peng ZH, Si SH, Liu WW, Luo YH, Ye ZY. KAI1 gene suppresses invasion and metastasis of hepatocellular carcinoma MHCC97-H cells in vitro and in animal models. Liver Int. 2008;28:132-139. [PubMed] |
| 2. | Goto Y, Matsuzaki Y, Kurihara S, Shimizu A, Okada T, Yamamoto K, Murata H, Takata M, Aburatani H, Hoon DS. A new melanoma antigen fatty acid-binding protein 7, involved in proliferation and invasion, is a potential target for immunotherapy and molecular target therapy. Cancer Res. 2006;66:4443-4449. [PubMed] [DOI] |
| 3. | Bijker MS, Melief CJ, Offringa R, van der Burg SH. Design and development of synthetic peptide vaccines: past, present and future. Expert Rev Vaccines. 2007;6:591-603. [PubMed] [DOI] |
| 4. | Lee GR, Kim ST, Spilianakis CG, Fields PE, Flavell RA. T helper cell differentiation: regulation by cis elements and epigenetics. Immunity. 2006;24:369-379. [PubMed] [DOI] |
| 5. | Tsuruma T, Hata F, Furuhata T, Ohmura T, Katsuramaki T, Yamaguchi K, Kimura Y, Torigoe T, Sato N, Hirata K. Peptide-based vaccination for colorectal cancer. Expert Opin Biol Ther. 2005;5:799-807. [PubMed] [DOI] |
| 6. | Nasta F, Ubaldi V, Pace L, Doria G, Pioli C. Cytotoxic T-lymphocyte antigen-4 inhibits GATA-3 but not T-bet mRNA expression during T helper cell differentiation. Immunology. 2006;117:358-367. [PubMed] [DOI] |
| 7. | Schietinger A, Philip M, Yoshida BA, Azadi P, Liu H, Meredith SC, Schreiber H. A mutant chaperone converts a wild-type protein into a tumor-specific antigen. Science. 2006;314:304-308. [PubMed] [DOI] |
| 8. | Deveci MS, Deveci G. Prognostic value of p53 protein and MK-1 (a tumor-associated antigen) expression in gastric carcinoma. Gastric Cancer. 2007;10:112-116. [PubMed] [DOI] |
| 9. | Kwissa M, Kasturi SP, Pulendran B. The science of adjuvants. Expert Rev Vaccines. 2007;6:673-684. [PubMed] [DOI] |
| 10. | Scheibenbogen C, Schadendorf D, Bechrakis NE, Nagorsen D, Hofmann U, Servetopoulou F, Letsch A, Philipp A, Foerster MH, Schmittel A. Effects of granulocyte-macrophage colony-stimulating factor and foreign helper protein as immunologic adjuvants on the T-cell response to vaccination with tyrosinase peptides. Int J Cancer. 2003;104:188-194. [PubMed] [DOI] |
| 11. | Decker WK, Xing D, Shpall EJ. Dendritic cell immunotherapy for the treatment of neoplastic disease. Biol Blood Marrow Transplant. 2006;12:113-125. [PubMed] [DOI] |
| 12. | Papewalis C, Wuttke M, Jacobs B, Domberg J, Willenberg H, Baehring T, Cupisti K, Raffel A, Chao L, Fenk R. Dendritic cell vaccination induces tumor epitope-specific Th1 immune response in medullary thyroid carcinoma. Horm Metab Res. 2008;40:108-116. [PubMed] [DOI] |
| 13. | Connolly NC, Whiteside TL, Wilson C, Kondragunta V, Rinaldo CR, Riddler SA. Therapeutic immunization with human immunodeficiency virus type 1 (HIV-1) peptide-loaded dendritic cells is safe and induces immunogenicity in HIV-1-infected individuals. Clin Vaccine Immunol. 2008;15:284-292. [PubMed] [DOI] |
| 14. | Amexis G, Young NS. Multiple antigenic peptides as vaccine platform for the induction of humoral responses against dengue-2 virus. Viral Immunol. 2007;20:657-663. [PubMed] [DOI] |
| 15. | Ciesielski MJ, Kazim AL, Barth RF, Fenstermaker RA. Cellular antitumor immune response to a branched lysine multiple antigenic peptide containing epitopes of a common tumor-specific antigen in a rat glioma model. Cancer Immunol Immunother. 2005;54:107-119. [PubMed] [DOI] |
| 16. | Chen L, Liang GP, Tang XD, Chen T, Cai YG, Fang DC, Yu ST, Luo YH, Yang SM. In vitro anti-tumor immune response induced by dendritic cells transfected with hTERT recombinant adenovirus. Biochem Biophys Res Commun. 2006;351:927-934. [PubMed] [DOI] |
| 17. | Slingluff CL Jr, Petroni GR, Chianese-Bullock KA, Smolkin ME, Hibbitts S, Murphy C, Johansen N, Grosh WW, Yamshchikov GV, Neese PY, Patterson JW, Fink R, Rehm PK. Immunologic and clinical outcomes of a randomized phase II trial of two multipeptide vaccines for melanoma in the adjuvant setting. Clin Cancer Res. 2007;13:6386-6395. [PubMed] [DOI] |
| 18. | Dechamma HJ, Dighe V, Kumar CA, Singh RP, Jagadish M, Kumar S. Identification of T-helper and linear B epitope in the hypervariable region of nucleocapsid protein of PPRV and its use in the development of specific antibodies to detect viral antigen. Vet Microbiol. 2006;118:201-211. [PubMed] [DOI] |
| 19. | Kinyanjui MW, Fixman ED. Cell-penetrating peptides and proteins: new inhibitors of allergic airways disease. Can J Physiol Pharmacol. 2008;86:1-7. [PubMed] [DOI] |
| 20. | Morris MC, Deshayes S, Heitz F, Divita G. Cell-penetrating peptides: from molecular mechanisms to therapeutics. Biol Cell. 2008;100:201-217. [PubMed] [DOI] |
| 21. | Cohen JL, Almutairi A, Cohen JA, Bernstein M, Brody SL, Schuster DP, Frechet JM. Enhanced cell penetration of Acid-degradable particles functionalized with cell-penetrating peptides. Bioconjug Chem. 2008;19:876-881. [PubMed] [DOI] |
| 22. | Letsch A, Keilholz U, Fluck M, Nagorsen D, Asemissen AM, Schmittel A, Thiel E, Scheibenbogen C. Peptide vaccination after repeated resection of metastases can induce a prolonged relapse-free interval in melanoma patients. Int J Cancer. 2005;114:936-941. [PubMed] [DOI] |
| 23. | Atzpodien J, Reitz M. GM-CSF plus antigenic peptide vaccination in locally advanced melanoma patients. Cancer Biother Radiopharm. 2007;22:551-555. [PubMed] [DOI] |
| 24. | Yamanaka R, Itoh K. Peptide-based immunotherapeutic approaches to glioma: a review. Expert Opin Biol Ther. 2007;7:645-649. [PubMed] [DOI] |
| 25. | Noguchi M, Yao A, Harada M, Nakashima O, Komohara Y, Yamada S, Itoh K, Matsuoka K. Immunological evaluation of neoadjuvant peptide vaccination before radical prostatectomy for patients with localized prostate cancer. Prostate. 2007;67:933-942. [PubMed] [DOI] |
| 26. | Bolonaki I, Kotsakis A, Papadimitraki E, Aggouraki D, Konsolakis G, Vagia A, Christophylakis C, Nikoloudi I, Magganas E, Galanis A. Vaccination of patients with advanced non-small-cell lung cancer with an optimized cryptic human telomerase reverse transcriptase peptide. J Clin Oncol. 2007;25:2727-2734. [PubMed] [DOI] |
| 27. | Sato Y, Maeda Y, Shomura H, Sasatomi T, Takahashi M, Une Y, Kondo M, Shinohara T, Hida N, Katagiri K. A phase I trial of cytotoxic T-lymphocyte precursor-oriented peptide vaccines for colorectal carcinoma patients. Br J Cancer. 2004;90:1334-1342. [PubMed] [DOI] |