修回日期: 2008-03-29
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 观察培养的肠肌间神经丛神经元对平滑肌细胞增殖的抑制作用.
方法: 成年♀Sprague-Dawley大鼠结肠环行平滑肌细胞体外培养, 当平滑肌细胞增殖并形成细胞薄层覆满玻片时, 植入小肠肌间神经丛神经节和结肠平滑肌细胞共同培养10 d. 培养体经固定后行双重免疫荧光染色, 记数VIP阳性神经元占总神经元的百分比, 观察VIP阳性神经元和平滑肌细胞的生长关系.
结果: 体外培养后VIP阳性神经元占总神经元的百分比为27.3%±5.6%, VIP阳性神经纤维所分布之处, 平滑肌细胞明显减少.
结论: VIP阳性神经元调节肠平滑肌细胞的增殖.
引文著录: 林中, 张剑波, 赵永忠, EkbladEva. 小肠肌间神经丛神经元体外培养抑制肠平滑肌细胞的增殖. 世界华人消化杂志 2008; 16(14): 1577-1580
Revised: March 29, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To observe the inhibitory effect of myenteric neurons on the proliferation of cultured smooth muscle cells from rat colon.
METHODS: Circular smooth muscle cells from the colon of adult female Sprague-Dawley rats were cultured. When the cultured smooth muscle cells reached confluence, myenteric ganglia from the rat small intestine were dissociated and co-cultured with smooth muscle cells for 10 d. Immunofluorescent techniques were employed for double labeling of the preparations. The percentage of VIP-immunoreactive neurons was calculated based on the total neurons of Hu-immunoreactivity. Immunocytochemistry with anti-VIP and anti-smooth muscle a-actin was employed to reveal the relationship between the cultured myenteric neurons and smooth muscle cells.
RESULTS: After co-culture in vitro, the percentage of VIP-immunoreactive neurons was 27.3% ± 5.6%. The number of smooth muscle cells was markedly decreased within the innervation area of VIP-immunoreactive fibers.
CONCLUSION: VIP-ergic neurons modulate the proliferation of cultured smooth muscle cells.
- Citation: Lin Z, Zhang JB, Zhao YZ, Ekblad E. Myenteric neurons of small intestine inhibit proliferation of smooth muscle cells cultured in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1577-1580
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1577
肠神经系统(enteric nervous systen, ENS)是胃肠道内在的神经组织. 胃肠平滑肌细胞是ENS神经元所支配的效应器之一, 在长期的演化过程中肠神经元-平滑肌形成了相互对应关系, 以维持功能的稳定性. 神经系统的神经元具有重塑(plasticity)这一特点[1], 成年后ENS神经元仍可重塑, 肠神经元或靶器官任何一方受到损害, 或体内内环境发生改变的情况下, 神经元将发生适应性改变, 重塑神经-靶器官的关系[2-4], 以维持正常的生理功能. 我们以前的实验观察到, ENS肌间神经丛神经元体外培养后血管活性肠肽(vasoactive intestinal polypeptide, VIP)阳性神经元的比例增加[5], 而VIP有广泛的生物学活性包括抑制平滑肌细胞增殖[6-7]. 本实验利用体外培养的ENS肌间神经丛神经元和肠平滑肌细胞, 观察ENS神经元对平滑肌细胞增殖的调节作用.
成年♂Sprague-Dawley(SD)大鼠, 体质量180-250 g, 培养液为Neurobasal A(美国Gibco BRL公司). 小鼠抗Hu蛋白(HuC/HuD)购于美国Molecular Probes公司; 兔抗VIP购于瑞典Euro-Diagnostica公司; 小鼠抗α-SM-actin购于美国Sigma公司.
1.2.1 大鼠远端结肠平滑肌细胞培养: 成年♂SD大鼠ip水合氯醛(30 mg/100 g体质量)麻醉, 剖腹取远端结肠肠段. 以下操作在冰Kreb液中进行. 沿系膜侧将肠段剪开, 黏膜面朝上平展固定于琼脂平皿中, 钝性剥离黏膜层和黏膜下层, 暴露环行肌层, 取环行平滑肌束置入培养皿中进行体外培养. 平滑肌束中的平滑肌细胞在体外培养条件下可不断分裂增殖, 但平滑肌束必须贴附在培养皿底部的玻片上才能成功地进行细胞增殖. 培养液为Neurobasal A, 每3天换液1次. 每次换液前在反转显微镜(inverted microscope)下观察培养体生长情况.
1.2.2 大鼠小肠肌间神经丛神经元和平滑肌细胞共同培养: 当培养的结肠平滑肌细胞在玻片上形成薄层细胞层并覆满盖玻片时, 取成年♂SD大鼠小肠肌间神经丛神经元与结肠平滑肌细胞同室培养. 大鼠麻醉后开腹, 活体上钝性剥离的方法用手术刀片将纵行肌连同肌间神经丛神经节一同取下, 消化酶(胶原酶Ⅱ 1.5 g/L, 蛋白酶1.5 g/L)37℃消化90 min, 离心分离后在解剖显微镜下用10 μL移液管挑选出分离完好的神经节, 移入已有平滑肌细胞生长的培养皿中共同培养, 每个培养皿接受20-30个神经节. 培养条件: 37℃, 50 mL/L CO2, 950 mg/L空气. 培养液为Neurobasal A, 每3天换液1次, 反转显微镜监看生长情况. 上述实验3批共15个培养皿. 以单纯结肠平滑肌细胞培养作为对照, 观察无肌间神经丛神经元存在情况下平滑肌细胞生长情况.
1.2.3 免疫荧光染色: 肌间神经丛神经元和结肠平滑肌细胞共同培养第10天, 经Stefanini固定液固定30 min, 磷酸缓冲液2次漂洗后, -20℃保存待测. 采用间接免疫荧光染色法, 以小鼠抗Hu蛋白显示全部神经元[8]; 显示血管活性肠肽VIP阳性神经元用兔抗VIP; 显示结肠平滑肌细胞用小鼠抗α-SM-actin. 计算VIP阳性神经元的百分比采用间接免疫荧光染色法行Hu蛋白和VIP双重染色; VIP与α-SM-actin双重染色观察VIP阳性神经元及其神经纤维与平滑肌细胞的生长关系. 分别以FITC(绿色)、Cy3(红色)标志的二抗显示不同的一抗. 二抗有抗兔IgG, 抗小鼠IgG.
体外培养3-5 d后增殖的平滑肌细胞迅速从原平滑肌束向周边平铺生长, 约10 d左右原平滑肌束消失, 增殖的平滑肌细胞形成一细胞薄膜. 平滑肌细胞形状呈双极的梭形细胞, 排列方向一致. 之后随着时间的推移, 平滑肌细胞层增厚, 细胞培养体经历了平滑肌细胞膜出现裂隙、平滑肌束形成、皱缩成团等改变.
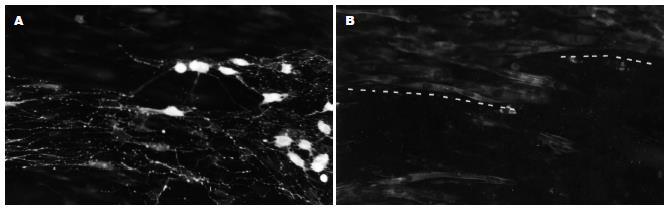
植入小肠肌间神经丛神经节与结肠平滑肌细胞共同培养后, 新生的神经纤维从神经节长出并向周边延伸. 约4 d后原神经节形态消失, 存活的神经元形成一细胞群, 向外生长的神经纤维与平滑肌细胞密切接触. 双重免疫荧光染色显示, VIP阳性神经纤维所延伸到的区域, 平滑肌细胞的数量明显减少, 仅保留2-3层平滑肌细胞层(图1). 而无神经纤维覆盖的区域, 其平滑肌细胞呈多层生长, 与单纯平滑肌培养皿中的平滑肌细胞生长情形一致.
Hu蛋白有高度的神经元特异性, 能标志出所有的肠神经元, 故常以Hu蛋白作为神经元标志物显示全部神经元, 以此计算出各类神经元的百分比[8]. 本实验中, VIP阳性神经元在全部神经元中所占的百分比为27.3%±5.6%.
本实验利用大鼠小肠肌间神经丛神经元和结肠平滑肌细胞共同培养模型, 观察小肠肌间神经丛神经元体外培养条件下对平滑肌细胞增殖的抑制作用. 本实验结果的主要特征: 一是VIP阳性神经纤维所分布之处, 肠平滑肌细胞的增殖受到抑制, 肠平滑肌变得稀少; 二是肌间神经丛神经元体外培养后VIP阳性神经元在总神经元中的百分比增加, 增至27.3%±5.6%, 较活体内增加7倍以上, 与我们的系列实验结果一致[5], 而活体内小肠肌间神经丛VIP阳性神经元在总神经元中的百分比为3.6%, 显示了体外培养时小肠肌间神经丛神经元发生了重塑. 体外培养后VIP阳性神经元增加可能与其分泌的VIP促进自身存活有关[9], 也可能与抑制肠平滑肌细胞增殖有关.
当SD幼鼠小肠环行肌、纵行肌连同其间的肠肌间神经丛神经元制成细胞悬液进行体外培养时, 用神经毒性药物蝎毒选择性地清除神经元后, 肠平滑肌细胞数量上较未清除神经元的对照组增加40%[10], 提示肠肌间神经丛神经元有抑制平滑肌增殖的作用. 肠肌间神经丛神经元种类众多, 目前认为VIP阳性神经元能调控肠平滑肌细胞的增殖. 培养液中添加VIP可抑制培养中的肠平滑肌细胞[6]、气管平滑肌[7]的增殖. 在缺失VIP基因(因而体内不能产生VIP)的C57BL/6小鼠, 肠壁间VIP阳性神经纤维缺失, 肠壁平滑肌层明显增厚[11]. 缺失VIP也导致支气管平滑肌增生, 气管壁肌层增厚[12]. 进一步研究发现, 伴随VIP基因缺失, 肺组织中有广泛的其他基因表达的改变, 包括促肺血管平滑肌细胞增殖基因的过度表达和抗增殖基因表达的下调[13]. 当结扎大鼠末端回肠形成不全性肠梗阻时, 梗阻近端肠壁的平滑肌层增厚, 并伴有VIP阳性神经元的显著增加; 相反, 旷置萎缩的肠段VIP阳性神经元的数量减少[4]. 在人类, 肠Crohn病的病变肠段也可见到VIP阳性神经元的增加[14]. 这些改变可能是VIP阳性神经元-靶器官之间相互适应性调节的结果, 以维持相对正常的器官功能. 比如在肠Crohn病时, 受炎症刺激肠壁平滑肌细胞增生, 部分ENS神经元发生重塑转变为VIP能神经元, 以抑制无序的平滑肌细胞增生. 若失掉VIP能神经元对平滑肌细胞的调控, 平滑肌细胞的增殖可能会失控, 导致肠功能紊乱.
胃肠道动力性疾病如贲门失弛缓症、先天性巨结肠症的发病机制都与ENS的抑制性神经元和兴奋性神经元失衡有关. 一项实验称, 来自贲门失弛缓症患者的血清可导致体外培养的正常人胃底肌间神经丛神经元重塑, 包括VIP阳性神经元和NOS阳性神经元百分比的减少[15]. 这项研究结果提示, 通过调控相关基因如VIP基因的表达, 某些胃肠道神经源性疾病可望得到有效的治疗. 最近, 人们已经开始致力研发VIP类似物治疗哮喘和慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)[16]. 中药对ENS神经元基因的表达也有影响[17-18]. 本实验建立的肌间神经丛神经元与平滑肌细胞体外培养模型以及研究发现, 为今后进一步研究VIP与平滑肌细胞的关系, 以及研发相关药物提供研究基础.
临床上胃肠动力性疾病非常多见. 对胃肠平滑肌的神经控制, 胃肠壁内的肠神经系统(ENS)较自主神经更为重要, ENS的神经元通过分泌抑制性神经递质(VIP、NOS)和兴奋性神经递质(Ach、SP)调节平滑肌的舒张和收缩. 因此, 研究肠神经系统的生理和病理是揭开胃肠动力性疾病发病机制的关键.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
本研究建立的肌间神经丛神经元与平滑肌细胞体外培养模型以及研究成果, 为今后进一步研究VIP与平滑肌的关系, 以及研发相关药物提供研究基础.
神经元重塑(plas-ticity): 在特定条件下, 神经元可发生适应性改变获得新的功能. 神经元重塑主要表现在其神经递质的改变, 既重新获得合成某些神经递质的能力, 或某些神经递质表达的上调或下调.
本研究创新性较好, 对进一步研究平滑肌细胞增殖有参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Ruediger T, Bolz J. Neurotransmitters and the development of neuronal circuits. Adv Exp Med Biol. 2007;621:104-115. [PubMed] |
| 2. | Ekblad E, Bauer AJ. Role of vasoactive intestinal peptide and inflammatory mediators in enteric neuronal plasticity. Neurogastroenterol Motil. 2004;16 Suppl 1:123-128. [PubMed] [DOI] |
| 4. | Ekelund KM, Ekblad E. Structural, neuronal, and functional adaptive changes in atrophic rat ileum. Gut. 1999;45:236-245. [PubMed] |
| 5. | Lin Z, Sandgren K, Ekblad E. Increased expression of vasoactive intestinal polypeptide in cultured myenteric neurons from adult rat small intestine. Auton Neurosci. 2003;107:9-19. [PubMed] [DOI] |
| 6. | van Assche G, Depoortere I, de Vos R, Geboes K, Janssens JJ, Collins SM, Peeters TL. Region-specific antiproliferative effect of VIP and PACAP-(1-38) on rabbit enteric smooth muscle. Am J Physiol. 1999;276:G303-G310. [PubMed] |
| 7. | Maruno K, Absood A, Said SI. VIP inhibits basal and histamine-stimulated proliferation of human airway smooth muscle cells. Am J Physiol. 1995;268:L1047-L1051. [PubMed] |
| 8. | Lin Z, Gao N, Hu HZ, Liu S, Gao C, Kim G, Ren J, Xia Y, Peck OC, Wood JD. Immunoreactivity of Hu proteins facilitates identification of myenteric neurones in guinea-pig small intestine. Neurogas-troenterol Motil. 2002;14:197-204. [PubMed] [DOI] |
| 9. | Sandgren K, Lin Z, Svenningsen AF, Ekblad E. Vasoactive intestinal peptide and nitric oxide promote survival of adult rat myenteric neurons in culture. J Neurosci Res. 2003;72:595-602. [PubMed] [DOI] |
| 10. | Blennerhassett MG, Lourenssen S. Neural regulation of intestinal smooth muscle growth in vitro. Am J Physiol Gastrointest Liver Physiol. 2000;279:G511-G519. [PubMed] |
| 11. | Lelievre V, Favrais G, Abad C, Adle-Biassette H, Lu Y, Germano PM, Cheung-Lau G, Pisegna JR, Gressens P, Lawson G. Gastroin-testinal dysfunction in mice with a targeted mutation in the gene encoding vasoactive intestinal polypeptide: a model for the study of intestinal ileus and Hirschsprung's disease. Peptides. 2007;28:1688-1699. [PubMed] [DOI] |
| 12. | Said SI, Hamidi SA, Dickman KG, Szema AM, Lyubsky S, Lin RZ, Jiang YP, Chen JJ, Waschek JA, Kort S. Moderate pulmonary arterial hypertension in male mice lacking the vasoactive intestinal peptide gene. Circulation. 2007;115:1260-1268. [PubMed] |
| 13. | Hamidi SA, Prabhakar S, Said SI. Enhancement of pulmonary vascular remodelling and inflammatory genes with VIP gene deletion. Eur Respir J. 2008;31:135-139. [PubMed] [DOI] |
| 14. | Boyer L, Sidpra D, Jevon G, Buchan AM, Jacobson K. Differential responses of VIPergic and nitrergic neurons in paediatric patients with Crohn's disease. Auton Neurosci. 2007;134:106-114. [PubMed] [DOI] |
| 15. | Bruley des Varannes S, Chevalier J, Pimont S, Le Neel JC, Klotz M, Schafer KH, Galmiche JP, Neunlist M. Serum from achalasia patients alters neurochemical coding in the myenteric plexus and nitric oxide mediated motor response in normal human fundus. Gut. 2006;55:319-326. [PubMed] [DOI] |