修回日期: 2008-03-12
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 探讨人类巨噬细胞金属弹力酶(human macrophage metalloelastase, HME)在人胃癌中的表达对肿瘤进展及预后的影响.
方法: 选取完整随访资料的胃癌存档蜡块65例(男57例, 女8例, 患者年龄30-74岁, 分期T1-T4)进行免疫组化和原位杂交分析, 评价HME表达与人胃癌临床病理学因素的相关性及其对疾病预后的意义.
结果: HME蛋白及mRNA高表达率在分化类型较高的胃癌组织中较高(67.74% vs 41.18%, 77.42% vs 52.94%, 均P<0.05), 血管浸润的胃癌组织低于无血管浸润者(31.25% vs 75.76%, 40.63% vs 87.88%, 均P<0.01), 术后复发者低于无术后复发者(37.50% vs 63.41%, P<0.05; 41.67% vs 78.05%, P<0.01). HME蛋白及mRNA高表达率与性别、年龄、肿瘤位置、大小、组织浸润深度及远处转移均无明显相关性, 胃癌术后5年内复发死亡患者HME蛋白及mRNA高表达率明显低于术后生存5年以上者(37.04% vs 74.29%, P<0.01; 48.15% vs 77.14%, P<0.05). HME表达为胃癌预后的独立影响因素, HME蛋白及mRNA高表达者预后较好(OR = 0.323, OR = 0.377; 均P<0.05).
结论: HME高表达与预后较好的密切相关, 可能成为反映胃癌生物学行为及预测预后的有效指标.
引文著录: 程芃, 许建明, 石海, 江佛湖. 胃癌HME表达的临床病理学意义. 世界华人消化杂志 2008; 16(14): 1519-1524
Revised: March 12, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To investigate the expression of human macrophage metalloelastase (HME) in gastric carcinoma, and its influence on tumor progression and disease prognosis.
METHODS: Sixty-five gastric carcinoma patients (57 men and 8 women with ages ranging from 30 to 74, stage T1-T4) who underwent surgical resection were followed up. HME expression in gastric carcinoma was detected both at protein and mRNA level by immunohistochemistry and in situ hybridization, respectively. The correlation between HME expression and its clinicopathologic factors, and the role of HME in the prognosis of gastric cancer were evaluated.
RESULTS: The high-level expression rate of HME was significantly higher both at protein and mRNA level in the well-differentiated gastric carcinoma tissues than that in the poorly-differentiated tissues (67.74% vs 41.18%, 77.42% vs 52.94%; both P < 0.05), but it was markedly lower in the cancer tissues with vascular invasion than that in the cancer tissues without vascular invasion (31.25% vs 75.76%, 40.63% vs 87.88%; both P < 0.01), as well as in the patients with occurrence than that in those without occurrence (37.50% vs 63.41%, P < 0.05; 41.67% vs 78.05%, P < 0.01). HME expression showed no notable correlation with the sex and age of patients, tumor location, tumor size, depth of invasion and metastases. The mortality rate of patients survived less than 5 years after operation was markedly lower than that of patients survived more than 5 years (37.04% vs 74.29%, P < 0.01; 48.15% vs 77.14%, P < 0.05). HME was an independent prognostic factor for gastric carcinoma, and the patients with a higher HME expression had a better prognosis (OR = 0.323, OR = 0.377; both P < 0.05).
CONCLUSION: Hig expression of HME is closely related to a favorable prognosis, and HME may serve as an effective indicator for the prediction of biological behavior and disease prognosis in gastric carcinoma.
- Citation: Cheng P, Xu JM, Shi H, Jiang FH. Clinicopathologic significance of human macrophage metalloelastase expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1519-1524
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1519.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1519
人类巨噬细胞金属弹力酶(human macrophage metalloelastase, HME)是一种依赖Zn2+的中性肽链内切酶, 为基质金属蛋白酶(matrix metallo- proteinases, MMPs)家族中的一员, 命名为MMP-12. MMPs在肿瘤发展机制中的作用迥异, 以往多被认为MMPs通过细胞外基质的降解促进肿瘤的浸润和转移, 加速肿瘤的发展. 近年来发现一些MMPs具有抗肿瘤活性. 有研究报道, HME可使纤溶酶原转化为血管稳定因子(angiostatin), 从而可能抑制内皮细胞增生和肿瘤血管形成, 降低转移机率[1-2]. 然而, HME表达对于肿瘤预后的影响尚无统一定论, 似乎在不同部位其预后影响截然不同. 到目前为止, 认为HME在肝细胞肿瘤[3]、Barrett's食管发生癌变[4]及大肠癌[5]中是反映预后生存期较长的一个因素; 在胰腺癌[6]、皮肤癌[7]以及喉肿瘤[8], HME与肿瘤的较强攻击性和较差分化相关. 有关胃癌的恶性生物学行为与HME相关的临床研究尚未见报道. 我们探讨HME在人胃癌中的表达对肿瘤进展及疾病预后的影响.
安徽医科大学第一附属医院1996-08/2004-10经手术病理证实的各期胃癌存档病例, Excel登录各个患者的性别、年龄、肿瘤部位、肿瘤大小、组织学分型、浸润深度、血管及淋巴管的浸润和转移情况等. 采用问卷调查和/或胃镜复查的方式进行预后随访, 登录获随访患者的生存时间、复发情况和死亡原因等, 随访时间截止至2005年. 总共收集有完整随访资料的患者(男57, 女8)65例, 患者年龄30-74(56.80±10.17)岁, 所有患者手术前均无放化疗史, 术后均给予辅助化疗. 经HE染色确定胃癌的组织学分型、组织浸润深度、淋巴管和血管浸润情况.
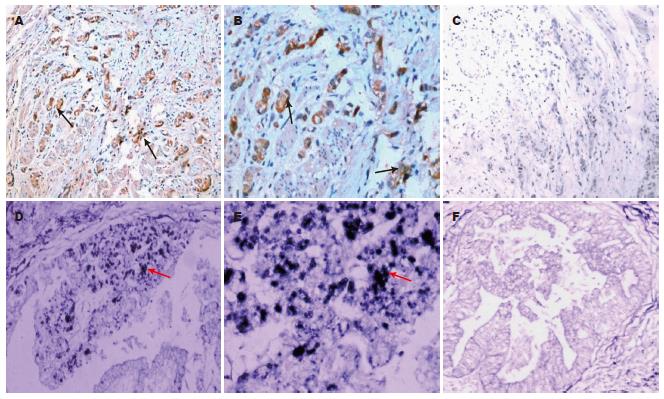
1.2.1 胃癌组织中HME蛋白表达的检测: 石蜡包埋组织切片厚3 μm, 经脱蜡、水化, 按要求进行抗原修复后, 运用抗生物素蛋白-生物素-过氧化物酶复合物法(ABC)进行酶免疫组织化学染色, 一抗: 羊多抗人MMP-12按1:100比例稀释; 鼠单抗人VEGF即用型, DAB显色, 苏木素复染. 采用PBS代替第一抗体作为阴性对照. 阳性者可见细胞胞质或胞膜染色为棕黄色颗粒. HME蛋白表达结果检测: 计数1000个细胞, 按切片中看到有<25%的细胞胞质或胞膜染色阳性, 判定为HME阴性或低表达; ≥25%的染色阳性, 判定为HME高表达.
1.2.2 原位杂交胃癌组织中HME mRNA表达的检测: 石蜡包埋组织切片(玻片经DEPC预处理)厚3 μm. 胃蛋白酶暴露mRNA核酸片段, 经预杂交后加入探针, 地高辛RNA标记试剂盒进行标记, 核酸检测试剂盒检测杂交的地高辛标记的探针, DAB显色(为区分于IH, 采用蓝色DAB). 阴性对照采用探针稀释液作为杂交探针, 在相同条件下用相同方法对连续切片进行ISH检测. RT-PCR方法从人胃癌组织中提取并逆转录HME mRNA(上、下游引物分别为5'-GAACCGTGAGGATGTTGACT-3, 5'-AGTTTGTGCCTCCTGAATGT-3', 片段长度260 bp, 位于催化区第3-4外显子), 通过聚合酶链反应扩增HME cDNA, PCR产物经纯化后, 10 g/L琼脂糖凝胶电泳鉴定. 阳性者可见细胞胞质染色为蓝色颗粒. HME mRNA表达结果检测: 计数1000个细胞, 按切片中看到有<25%的细胞胞质染色阳性, 判定为HME mRNA阴性或低表达; ≥25%的染色阳性, 判定为HME mRNA高表达.
统计学处理 所得数据百分率比较用χ2检验, 配对数据均值比较用t检验, 多组数据均值比较用方差分析. 相关性分析运用双变量相关分析法. 生存时间为胃癌手术之日到最后一次随访或死亡的时间, 生存分析依照Kaplan-Meier方法制作生存曲线, 用Log-rank时序检验法进行生存期统计学差异分析. 运用多元线性回归模型评估分析各种临床病理学因素及HME、VEGF表达情况对胃癌组织MVD的影响. 运用COX比例风险模型评估各种因素对于胃癌预后存活率的影响. 统计学分析应用SPSS软件(在SPSS V10.0 for Windows统计软件包中完成), 在双尾检验基础上, P<0.05为具有统计学意义.
IH检测HME蛋白, ISH检测HME mRNA在胃癌组织中的表达情况见图1.
HME蛋白高表达率在分化类型较高的胃癌组织中高于分化类型较低的胃癌组织(P<0.05); 有血管浸润的胃癌组织低于无血管浸润者(P<0.01); 有术后复发者低于无术后复发者(P<0.05). HME蛋白高表达率与性别、年龄、肿瘤位置、大小、组织浸润深度、淋巴浸润、淋巴结转移及远处转移均无明显相关性.
HME mRNA高表达率在分化类型较高的胃癌组织中较高(P<0.05); 在有淋巴浸润、血管浸润或淋巴结转移的胃癌组织中, HME mRNA高表达率明显低于无淋巴浸润、血管浸润或淋巴结转移者(分别为P<0.05, P<0.01, P<0.05); 有术后复发的患者胃癌组织HME mRNA高表达率明显低于无术后复发者(P<0.01); 与其他临床病理因素均无明显相关性(表1).
| 变量 | n | HME蛋白 | HME mRNA |
| 总数 | 65 | 35(53.85) | 42(64.62) |
| 性别 | |||
| 男 | 57 | 31(54.39) | 37(64.91) |
| 女 | 8 | 4(50.00) | 5(62.50) |
| 年龄(岁) | |||
| <60 | 36 | 19(65.52) | 22(61.11) |
| ≥60 | 29 | 16(44.44) | 20(68.97) |
| 肿瘤位置 | |||
| 贲门 | 20 | 12(60.00) | 12(60.00) |
| 胃体 | 12 | 8(66.67) | 8(66.67) |
| 胃角 | 9 | 4(44.44) | 4(44.44) |
| 胃窦 | 24 | 11(45.83) | 11(45.83) |
| 肿瘤大小 | |||
| <50 mm | 49 | 32(65.31) | 32(65.31) |
| ≥50 mm | 16 | 10(62.50) | 10(62.50) |
| 组织学类型 | |||
| 高中分化 | 31 | 21(67.74) | 24(77.42) |
| 差分化 | 34 | 14(41.18)a | 18(52.94)a |
| 组织浸润 | |||
| 黏膜下层-肌层 | 34 | 18(52.94) | 22(64.71) |
| 浆膜层-穿破浆膜层 | 31 | 17(54.84) | 20(64.52) |
| 淋巴浸润 | |||
| 有 | 40 | 18(45.00) | 22(55.00) |
| 无 | 25 | 17(68.00) | 20(80.00)a |
| 血管浸润 | |||
| 有 | 32 | 10(31.25) | 13(40.63) |
| 无 | 33 | 25(75.76)b | 29(87.88)b |
| 淋巴结转移 | |||
| 有 | 21 | 8(38.10) | 10(47.62) |
| 无 | 44 | 27(61.36) | 32(72.73)a |
| 远处转移 | |||
| 有 | 23 | 10(43.48) | 12(52.17) |
| 无 | 42 | 25(59.52) | 30(71.43) |
| 术后复发 | |||
| 有 | 24 | 9(37.50) | 10(41.67) |
| 无 | 41 | 26(63.41)a | 32(78.05)b |
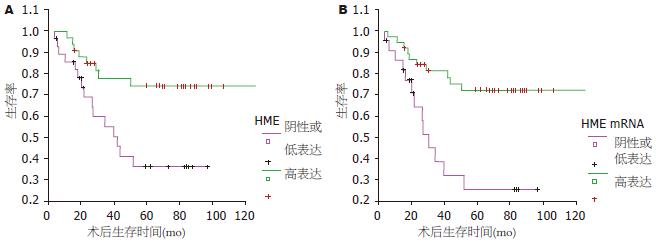
本组收集胃癌患者随访资料62例(去除非胃癌复发和转移引起的死亡者3例), 其中胃癌术后生存时间大于等于5年者35例, 术后5年内胃癌复发、转移死亡者27例. 手术后5年内因胃癌复发死亡的患者标本中, HME高表达率明显低于手术后生存5年以上者(P<0.05, 表2). 依照Kaplan-Meier方法制作生存曲线, 用Log-Rank时序检验法对62例胃癌患者(去除非胃癌复发和转移引起的死亡者3例)进行生存期统计学差异分析. 结果显示, HME高表达的胃癌患者术后生存期明显高于HME阴性或低表达者(图2).
| 变量 | ≥5年n = 35 | ≤5年n = 27 | |
| HME蛋白 | 高表达 | 26(74.29) | 10(37.04) |
| 无或低表达 | 9(25.71) | 17(62.96)b | |
| HME mRNA | 高表达 | 27(77.14) | 13(48.15) |
| 无或低表达 | 8(22.86) | 14(51.85)a |
运用COX比例风险模型进行评估, 分析临床病理学因素及HME表达情况对胃癌预后的影响. 结果表明, 组织浸润深度、淋巴浸润、血管浸润、淋巴结转移、远处转移、HME蛋白及HME mRNA表达均为胃癌预后的独立影响因素(P<0.05). 其中, 从回归系数(B值)可以看出, HME表达为保护因素, 其余均为危险因素. 用比值比(OR值)进行比较, 危险因素中, 以淋巴浸润对预后影响较大(表3). 在逐步COX回归风险模型中可以看出, 淋巴浸润仍然具有统计学意义(P<0.05), 表明此因素可作为胃癌预后的预测指标. 由于相互关联的因素可能因为具有线性关系或存在信息重叠的影响, 其他多项独立影响因素未能具有显著性意义(表4).
| 预后因素 | SE | OR | B1 | 95% CI |
| 性别(M/F) | 1.054 | 1.023 | 2.869 | 0.387-21.297 |
| 年龄(<60/≥60岁) | 0.021 | 0.421 | 1.021 | 0.448-2.331 |
| 肿瘤大小(<50/≥50) mm | 0.544 | 0.438 | 1.723 | 0.730-4.066 |
| 肿瘤部位(贲门/远端) | 0.05 | 0.164 | 1.052 | 0.762-1.450 |
| 组织学分化类型(高中/差分化) | 0.455 | 0.429 | 1.576 | 0.680-3.652 |
| 组织浸润深度(T1-T2/T3-T4) | 1.319 | 0.476b | 3.739 | 1.471-9.503 |
| 淋巴浸润(有/无) | 1.848 | 0.621b | 6.347 | 1.878-21.458 |
| 血管浸润(有/无) | 0.986 | 0.456a | 2.68 | 1.097-6.546 |
| 淋巴结转移(有/无) | 1.098 | 0.424b | 2.997 | 1.305-6.885 |
| 远处转移(有/无) | 1.176 | 0.428b | 3.242 | 1.402-7.494 |
| HME蛋白表达(高/无或低表达) | -1.129 | 0.440b | 0.323 | 0.136-0.766 |
| HMEmRNA表达(高/无或低表达) | -0.976 | 0.420a | 0.377 | 0.165-0.859 |
以往研究认为, MMPs因为具有降解细胞外基质的作用可加速肿瘤的发展. 近年来发现, 部分MMP在某些肿瘤中是积极的预后因素, 可阻碍肿瘤的发展. 其中, HME被认为是一种抗血管生成的因子从而抑制肿瘤生长, 并可能降低转移机率[1]. 我们发现, HME蛋白和HME mRNA表达与胃癌组织分化类型、血管浸润及术后复发均密切相关, 二者在分化类型较高, 无血管浸润及无术后复发的胃癌组织中均明显增高. 但HME mRNA高表达率在无淋巴浸润, 无淋巴结转移的胃癌组织中也有显著增高, 与HME蛋白表达结果不一致, 提示HME表达在mRNA和蛋白水平之间可能存在差异. 根据两种水平检测一致性的资料分析, 我们至少可以认为, HME表达与胃癌组织分化类型、血管浸润及术后复发具有显著的相关关系, 而与胃癌组织淋巴浸润、淋巴结转移可能具有相关趋势. HME在高中分化型胃癌中的表达明显高于低分化型胃癌, 这一结论与Salmela et al[4]研究Barrett's食管发生癌变的结果一致, 他们同样发现分化较好的腺癌组织中HME表达显著增高, 提示HME可能主要参与了分化较好的胃癌的发展过程. 术后5年生存率及生存期统计学差异分析显示, HME高表达与胃癌患者较高生存率及较长生存期显著相关. 多因素分析结果: 组织浸润深度、淋巴浸润、血管浸润、淋巴结转移、远处转移和HME表达均为胃癌患者预后的独立影响因素. 其中, HME高表达预后生存情况较好, 而淋巴浸润对胃癌患者不良预后影响较大, 并可作为胃癌预后的预测指标. 根据以上的分析结果可以看出, HME在胃癌组织中与较好的预后密切相关, 可抑制胃癌的发展和术后复发.
肝细胞癌患者中, HME高表达者预后较好[3]与我们的研究结果类似. 肝癌组织高表达HME mRNA较不表达者门静脉浸润率及肝内转移率低. Gorrin-Rivas et al[3]认为, 肝癌组织内, 在纤溶酶原产生血管稳定因子的过程中, HME可能直接作为关键分子发生作用. 相反, Shapiro et al[9]认为: MME对肿瘤转移的抑制作用与血管稳定因子的产生无关, 可能是MMP-12干扰了MMP-2介导的肿瘤生长. 此外, 大肠癌细胞MME转染体在体外无血清的介质中显示了浸润活性的降低, 这些抑制结果的出现同样认为与血管稳定因子的产生无关[1]. 我们未检测到HME与血管稳定因子产生的直接关系. 我们发现, HME表达与胃癌组织有无血管浸润具有显著相关关系, 同时, 高表达HME mRNA的胃癌组织, 其组织分化程度较高, 术后复发的机率明显降低, 后者似乎也与血管形成无关. 因而, 我们推测, HME可能与血管稳定因子的生成有关, 而这对抑制肿瘤的生长或许产生了间接的影响. 重要的是, HME可能同时拥有不同于蛋白质分解和抗血管形成的另外的功能, 这些未知的机制仍需要我们进一步研究来确定.
总之, 本研究证明, HME高表达与抑制胃癌的血管浸润及术后复发显著相关, 并可能减少淋巴管浸润和淋巴结转移, 提高患者术后生存率、延长生存期. HME高表达与较好的预后密切相关, 对抑制胃癌的发展及术后复发起着至关重要的作用, 是胃癌患者预后的独立影响因素, 可能成为反映胃癌生物学行为及判断预后的有效指标.
人类巨噬细胞金属弹力酶(HME)是一种依赖Zn2+的中性肽链内切酶, 为基质金属蛋白酶(MMPs)家族中的一员, 命名为MMP-12. HME由活化的巨噬细胞分泌, 是巨噬细胞穿透基底膜和浸润组织必不可少的一种活性成分.
王晓艳, 副教授, 湖南长沙中南大学湘雅三医院消化内科; 郑鹏远, 教授, 郑州大学第二附属医院消化科
不同部位肿瘤组织表达HME与其恶性生物学行为及其预后研究结果不一致. 因而亟需广泛深入的研究HME与肿瘤的关系, 阐明HME在肿瘤发展机制中的确切作用及其价值.
在肿瘤发展机制中, 以往研究认为MMPs可能通过细胞外基质的降解促进肿瘤的浸润和转移, 加速肿瘤的发展. 近年来发现一些MMPs具有抗肿瘤活性.
HME高表达与预后较好的密切相关, 可能成为反映胃癌生物学行为及预测预后的有效指标.
本研究选题新颖, 方法可靠, 设计合理, 结论明确, 具有一定的临床意义和实用价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Yang W, Arii S, Gorrin-Rivas MJ, Mori A, Onodera H, Imamura M. Human macrophage metalloelastase gene expression in colorectal carcinoma and its clinicopathologic significance. Cancer. 2001;91:1277-1283. [PubMed] [DOI] |
| 2. | Houghton AM, Grisolano JL, Baumann ML, Kobayashi DK, Hautamaki RD, Nehring LC, Cornelius LA, Shapiro SD. Macrophage elastase (matrix metalloproteinase-12) suppresses growth of lung metastases. Cancer Res. 2006;66:6149-6155. [PubMed] [DOI] |
| 3. | Gorrin-Rivas MJ, Arii S, Mori A, Takeda Y, Mizumoto M, Furutani M, Imamura M. Implications of human macrophage metalloelastase and vascular endothelial growth factor gene expression in angiogenesis of hepatocellular carcinoma. Ann Surg. 2000;231:67-73. [PubMed] [DOI] |
| 4. | Salmela MT, Karjalainen-Lindsberg ML, Puolakkainen P, Saarialho-Kere U. Upregulation and differential expression of matrilysin (MMP-7) and metalloelastase (MMP-12) and their inhibitors TIMP-1 and TIMP-3 in Barrett's oesophageal adenocarcinoma. Br J Cancer. 2001;85:383-392. [PubMed] [DOI] |
| 5. | Zucker S, Vacirca J. Role of matrix metallopro-teinases (MMPs) in colorectal cancer. Cancer Metastasis Rev. 2004;23:101-117. [PubMed] [DOI] |
| 6. | Balaz P, Friess H, Kondo Y, Zhu Z, Zimmermann A, Buchler MW. Human macrophage metalloelastase worsens the prognosis of pancreatic cancer. Ann Surg. 2002;235:519-527. [PubMed] [DOI] |
| 7. | Kerkela E, Ala-Aho R, Jeskanen L, Rechardt O, Grenman R, Shapiro SD, Kahari VM, Saarialho-Kere U. Expression of human macrophage metalloelastase (MMP-12) by tumor cells in skin cancer. J Invest Dermatol. 2000;114:1113-1119. [PubMed] [DOI] |
| 8. | Liu W, Xiang C, Jia S. Study on the expression of matrix metalloproteinase-12 and NM_002426 in squamous laryngeal carcinoma. Linchuang Erbiyanhouke Zazhi. 2006;20:1120-1123. [PubMed] |
| 9. | Shapiro SD. Diverse roles of macrophage matrix metalloproteinases in tissue destruction and tumor growth. Thromb Haemost. 1999;82:846-849. [PubMed] |