修回日期: 2008-03-10
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 研究MMP抑制剂二氮杂菲防治三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)肠炎的作用.
方法: TNBS建立慢性结肠炎大鼠模型, 并将其分为3组: 治疗组给药1, 10-二氮杂菲; 对照组给SASP; 空白对照组给予双蒸水1 mL. 7 d后, 处死大鼠, 测定中性粒细胞髓过氧化物酶(myeloperoxidase, MPO)活性; RT-PCR检测肠道组织MMP-1, MMP-2, MMP-3和TIMP-1 mRNA的表达; 免疫组织化学方法检测MMP-3和TIMP-1蛋白质的表达.
结果: SASP组和二氮杂菲组MPO的A值明显低于对照组(0.25±0.15, 0.16±0.09 vs 0.48 ±0.34, P = 0.025, 0.004), MMP-1, MMP-2及MMP-3表达在SASP组(0.19±0.11, 0.35±0.21, 0.25±0.16)和二氮杂菲组(0.33±0.19, 0.29±0.16, 0.22±0.17)无明显差异, 与对照组(0.45±0.23, 0.53±0.17, 0.62±0.15)相比明显偏低(P = 0.002, 0.020, 0.000). 3组之间TIMP-1 mRAN及蛋白表达均无差异. MMP-3在SASP组和二氮杂菲组的蛋白表达量均较对照组低(2971.3±1036.5, 2507.7±1101.0 vs 7812.8±4761.6, P = 0.000).
结论: 二氮杂菲治疗大鼠TNBS肠炎后, 肠道损伤积分、MPO以及MMP-1, MMP-2和MMP-3的mRNA的表达均明显下降, 但不影响TIMP-1的表达.
引文著录: 缪应雷, 段丽平, 黄华丽. 二氮杂菲对三硝基苯磺酸所致大鼠结肠炎的治疗作用. 世界华人消化杂志 2008; 16(14): 1499-1506
Revised: March 10, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To evaluate the effect of a matrix metalloproteinase (MMP) inhibitor, phenan-throline, on colonic inflammation in experi-mental colitis induced by trinitrobenzene sulfonic acid (TNBS) in rats.
METHODS: A rat model of experimental colitis was induced by administration of TNBS. Animals were divided into 3 groups, treated with 1, 10-phenanthroline (20 mg/kg per day), sulphasalazine, and double distilled water (1 mL, control group), respectively. All the animals were killed after 7 days. Myeloperoxidase (MPO) activity was assessed; the mRNA expression of MMP-1, MMP-2, MMP-3 and tissue inhibitor of matrix metalloproteinase-1 (TIMP-1) in colon tissues were detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR). Meanwhile, MMP-3 and TIMP-1 proteins expression were analyzed by immunohistochemistry.
RESULTS: The absorbency value of MPO in the SASP group or phenanthroline group was significantly lower than that in the control group (0.25 ± 0.15, 0.16 ± 0.09 vs 0.48 ± 0.34, P = 0.025, 0.004). The expression levels of MMP-1, MMP-2 and MMP-3 mRNA had no markedly difference between the SASP group (0.19 ± 0.11, 0.35 ± 0.21, 0.25 ± 0.16) and phenanthroline group (0.33 ± 0.19, 0.29 ± 0.16, 0.22 ± 0.17); however, they were lower than those in the control group (0.45 ± 0.23, 0.53 ± 0.17, 0.62 ± 0.15; P = 0.002, 0.020, 0.000). There was no significant difference in TIMP-1 mRNA and protein among the three groups. However, the expression of MMP-3 protein in the SASP group or phenanthroline group was lower than that in the control group (2971.3 ± 1036.5, 2507.7 ± 1101.0 vs 7812.8 ± 4761.6, P = 0.000).
CONCLUSION: Phenanthroline may treat TNBS-induced colitis in rats by down-regulating MPO activity and MMP-1, MMP-2 and MMP-3 expression, but it has no effect on TIMP-1 expression.
- Citation: Miao YL, Duan LP, Huang HL. Therapeutic effect of phenanthroline on trinitrobenzene sulfonic acid-induced colitis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1499-1506
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1499.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1499
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 为非特异性肠道炎症, 其病程迁延, 治疗困难. 传统内科治疗主要包括柳氮磺胺吡啶(salicylazosulfapyridine, SASP)和糖皮质激素. 前者仅适用轻、中度患者; 后者如全身使用时间过长副作用较大, 而且疗效不足80%. 随着对发病机制的深入研究, 新型生物制剂层出不穷, 包括各种细胞促炎因子的拮抗剂: 抗TNF-α抗体, 抗炎细胞因子拟似剂如重组IL-10, 其他类型的抗炎制剂如抗黏附分子抗体等[1-2]. 但迄今为止除抗TNF-α抗体外, 其他制剂尚未常规用于临床, 而且价格昂贵, 远期疗效及其副作用尚需大宗病例观察研究. 由此很有必要进一步探索更有效、安全、廉价的新型制剂.
二氮杂菲(1, 10-Phenanthroline, C12H8N2•H2O)是一个锌离子螯合剂, 可抑制基质金属蛋白酶(matrix metalloproteinase, MMP)的DNA合成[3]及其活性[4], 该药以前主要用来抗肿瘤[5], 现体外用作MMP的抑制剂[6]. MMP能降解细胞外基质, 细胞因子可刺激基质中免疫细胞分泌和激活MMP[7-11], MMP的过度分泌及活性增加将导致基质降解和组织破坏; 而组织金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases, TIMPs)则是MMP的天然抑制剂[12]. 所以在一些炎症性疾病中, 基质金属蛋白酶抑制剂(matrix metalloproteinase inhibitor, MMPI)已经能有效防止组织破坏, 最近研究提示, IBD炎症组织中MMP的表达水平增加[13-15], 而且MMPI治疗一些胃肠道疾病有一定疗效[16]; Lefort et al[17]采用二氮杂菲治疗三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)和右旋葡聚糖磷酸钠(dextran sulphate sodium, DSS)的急性结肠炎动物模型也取得良效, 只是对肠道慢性炎症的治疗尚无报道. 我们采用TNBS二次致炎法, 建立急、慢性结肠炎共存的动物模型后, 再检测MMP抑制剂二氮杂菲防治TNBS肠炎的作用, 并与经典抗炎药物SASP相比较, 希望能为IBD的治疗提供新的思路和途径.
TNBS为Sigma公司产品; SASP为上海三维制药有限公司生产; TRIzol试剂, 上海华舜生物工程有限公司; 二氮杂菲, Sigma, USA; MMP-3小鼠抗大鼠mAb, Neomarker USA; TIMP-1小鼠抗大鼠mAb, Neomarker USA; 十六烷基三甲基溴化铵(hexadecyltrimethyl ammonium bromide, HTAB), 山东济宁市化工研究所; 邻联二茴香胺(O-dianisidine dihydrochloride), Merck, USA; 大鼠MMP和TIMP-1的引物, 上海基康公司合成; 紫外分光光度计Lambda Bio 40, PerkinElmer, USA. ♀、未育、健康的Wistar大鼠, 体质量200 g左右, 购自本校实验动物中心. 在诱发结肠炎前24 h大鼠一般情况及进食、活动、大便质地如常. 饲料为消毒的标准颗粒, 饮水为过滤自来水.
按Medina et al[18]和Gordon et al[19]的细胞免疫方法进行, 以乙醇为肠黏膜屏障破坏物, TNBS为半抗原. 乙醚麻醉后, TNBS 30 mg溶于500 mL/L的乙醇中(共0.85 mL), 用硅胶管(d = 2 mm)插入8 cm灌肠, 复制大鼠结肠炎的动物模型. 3 wk后再次从肠道注入TNBS 10 mg+生理盐水0.25 mL后, 将动物分3组: 治疗组(n = 12): 二氮杂菲溶于双蒸水, 浓度为3 g/L; 再ig 20 mg/kg[17], 共7 d; 对照组(n = 12), 将SASP以50 mg/kg[20]溶于双蒸水1 mL中ig, 1次/d, 共7 d; 空白对照组(n = 12), 双蒸水1 mL ig 1次/d, 共7 d. 观察大鼠体质量及大便质地. 治疗7 d后断颈处死大鼠, 取下结肠, 沿系膜对侧纵行剖开仔细观察肠道病变; 再将病变明显处甲醛固定, 石蜡包埋, HE染色, 光镜下观察. 行评分(表1-2)[17].
| 观察指标 | 积分 | |
| 粘连 | 无 | 0 |
| 轻度 | 1 | |
| 涉及数个肠攀 | 2 | |
| 狭窄 | 无 | 0 |
| 轻 | 2 | |
| 重, 近端肠管扩张 | 3 | |
| 溃疡 | 无 | 0 |
| 线性, <1 cm | 1 | |
| 2个线性, <1 cm | 2 | |
| 多发, 或有1个>1 cm | 3 | |
| 肠壁厚度 | <1 mm | 0 |
| 1-3 mm | 1 | |
| >3 mm | 2 | |
| 总分 | 10 |
| 观察指标 | 积分 | |
| 溃疡 | 无 | 0 |
| 小<3 mm | 1 | |
| 大>3 mm | 2 | |
| 炎症 | 无 | 0 |
| 轻 | 1 | |
| 中 | 2 | |
| 重 | 3 | |
| 累及肠壁的范围 | 未累及 | 0 |
| 黏膜下 | 1 | |
| 肌层 | 2 | |
| 浆膜 | 3 | |
| 纤维化 | 无 | 0 |
| 轻 | 1 | |
| 重 | 2 | |
| 总分 | 10 |
1.2.1 中性粒细胞髓过氧化物酶(myeloperoxi-dase, MPO)活性测定: PBS冲洗组织后, 取100 mg+PBS 1 mL, 4℃电动匀浆30 s. 4℃, 10 500 g离心10 min, 弃上层油脂及血红蛋白层. 沉淀加入1 mL 5 g/L HTAB-EDTA-PBS(5 mmol/L)混匀, 吹打呈胶状. 4℃, 10 500 g离心10 min. 上清液100 μL+ 200 μL HTAB-EDTA-PBS+1.25 g/L o'-dianisidine dihydrochloride 100 μL+0.5 mL/L H2O2 100 μL(4 mmol/L)混匀, 37℃振荡培养15 min. 10 g/L叠氮钠(NaN3)100 μL终止反应. 460 nm比色测吸光度值(A).
1.2.2 免疫组织化学检测MMP-3和TIMP-1的表达: 采用标准链亲和素-生物素-过氧化物酶(streptavidin-biotin immunoperoxidase, SP)法, 大鼠的石腊包埋组织切片→二甲苯、梯度酒精处理→30 mL/L H2O2室温处理20 min→高压锅修复→50 mL/L正常血清处理(37℃, 20 min)→加抗MMP-3(1:100)和抗TIMP-1(1:100)一抗, 37℃ 60 min, 4℃过夜→PBS洗5 min, 2次→加Biotin-二抗37℃, 40 min→PBS洗5 min, 2次→加SP(1:200)37℃ 30 min→PBS洗5 min, 3次→DAB显色, 显微镜下观察适时终止→苏木素复染→盐酸酒精30 s→氨水中30 s→梯度酒精脱水→二甲苯透明, 加拿大胶封片→阳性信号评价: MMP-3和TIMP-1的阳性均为细胞质中棕黄色着色, 以炎性细胞的胞质表达为主. PBS代替一抗作为空白对照, 对照未见着色, 胎盘为阳性对照. 阳性细胞评价, 利用计算机软件Image-ProPlus检测其积分吸A, 对其显色强度和面积进行综合评估.
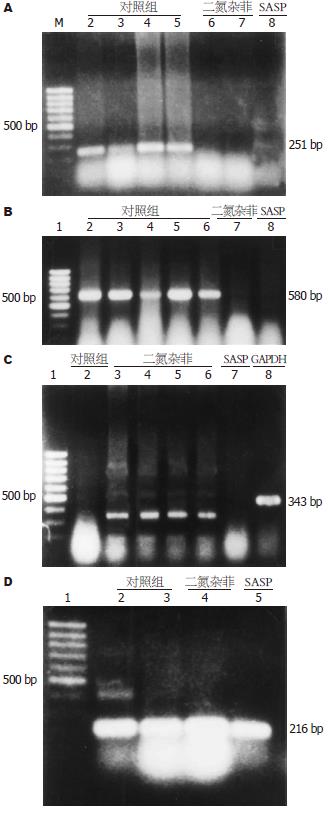
1.2.3 肠组织MMP和TIMP的检测: -70℃取出标本, 每份加入TRIzol 0.2 mL, 剪碎组织, 移液器抽打5次, 空针抽打5-20次, 再加入TRIzol 0.8 mL, 室温静置10 min→加氯仿200 μL, 颠倒混匀, 静置10 min, 4℃ 12 000 g, 离心10 min; 水相移入1.5 mL离心管→加异丙醇500 μL, 振荡混匀, 室温静置10 min→4℃离心12 000 g, 5 min, 弃上清→加750 mL/L乙醇1 mL, 振荡混匀, 4℃ 9800 g, 离心5 min弃上清; 通风厨中静置15 min, 使RNA干燥, 加DEPC处理水50 μL, 56℃水浴10 min使RNA溶解, 全速短暂离心, 得RNA. RNA的质量鉴定和电泳同第一部分. RT-PCR(一步法):引物序列如表3所示. 引物设计、合成及扩增条件分别参照文献: MMP-1参考文献[21]; MMP-2、TIMP-1和GAPDH参照文献[22]; MMP-3参照文献[16]进行. RT-PCR检测肠道组织MMP-1, MMP-2, MMP-3和TIMP-1的方法和条件同第一部分.
| 名称 | 引物序列 | bp |
| MMP-1 | 5'-GGTGGCCAGAATAGCTGAATG-3'(sense) | 251 |
| 5'-GCGTTTTGATATGCCC-3'(antisense) | ||
| MMP-2 | 5'-GTGCTGAAGGACACACTAAAGAAGA-3'(sense) | 580 |
| 5'-TTGCCATCCTTCTCAAAGTTGTAGG-3'(antisense) | ||
| MMP-3 | 5'-AGGAAATCAATTCTGGGC-3'(sense) | 343 |
| 5'-CTTCAAAGTGTGTGTCACTTTC-3'(antisense) | ||
| TIMP-1 | 5'-GACCTGGTCATAAGGGCTAAA-3'(sense) | 216 |
| 5'-GCCCGTGATGAGAAACTCTTCACT-3'(antisense) | ||
| GAPDH | 5'-ACCACAGTCCATGCCATCAC-3'(sense) | 456 |
| 5'-TCCACCACCCTGTTGCTGTA-3'(antisense) |
统计学处理 采用GLM(Generalized linear model)模块进行随机分组设计方差分析, 3组两两比较采用最小显著差(LSD)法. 两组比较采用成组t检验. 所有统计分析均在SPSS11.0中实现. 检验水准定为0.05.
在未给予治疗的3 wk内, 大鼠主要在第1周内出现腹泻, 大便为黄色稀便, 或肛周体毛被稀便沾染. 给药后第1周体质量明显降低(3组P = 0.001, 0.001, 0.000). 第2周体质量开始增加, 腹泻症状开始好转. 第3周后, 大便正常, 体质量逐渐恢复正常. 第4周再次给予TNBS灌肠后, 对照组直到处死前, 仍有腹泻; 而二氮杂菲组和SASP组出现腹泻, 持续3 d, 以后逐渐恢复正常. 第4周结束时, SASP组和二氮杂菲组体质量均较对照组高(P = 0.008, 0.039, 表4).
| 时间 | SASP组 | 二氮杂菲组 | 对照组 |
| 第1天 | 212.1±8.2 | 213.8±6.9 | 210.6±7.0 |
| 第1周 | 186.7±18.6 | 185.6±19.6 | 187.2±8.7 |
| 第2周 | 198.1±10.3 | 201.0±13.9 | 192.2±14.7 |
| 第3周 | 206.3±13.9 | 209.4±18.7 | 207.2±15.4 |
| 第4周 | 219.4±29.8 | 215.6±20.5 | 203.1±9.2 |
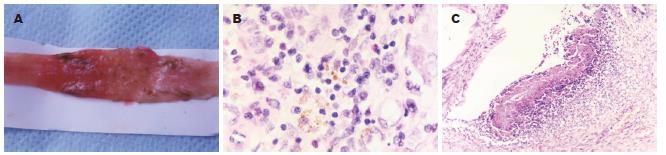
对照组肠道可见肠壁充血、水肿明显. 对系膜缘剖开后见黏膜充血、水肿、糜烂及溃疡(图1A)形成, 几乎所有大鼠均有肠壁增厚. 少数腹腔粘连, 肠道近端扩张. 光镜下病变主要位于黏膜和黏膜下层, 少数出现在肌层、甚至是全层炎症, 以中性粒细胞、浆细胞、淋巴细胞浸润为主黏膜和黏膜下层有单核细胞和巨噬细胞的浸润, 甚至溃疡形成(图1B-C).
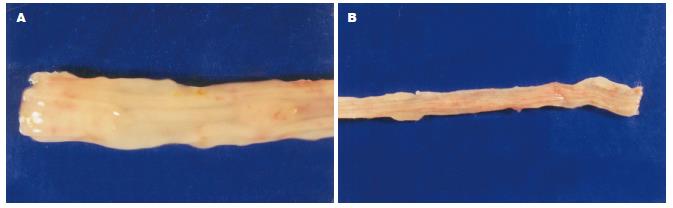
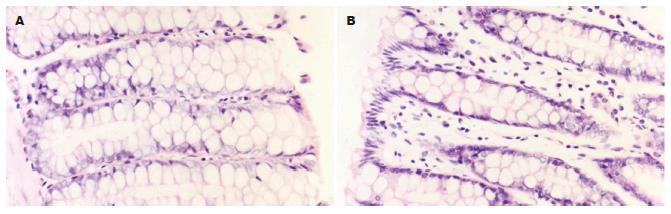
对照组肠道损伤积分包括大体积分和组织学积分6.83±1.53; 460 nm比色测得的MPO的A值为0.48±0.34. 而SASP组和二氮杂菲组肉眼观察仍隐约可见红斑, 肠道无明显充血、水肿、糜烂和溃疡(图2A-B). 显微镜下可见黏膜及黏膜下层的炎症明显减轻(图3A-B)肠道损伤积分分别为3.58±2.61和3.92±2.31, 均低于对照组(6.83±1.53, P = 0.002, 0.004); MPO的A值分别为0.25±0.15和0.16±0.09, 均明显低于对照组(0.48 ±0.34, P = 0.025, 0.004).
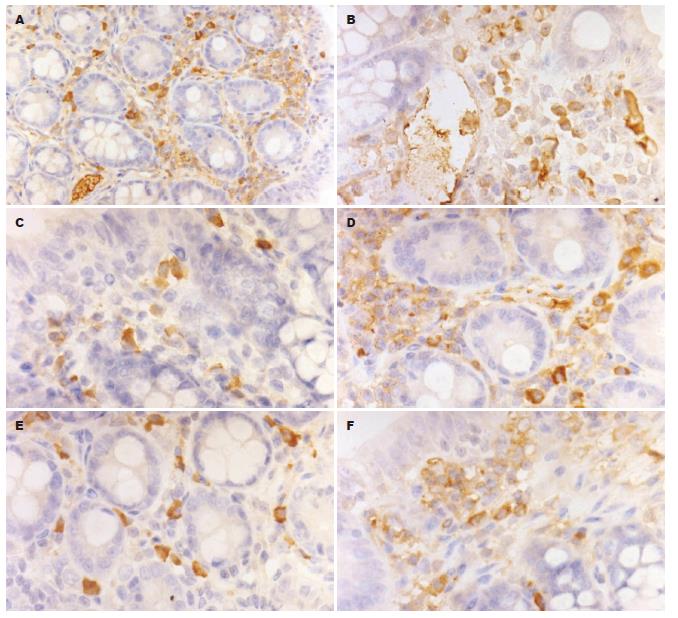
MMP-3和TIMP-1的阳性均为棕黄色, 定位于细胞质, 主要在肠黏膜固有层及黏膜下层的浆细胞、中性粒细胞、单核细胞及巨噬细胞表达(图4A-F). MMP-3在SASP组和二氮杂菲组的表达量均较对照组低(P = 0.000); 3组之间TIMP-1的A值无明显差异(P = 0.871, 表5).
| 指标IA | SASP | 二氮杂菲 | 对照组 |
| TIMP-1 | 2812.2±1160.4 | 3057.3±1171.7 | 2978.4±1342.2 |
| MMP-3 | 2971.3±1036.5 | 2507.7±1101.0 | 7812.8±4761.6 |
SASP组和二氮杂菲组的MMP-1, MMP-2及MMP-3表达并无明显差异(P = 0.078, 0.381, 0.653); 与对照组相比明显偏低(SASP组 vs 对照组P = 0.002, 0.020, 0.000; 二氮杂菲组 vs 对照组P = 0.030, 0.003, 0.000). 3组的TIMP-1表达无差异(P = 0.471, 图5A-D, 表6).
| 指 标 | SASP组 | 二氮杂菲组 | 对照组 |
| MMP-1 | 0.19±0.11 | 0.33±0.19 | 0.45±0.23 |
| MMP-2 | 0.35±0.21 | 0.29±0.16 | 0.53±0.17 |
| MMP-3 | 0.25±0.16 | 0.22±0.17 | 0.62±0.15 |
| TIMP-1 | 0.61±0.18 | 0.52±0.20 | 0.53±0.21 |
既往的TNBS动物模型常常采用一次性刺激, 第1周为急性炎症, 给药后1-3 wk内有慢性炎症[23-24], 没有缓解后复发这一临床表现. 我们采用TNBS/乙醇(30 mg/0.25 mL)建立TNBS结肠炎动物模型, 3 wk后再以不加黏膜屏障破坏物(乙醇)的小剂量TNBS(10 mg)二次刺激. 结果动物出现腹泻、血便、体质量减轻等症状; 病理改变有肠壁充血、水肿, 糜烂及溃疡, 甚至伴有肠壁的增厚和狭窄, 糜烂、溃疡、纤维结缔组织增生和血管增生等, 肠壁炎症以中性粒细胞、浆细胞、淋巴细胞浸润为主, 其中黏膜及黏膜下层有单核细胞和巨噬细胞的浸润, 炎症损伤积分明显增高; 炎症标志物MPO(MPO是评价炎症程度的指标, 其活性反应了中性粒细胞的浸润数目和活性)也明显增高. 以上结果表明, (1)采用二次刺激法, 使大鼠在慢性结肠炎的基础上再次出现急性结肠炎的表现, 具有急、慢性结肠炎共存的特点; (2)炎症慢性化后, 再次接触相同抗原, 仍可使病情复发; (3)复发时的抗原剂量小于首次抗原量; (4)肠黏膜屏障被乙醇首次破坏后无法恢复完整, 已处于允许抗原进入的通透状态, 所以二次刺激不需要乙醇. 大鼠急、慢性结肠炎共存的动物模型, 类似慢性复发性炎症, 更接近人类IBD的临床表现, 即发作-缓解-复发的模式. 故该模型在组织病理学方面与人类IBD亦有相似之处, 可作为进一步研究IBD的手段.
最近有研究显示, MMP参与了肠道的损伤和重建, 直接证据是在人的胎肠培养模型中, 商陆有丝分裂原(pokeweed mitogen, PWM)刺激胎肠的T淋巴细胞产生MMP, 损伤和破坏肠道黏膜组织, 表现为上皮脱落及绒毛消失; 利用人工合成的MMPI CT1399可有效防治PWM所致的肠黏膜损伤及炎症[25]. 随后几个研究组分别利用RT-PCR, Western杂交和原位杂交都证实IBD炎症组织中有MMP的高表达[13-15], 与本研究中第1部分的结果相似. 位于成纤维细胞和巨噬细胞的MMP-1和MMP-3, 其作用尤为突出, 他们被促炎症细胞因子, 如TNF-α, NF-κB, 促炎症的白介素等激活后损伤与破坏肠道黏膜组织. Chang et al[26]的免疫组化证实, MMP的表达在黏膜损伤的区域明显高于正常黏膜区; 最近的酶谱法也显示活动性炎症组织有丰富的MMP表达[15]; IBD炎症肠黏膜中, MMP-1和MMP-3 mRNA的高表达已是公认的事实[14]. 所有这些提示炎症肠黏膜MMP的表达及其酶活性均明显增高, 由此推测利用MMPI治疗IBD可能有效.
二氮杂菲是一种Zn离子螯合剂, 其主要作用为与MMP的催化结构域结合而抑制MMP的活性. 有研究显示, 如果二氮杂菲的剂量超过20 mg/kg, 重复给药, 将会出现对小鼠的神经毒性[27]. 所以我们采用单剂量20 mg/kg, 防止不良反应; 同时利用二氮杂菲治疗大鼠肠炎模型后, 利用RT-PCR的方法证实他能明显地降低MMP-1, MMP-2和MMP-3的mRNA的表达, 而不影响TIMP-1的表达; 免疫组化证实, 这些MMP的表达主要位于黏膜及黏膜下层的炎性细胞胞质内, 如单核细胞、巨噬细胞和浆细胞等. 二氮杂菲治疗后MMP表达明显低于对照组, 而TIMP-1的表达在3组之间并无明显差异(P>0.05). 结果提示, 二氮杂菲能够有效地抑制MMP的表达及其酶活性, 以上与Chen et al[28]一致. 二氮杂菲治疗TNBS的肠炎模型后, 肠道损伤的面积和炎症程度, 均明显低于对照组(P<0.05), 疗效与SASP相近. 但二氮杂菲治疗后, 其MPO值与SASP组比较无差异, 与对照组有显著性差异(P<0.05). 而此前Lefort et al[17]的结论是, 二氮杂菲治疗TNBS实验性结肠炎模型后, 并不影响MPO的活性, 与我们的结果不符. 推测其原因可能有: (1)尽管二氮杂菲疗效的发挥可能并非直接抑制炎症介质的释放和炎性细胞的浸润, 而是抑制了炎症的病变组织重构而起作用[7-10], 但是其有助于黏膜屏障的修复, 防止黏膜的继发性损伤和感染, 有利于肠道炎症的消退; (2)我们采用TNBS二次致炎法建立的动物模型为慢性炎症基础上的急性炎症, 具有急、慢性炎症共存的特点, 符合人类IBD的发病特点; 而Medina et al的TNBS模型是7 d内的急性炎症模型, 所以标本的来源有别.
如前所述, 二氮杂菲是一种抑制MMP活性的锌离子螯合剂, 所以有防止肠道黏膜损伤的作用, 但最近Sykes et al[29]用硫酸锌溶液灌肠治疗大鼠的实验性肠炎, 发现其有明显的抗炎作用. 这可能是因为二氮杂菲是锌离子螯合剂, 其治疗肠道炎症的机制是抑制了MMP的活性而起作用; 而锌离子之所以能够治疗实验性肠炎是因为他具有抑制细菌, 维持上皮组织的正常修复及胶原合成等作用, 二者的作用机制不同. 另外TNF-α阻止剂、糖皮质激素和转化生长因子(TGF-β)对炎症性肠病的治疗有效, 很大程度上也是因为他们能在基因水平抑制MMP表达, 阻断了MMP激活的信号传导通路. 已明确糖皮质激素能通过与AP-1位点结合抑制胶原酶基因的表达; 而TGF-β可作用于鼠基质溶素transin启动子的上游序列而发挥抑制作用.
迄今已有几个研究组开始利用MMPI治疗IBD的实验研究. 最早是Di Sebastiano et al[20]用marimastat和SASP治疗TNBS诱导的IBD动物. 结果显示, marimastat和SASP都能有效地防止肠道的损伤及炎症, 并降低肠道炎症的积分, 他们的疗效并无差异. 只是在降低MPO活性及TNF-α方面, SASP更为有效; 此后朱峰 et al[30]用BB-94治疗TNBS致大鼠的结肠炎模型. 结果显示, BB-94能明显降低结肠炎的炎症积分, 同时MPO也明显低于对照组, 其疗效与剂量呈正相关; 同年Lefort et al[17]用二氮杂菲治疗TNBS和DSS诱导的结肠炎, 疗效显著, 但对MPO和花生四烯酸的释放无影响. 目前MMPI已经用于治疗肿瘤患者, 部分药品进入Ⅲ期临床试验阶段; 而对IBD的治疗仍处于体外试验及动物试验阶段.
总之, 二氮杂菲治疗大鼠TNBS肠炎使肠道损伤积分、MPO以及 MMP-1, MMP-2和MMP-3的 mRNA的表达均明显下降, 但不影响TIMP-1的表达, 以上提示二氮杂菲能够有效地抑制MMP的表达及其酶活性、治疗大鼠TNBS结肠炎. 相信随着对MMPI研究的不断深入和拓展, 将有可能为IBD的治疗开辟新途径.
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD), 为非特异性肠道炎症, 其病程迁延, 治疗困难. 最近研究提示IBD炎症组织中MMPs的表达水平增加, 而且MMPI治疗一些胃肠道疾病有一定疗效; Medina et al采用二氮杂菲治疗三硝基苯磺酸(TNBS)和右旋葡聚糖磷酸钠(DSS)的急性结肠炎动物模型也取得良效, 只是对肠道慢性黏膜炎症的治疗尚无报道.
房静远, 教授,上海交通大学医学院附属仁济医院消化内科, 上海市消化疾病研究所
炎症性肠病(IBD)的传统内科治疗主要包括SASP、糖皮质激素. 前者仅适用轻、中度患者; 后者如全身使用时间过长副作用较大, 而且疗效不足80%.
Sykes et al用Marimastat和SASP治疗TNBS诱导的IBD动物, 结果显示: Marimastat和SASP都能有效地防止肠道的损伤及炎症, 并降低肠道炎症的积分, 他们的疗效并无差异. 只是在降低MPO活性及TNF-α方面, SASP更为有效.
本研究拟采用TNBS二次致炎法, 建立急、慢性结肠炎共存的动物模型后, 再检测MMPs抑制剂二氮杂菲防治TNBS肠炎的作用, 并与经典抗炎药物SASP相比较, 希望能为IBD的治疗提供新的思路和途径.
二氮杂菲: 是一个锌离子螯合剂, 可抑制基质金属蛋白酶(MMPs)的DNA合成及其活性, 该药以前主要用来抗肿瘤,现体外用作MMPs的抑制剂.
本文立题较明确, 方法实用, 结果较可靠, 是一篇较有意义的论文.
编辑: 师忠芳 电编:郭海丽
| 1. | Marriott JB, Westby M, Cookson S, Guckian M, Goodbourn S, Muller G, Shire MG, Stirling D, Dalgleish AG. CC-3052: a water-soluble analog of thalidomide and potent inhibitor of activation-induced TNF-alpha production. J Immunol. 1998;161:4236-4243. [PubMed] |
| 2. | Hamamoto N, Maemura K, Hirata I, Murano M, Sasaki S, Katsu K. Inhibition of dextran sulphate sodium (DSS)-induced colitis in mice by intracolonically administered antibodies against adhesion molecules (endothelial leucocyte adhesion molecule-1 (ELAM-1) or intercellular adhesion molecule-1 (ICAM-1)). Clin Exp Immunol. 1999;117:462-468. [PubMed] [DOI] |
| 3. | Chang CH, Yarbro JW, Mann DE Jr, Gautieri RF. Effects of 1,10-phenanthroline and a zinc complex of 1,10-phenanthroline on nucleic acid synthesis in mouse liver and spleen. J Pharmacol Exp Ther. 1978;205:27-32. [PubMed] |
| 4. | Day TA, Chen GZ. The metalloprotease inhibitor 1,10-phenanthroline affects Schistosoma mansoni motor activity, egg laying and viability. Parasitology. 1998;116:319-325. [PubMed] [DOI] |
| 5. | Leiter J, Hartwell JL, Kahler JS, Kline I, Shear MJ. Damage induced in sarcoma 37 with chemical agents. VI. Biphenyl, fluorene, phenanthrene, and tropolone derivatives. J Natl Cancer Inst. 1953;14:365-374. [PubMed] |
| 6. | Borkakoti N. Matrix metalloproteases: variations on a theme. Prog Biophys Mol Biol. 1998;70:73-94. [PubMed] [DOI] |
| 7. | Cunnane G, FitzGerald O, Hummel KM, Gay RE, Gay S, Bresnihan B. Collagenase, cathepsin B and cathepsin L gene expression in the synovial membrane of patients with early inflammatory arthritis. Rheumatology (Oxford). 1999;38:34-42. [PubMed] [DOI] |
| 8. | Meikle MC, Atkinson SJ, Ward RV, Murphy G, Reynolds JJ. Gingival fibroblasts degrade type I collagen films when stimulated with tumor necrosis factor and interleukin 1: evidence that breakdown is mediated by metalloproteinases. J Periodontal Res. 1989;24:207-213. [PubMed] [DOI] |
| 9. | Page RC. The pathobiology of periodontal diseases may affect systemic diseases: inversion of a paradigm. Ann Periodontol. 1998;3:108-120. [PubMed] |
| 10. | Ishiguro N, Ito T, Miyazaki K, Iwata H. Matrix metalloproteinases, tissue inhibitors of metallo-proteinases, and glycosaminoglycans in synovial fluid from patients with rheumatoid arthritis. J Rheumatol. 1999;26:34-40. [PubMed] |
| 11. | Baugh MD, Perry MJ, Hollander AP, Davies DR, Cross SS, Lobo AJ, Taylor CJ, Evans GS. Matrix metalloproteinase levels are elevated in inflammatory bowel disease. Gastroenterology. 1999;117:814-822. [PubMed] [DOI] |
| 12. | Konttinen YT, Ceponis A, Takagi M, Ainola M, Sorsa T, Sutinen M, Salo T, Ma J, Santavirta S, Seiki M. New collagenolytic enzymes/cascade identified at the pannus-hard tissue junction in rheumatoid arthritis: destruction from above. Matrix Biol. 1998;17:585-601. [PubMed] [DOI] |
| 13. | von Lampe B, Barthel B, Coupland SE, Riecken EO, Rosewicz S. Differential expression of matrix metalloproteinases and their tissue inhibitors in colon mucosa of patients with inflammatory bowel disease. Gut. 2000;47:63-73. [PubMed] [DOI] |
| 14. | Heuschkel RB, MacDonald TT, Monteleone G, Bajaj-Elliott M, Smith JA, Pender SL. Imbalance of stromelysin-1 and TIMP-1 in the mucosal lesions of children with inflammatory bowel disease. Gut. 2000;47:57-62. [PubMed] [DOI] |
| 15. | Wojtowicz-Praga SM, Dickson RB, Hawkins MJ. Matrix metalloproteinase inhibitors. Invest New Drugs. 1997;15:61-75. [PubMed] [DOI] |
| 16. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 17. | Lefort J, Singer M, Leduc D, Renesto P, Nahori MA, Huerre M, Creminon C, Chignard M, Vargaftig BB. Systemic administration of endotoxin induces bronchopulmonary hyperreactivity dissociated from TNF-alpha formation and neutrophil sequestration into the murine lungs. J Immunol. 1998;161:474-480. [PubMed] |
| 18. | Medina C, Videla S, Radomski A, Radomski M, Antolin M, Guarner F, Vilaseca J, Salas A, Malagelada JR. Therapeutic effect of phenantroline in two rat models of inflammatory bowel disease. Scand J Gastroenterol. 2001;36:1314-1319. [PubMed] [DOI] |
| 19. | Gordon JL, Drummond AH, Galloway WA. Metalloproteinase inhibitors as therapeutics. Clin Exp Rheumatol. 1993;11 Suppl 8:S91-S94. [PubMed] |
| 20. | Di Sebastiano P, di Mola FF, Artese L, Rossi C, Mascetta G, Pernthaler H, Innocenti P. Beneficial effects of Batimastat (BB-94), a matrix metallo-proteinase inhibitor, in rat experimental colitis. Digestion. 2001;63:234-239. [PubMed] [DOI] |
| 22. | Knittel T, Mehde M, Kobold D, Saile B, Dinter C, Ramadori G. Expression patterns of matrix metallo-proteinases and their inhibitors in parenchymal and non-parenchymal cells of rat liver: regulation by TNF-alpha and TGF-beta1. J Hepatol. 1999;30:48-60. [PubMed] [DOI] |
| 23. | Vilaseca J, Salas A, Guarner F, Rodriguez R, Mala-gelada JR. Participation of thromboxane and other eicosanoid synthesis in the course of experimental inflammatory colitis. Gastroenterology. 1990;98:269-277. [PubMed] |
| 24. | Hoshino H, Goto H, Sugiyama S, Hayakawa T, Ozawa T. Effects of FK506 on an experimental model of colitis in rats. Aliment Pharmacol Ther. 1995;9:301-307. [PubMed] |
| 25. | Bailey CJ, Hembry RM, Alexander A, Irving MH, Grant ME, Shuttleworth CA. Distribution of the matrix metalloproteinases stromelysin, gelatinases A and B, and collagenase in Crohn's disease and normal intestine. J Clin Pathol. 1994;47:113-116. [PubMed] [DOI] |
| 26. | Chang CH, Mann DE Jr, Gautieri RF. Teratogenicity of zinc chloride, 1,10-phenanthroline, and a zinc-1,10-phenanthroline complex in mice. J Pharm Sci. 1977;66:1755-1758. [PubMed] [DOI] |
| 27. | Schuppan D, Hahn EG. MMPs in the gut: inflammation hits the matrix. Gut. 2000;47:12-14. [PubMed] [DOI] |
| 28. | Chen BW, Wang HH, Liu JX, Liu XG. Zinc sulphate solution enema decreases inflammation in experimental colitis in rats. J Gastroenterol Hepatol. 1999;14:1088-1092. [PubMed] [DOI] |
| 29. | Sykes AP, Bhogal R, Brampton C, Chander C, Whelan C, Parsons ME, Bird J. The effect of an inhibitor of matrix metalloproteinases on colonic inflammation in a trinitrobenzenesulphonic acid rat model of inflammatory bowel disease. Aliment Pharmacol Ther. 1999;13:1535-1542. [PubMed] [DOI] |