修回日期: 2008-03-11
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 探讨PI3K/AKT(磷脂酰肌醇-3-激酶/蛋白激酶B)信号转导通路在人肝癌细胞株SMMC-7221生长和黏附中的作用机制.
方法: 应用LY294002作用于SMMC-7221细胞, 并设对照组和实验组(LY294002: 5、10、20、40 μmol/L), MTT法检测LY294002作用24、48、72、96 h后, 对SMMC-7221细胞增殖的影响; 采用肿瘤细胞-基质黏附实验检测对照组和干预组SMMC-7221黏附能力的变化; 流式细胞仪检测肝癌细胞黏附分子CD44s表达情况; 细胞免疫化学S-P法检测SMMC-7221细胞血管内皮生长因子(vascular endothelial growth factor, VEGF)和CD44V6蛋白表达.
结果: LY294002对SMMC-7221细胞的增殖有抑制作用, 呈剂量和时间依赖性; 5、10 mol/L的LY294002作用于肝癌细胞后与对照组相比CD44s, VEGF, CD44V6蛋白表达下降(CD44s: 42.84%±6.35%, 20.21%±4.5% vs 89.23%±3.91%, P<0.01; VEGF: 103.11±18.60, 68.99±15.99 vs 137.84±22.50, P<0.01; CD44V6: 47.33±6.15, 33.09±5.23 vs 61.36±7.39, P<0.01); 5、10 μmol/L的LY294002干预后与对照组相比SMMC-7221黏附能力下降(0.498±0.024, 0.407±0.029 vs 0.616±0.080, P<0.01).
结论: 阻断PI3K/AKT信号传导通路, 肝癌细胞生长受到抑制、黏附能力下降. LY294002抑制肝癌细胞黏附力的作用机制与通过降低CD44V6、CD44s和VEGF水平有关.
引文著录: 富翠芹, 王沁, 尹蓉, 武令启. PI3K/AKT信号转导通路在肝癌细胞生长和黏附中的作用. 世界华人消化杂志 2008; 16(14): 1493-1498
Revised: March 11, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To investigate the role of phosphoinositide 3-kinase (PI3K)-protein kinase B (Akt) pathway in the growth, adherence and invasion of human hepatoma carcinoma cell line SMMC-7221 and its mechanism.
METHODS: MTT reduction assay was used to evaluate the inhibition of SMMC-7221 cells treated with LY294002 (5, 10, 20, 40 μmol/L) for 24, 48, 72, 96 h. The tumor adhesion ability was detected by cell-matrix adhesion experiment. Flow cytometry (FCM) was used to detect CD44s expression. Immunocytochemistry was used to detect the expression of vascular endothelial growth factor (VEGF) and CD44V6 in SMMC-7221 cells.
RESULTS: LY294002 at concentrations of 5, 10, 20 and 40 μmol/L inhibited the proliferation of SMMC-7221 cells in a time- and dose-dependent manner. LY294002 at 5 and 10 μmol/L induced down-regulation of VEGF, CD44V6 and CD44s protein expression as compared with the control group (VEGF: 103.11 ± 18.60, 68.99 ± 15.99 vs 137.84 ± 22.50, P < 0.01; CD44V6: 47.33 ± 6.15, 33.09 ± 5.23 vs 61.36 ± 7.39, P < 0.01; CD44s: 42.84% ± 6.35%, 20.21% ± 4.5% vs 89.23% ± 3.91%, P < 0.01); meanwhile, LY294002 at 5 and 10 μmol/L reduced the adhesion ability of SMMC-7221 cells in comparison with the control group (0.498 ± 0.024, 0.407 ± 0.029 vs 0.616 ± 0.080, P < 0.01).
CONCLUSION: PI3K/AKT pathway plays an important role in the growth, adherence and invasion of SMMC-7221 cells, and its catastaltic may be used in the management of hepatocellular carcinoma.
- Citation: Fu CQ, Wang Q, Yin R, Wu LQ. Role of PI3K/Akt pathway in the growth and adherence of human hepatocelluar carcinoma cells. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1493-1498
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1493.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1493
PI3K/AKT(磷脂酰肌醇-3-激酶/蛋白激酶B)信号转导通路广泛存在于细胞中, 是参与调节细胞生长、增殖、分化的信号传导通路. 近年来研究表明, PI3K/AKT信号转导通路在肿瘤的恶性增殖、血管新生和侵袭转移中起着重要作用[1-2]. LY294002是PI3K的特异性抑制剂, 能完全抑制PI3K的活性. 我们以PI3K/AKT信号转导通路特异性抑制剂LY294002作用于肝癌细胞株SMMC-7221, 观察其对肝癌细胞生长、增殖、黏附能力的影响及对黏附蛋白表达的影响.
人肝癌细胞株SMMC-7221由郑州大学医学院惠赠; LY294002(碧云天生物公司); F12培养基、RPMI 1640培养基(Gibco公司); 新生牛血清(杭州四季青生物公司); CD44s mAb (PharMingen公司); CD44V6 mAb、VEGF mAb、SP-9000免疫组化通用试剂盒(北京中杉金桥生物公司); Matrigel(BD公司); 酶标仪(Wellseav MK2型全自动酶标仪, Labsystem), 流式细胞仪为美国Becton Dickinson公司产品. 人肝癌细胞株SMMC-7221用含100 mL/L小牛血清的RPMI 1640培养基, 置37℃、50 mL/L CO2孵箱中, 细胞换液时间为2-3 d, 传代时间为3-5 d, 传代前用2.5 g/L胰酶消化. 取对数生长期细胞作为实验用细胞.
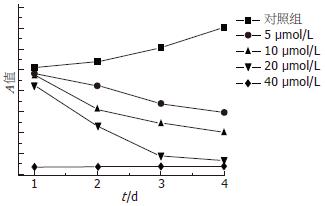
1.2.1 MTT法检测LY294002对SMMC-7221细胞生长的影响: 取对数生长期的细胞以3000个每孔接种于96孔培养板, 每孔200 μL培养体系. LY294002分4个不同浓度组分别为5、10、20、40 μmol/L, 每组5个复孔, 对照组加入等体积培养基, 并设空白对照孔, 分别于加药后1-4 d检测细胞活力. 细胞孵育终止前每孔加入5 g/L的MTT 20 μL, 5 h后吸弃上清, 加入200 μL二甲基亚砜(DMSO)震荡溶解10 min, 使结晶物充分溶解, 使用空白对照孔调零, 酶标仪测490 nm处吸光度(A), 绘制细胞生长曲线. 根据增殖抑制实验结果, 选择5、10 μmol/L作为下述实验中LY294002的浓度.
1.2.2 基质-黏附实验检测黏附能力: 以无血清F12培养液稀释Matrigel至100 μg/L, 按50 μL/孔加入96孔细胞培养板, 置于超净台过夜风干. 临用前按100 μL/孔加入无血清F12培养液, 室温静置90 min后吸取液体以除去未结合的Matrigel. 使用5、10 μmol/L的LY294002作用3 d后的SMMC-7221细胞制备成个3×107个/L的细胞悬液, 按每孔100 μL加入黏附系统, 每组设5个复孔, 对照组加入等量未经处理过的细胞, 37℃, 50 mL/L CO2孵箱培养2 h, PBS洗去未黏附的细胞按100 μL/每孔加入5 g/L结晶紫染色, 染色10 min. 用PBS洗涤, 37℃干燥. 按100 μL/孔加入10 mL/L醋酸乙醇溶液, 混合后静置10 min. 酶标仪570 nm测量吸光度, 表示细胞-基质黏附能力.
1.2.3 流式细胞仪检测CD44s: 取对数生长期细胞, 用胰酶消化后, 吹打为单个细胞悬液加入LY294002使其终浓度为5、10 μmol/L, 对照组加入等量培养基, 培养3 d后收集细胞, 取细胞悬液100 μL, 置于预先已加入CD44s-FITC 10 μL的12 mm×75 mm塑料管中, 并在室温下避光反应30 min, 以流式细胞术检测细胞表面标记, 具体操作按试剂说明书进行. Cell-Quest软件分析, 至少分析10 000个细胞.
1.2.4 免疫细胞化学S-P法检测VEGF和CD44V6: 取对数生长期细胞, 用胰酶-EDTA消化后, 吹打为单个细胞悬液, 以105个每孔接种于加有载玻片的6孔培养板中, 每孔4 mL培养体系. 分为对照组(加等体积培养基做为对照), LY294002组(浓度为5、10 μmol/L), 用含100 mL/L新生牛血清的1640培养基置培养置37℃, 50 mL/L CO2孵箱中培养3 d后将爬片取出. 采用免疫细胞化学S-P法染色, 步骤: 爬片使用丙酮固定后用PBS冲洗, 然后于30 mL/L的双氧水中室温下孵育10 min, 山羊血清工作液封闭, 滴加VEGF(一抗), 或者CD44V6(一抗), 在湿盒中过夜. 滴加生物素标记二抗37℃孵育30 min, 滴加过氧化物酶标记的链霉卵白素工作液室温孵育30 min, DAB显色剂显色, 苏木素复染, 常规脱水, 透明, 封片. 通过对设定阳性色彩的识别, 并自动将之转换为积分吸光度IA值, 客观的反映阳性染色的面节和强度的综合情况. 每张爬片随机选取5个视野(400倍)测量IA, 使用Image-Pro Plus 5.0软件分析.
统计学处理 数据用mean±SD表示, 采用SPSS10.0统计软件处理. 根据资料性质采用单因素方差分析、随机区组设计的双因素方差分析. 以P<0.05为差异有显著性.
5、10、20、40 μmol/L的LY294002(图1)作用于肝癌细胞12 h后均表现出对增殖的抑制作用. 且随着药物浓度的提高, 抑制作用逐渐增强. 5、10、20、40 μmol/L浓度组间比较差异有显著性(P<0.01). 各实验组与对照组比较差异有显著性(P<0.01). 各药物浓度组间细胞增殖抑制率随着时间的延长有增高趋势. 以A值对药物浓度作药物量效的相关回归分析, 可见两者间存在着线性关系.
用5、10 μmol/L的LY294002处理肝癌细胞3 d后测定黏附能力, 平均吸光度A值分别为0.498±0.024和0.407±0.029, 均低于对照组(0.616±0.080), 与对照组相比差异均有显著性(P<0.01), 两处理组之间比较, 差异也有显著性(P<0.01) .
用5、10 μmol/L的LY294002处理肝癌细胞3 d后测定CD44s平均表达率分别为42.84%±6.35%、20.21%±4.5%, 分别与对照组(89.23%±3.91%)比较, 差异均有显著性(P<0.01), 两处理组之间比较差异也有显著性(P<0.01).
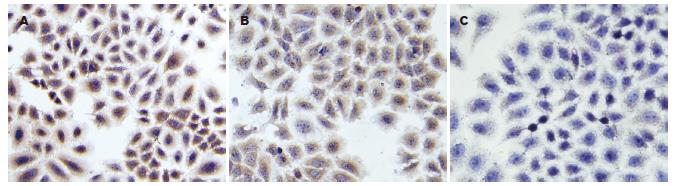
VEGF(图2)分布在胞质内呈棕色, 弥漫性分布. 用5、10 μmol/L的LY294002处理肝癌细胞3 d后染色较对照组变浅, 表达阳性率降低. 测定VEGF平均吸光度值A分别为103.11±18.60和68.99±15.99, 与对照组137.84±22.50比较, 差异均有显著性(P<0.01). 两处理组之间比较差异有显著性(P<0.01).
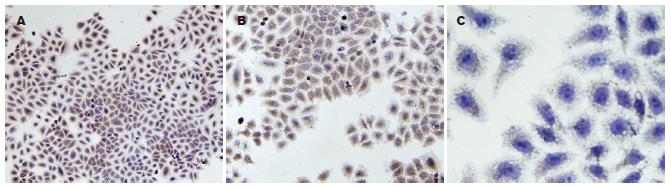
CD44V6(图3)分布在胞膜, SP染色呈棕黄色. 用5、10 μmol/L的LY294002处理肝癌细胞3 d后染色较对照组变浅, 阳性表达率降低. 测定CD44V6平均吸光度值A分别为47.33±6.15、33.09±5.23, 分别与对照组61.36±7.39比较, 差异均有显著性(P<0.01). 两处理组之间比较差异有显著性(P<0.01).
PI3K和AKT共同构成一条重要的信号转导通路, 能够利用PI3K/AKT通路传递信号的分子主要为生长因子如: PDGF, IGF, EGF以及胰岛素等. 近年来, 此信号转导通路在肿瘤细胞的生长、转移中的作用日益成为研究的热点. PI3K/AKT信号转导通路促进恶性肿瘤转移的机制主要为: 增加肿瘤细胞的运动能力、对生长因子受体的调节、降低细胞间的黏附力[2]、对细胞外基质(extracellular matrix, ECM)的影响、增加核转录因子的活性使基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2), 基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)产量增加, 使组织降解, 有利于细胞转移[3-6]. 可见此信号转导通路通过多种途径促进肿瘤的转移, 具有重要的研究价值.
不同浓度的LY294002在体外干预人肝癌细胞SMMC-7221细胞, 发现LY294002可抑制SMMC-7221生长增殖, 40 μmol/L LY294002可直接将肝癌细胞杀死, 以致于其生长曲线为一条平直曲线. 从浓度为0-40 μmo/L随着LY294002浓度的增大、作用时间的延长, 生长抑制率也随之增大. 并与CD44s、CD44V6表达降低成正相关, 二者均为异质性黏附的重要因子, 可能通过影响细胞黏附能力, 继而细胞不能贴壁以至于不能生长而死亡. 另外随着药物浓度增大, VEGF表达降低, VEGF是促进血管生长的必要因素, 但在体外是否能直接影响细胞生长还有待于进一步研究, 其杀死细胞的具体机制还有待于探讨. 可见PI3K/AKT信号传导通路对肝癌的生长、增殖是必要的条件.
肿瘤血管的生成既为肿瘤生长提供了营养, 又为肿瘤转移提供了有利条件. 肿瘤血管生成是包括血管内皮细胞增殖、迁移及细胞外基质降解的多步骤和复杂的过程. 其中VEGF是促进肿瘤血管生成的重要因子, 并通过特异性受体Flk-1, Flt-1和Flt-4作用于血管内皮细胞. 肝癌细胞株SMMC-7221通过体外培养, 免疫细胞化学实验可以发现, 他可通过自分泌机制分泌VEGF, 主要存在于胞质, 这与Tian et al研究的胃癌细胞自分泌VEGF的结果一致[7-8]. Abid et al[9]研究VEGF可以活化PI3K/AKT信号通路, 本研究中抑制此信号转导通路可以抑制VEGF表达, 可见VEGF可以通过PI3K/AKT信号转导途径正反馈生成, 从而为肿瘤血管的生成创造条件. 可见, 阻断PI3K/AKT信号转导通路可以抑制VEGF的生成, 从而抑制肿瘤的血道转移. Bachelder et al[10]研究发现, 体外抑制PI3K活性而实现抑制转移性乳腺癌细胞VEGF的表达从而诱导细胞凋亡也证实了这一点. 阻断PI3K/AKT转导通路也能阻断由表皮生长因子诱导的VEGF表达[11]. 但是多篇文献报道[12-14], 不同肿瘤中VEGF的信号转导通路并不相同, 可见在针对VEGF的抗肿瘤治疗过程中, 靶点并不一致.
侵袭和转移是恶性肿瘤的主要生物学特征, 是导致手术、放疗、化疗等手段失败和患者死亡的最主要原因. 肿瘤的侵袭和转移是一个极其复杂、多步骤的过程. 主要包括: 癌细胞从原发部位脱落, 结合并降解基底膜; 癌细胞侵入血管、淋巴管; 癌细胞在循环中运行和滞留最后穿出血管、淋巴管并增殖形成转移灶. CD44V6和CD44s二者均为异质性黏附因子, 经LY294002作用后表达下降并与其黏附能力下降成正相关. 可见阻断PI3K/AKT信号转导通路可以通过黏附分子CD44V6、CD44s表达下降而使其异质性黏附能力下降, 从而降低细胞的侵袭和转移. CD44分子是一种跨膜受体糖蛋白, 能够与多种配体分子结合, 参与细胞与细胞、细胞与ECM之间的特异性黏附. CD44V6在肿瘤转移中的主要作用可归纳为: (1)CD44V6高表达的癌细胞可获得淋巴细胞的伪装, 逃避人体免疫系统的识别和杀伤, 更易进入淋巴结, 形成转移[15]; (2)CD44V6表达的蛋白分子参与了癌细胞与基底层粘连蛋白及Ⅳ型胶原酶的黏附, 为癌细胞降解细胞外基质创造条件; (3)通过改变癌细胞的骨架构像和分布, 影响癌细胞的运动能力, 介导癌细胞的转移; (4)与细胞外基质中的配体结合, 导致细胞形态、游走性的改变, 为肿瘤细胞的迁移奠定基础[16]. 众多文献表明[17], CD44V6与人类多种恶性肿瘤组织如: 胃癌、结肠癌、肝癌、乳腺癌、肺癌、卵巢癌、鼻咽癌等肿瘤生长、侵袭和转移有关, 普遍存在CD44V6表达失控[18-21]. Endo et al研究表明高表达CD44V6的肝癌细胞患者高转移率和低生存率[22-23], 因此有人提出将其作为判断肿瘤预后的标记物. CD44s在肿瘤转移中的作用则报道不一, Mathew et al[24]研究正常肝细胞表面不表达CD44s, 在27例肝细胞肝癌中, 6例CD44s阳性, 其中5例有转移. 本实验中经流式细胞仪检测: SMMC-7221的CD44s表达率为85%, 经LY294002处理后表达明显下降(P<0.005), 下降率与黏附能力下降成正比. 推测在SMMC-7221中CD44s通过PI3K/AKT信号转导途径表达, 并在肿瘤转移中具有重要作用. CD44分子与VEGF之间也存在着密切的关系, 高表达CD44分子的肿瘤具有高侵袭性, 在肿瘤转移过程中二者密切配合. 在食管鳞癌, 大肠癌, 乳腺癌, 肝癌等多种癌组织中都有二者的同时表达升高并且与转移成高度相关性[25-28]. 二者具体的分子生物学关系有待于深入研究.
本实验应用PI3K/AKT通路抑制剂LY294002能够特异性的抑制PI3K的p110亚单位的催化活性, 这种抑制剂因为对细胞的毒性还都限于体外研究, 尚未发展到临床应用[29-30]. 尽管如此, 对信号转导途径中靶点的治疗已经成为治疗肿瘤的重要策略之一[31-32]. 通过此实验研究发现, PI3K/AKT通路在肝癌细胞的生长、增殖、黏附能力及黏附分子表达方面具有重要的作用, Ward et al多年来一直研究其在多种肿瘤中的各种作用, 已取得了一定成果, 但其机制纷繁复杂, 仍有待于深入研究, 其有可能为肿瘤的突破点之一.
PI3K/AKT(磷脂酰肌醇-3-激酶/蛋白激酶B)信号转导通路广泛存在于细胞中, 是参与调节细胞生长、增殖、分化的信号传导通路. 近年来研究表明, PI3K/AKT信号转导通路在肿瘤的恶性增殖、血管新生和侵袭转移中起着重要作用.
张吉翔, 教授, 南昌大学第二附属医院消化内科
PI3K/AKT信号转导通路在肿瘤侵袭、转移中的机制还不清除, 因此探明其机制及寻找有效的抑制剂抑制该通路的高活性在肿瘤治疗方面显得尤为重要.
本研究应用LY294002特异性抑制肝癌细胞PI3K后, 检测黏附分子、血管内皮生长因子及黏附能力变化及其相关性, 从而探讨肿瘤转移机制.
本研究为寻找PI3K/AKT信号转导通路中靶点治疗以及预防转移和复发提供科学依据.
本文探讨了PI3K/AKT信号转导通路在人肝癌细胞株SMMC-7221生长、黏附中的作用以及其作用机制, 具有一定的前沿性.
编辑: 潘伯荣 电编:吴鹏朕
| 2. | Sithanandam G, Smith GT, Masuda A, Takahashi T, Anderson LM, Fornwald LW. Cell cycle activation in lung adenocarcinoma cells by the ErbB3/phosphatidylinositol 3-kinase/Akt pathway. Carcinogenesis. 2003;24:1581-1592. [PubMed] [DOI] |
| 3. | Testa JR, Bellacosa A. AKT plays a central role in tumorigenesis. Proc Natl Acad Sci U S A. 2001;98:10983-10985. [PubMed] [DOI] |
| 6. | Cheng JC, Chou CH, Kuo ML, Hsieh CY. Radiation-enhanced hepatocellular carcinoma cell invasion with MMP-9 expression through PI3K/Akt/NF-kappaB signal transduction pathway. Oncogene. 2006;25:7009-7018. [PubMed] [DOI] |
| 7. | Tian X, Song S, Wu J, Meng L, Dong Z, Shou C. Vascular endothelial growth factor: acting as an autocrine growth factor for human gastric adenocarcinoma cell MGC803. Biochem Biophys Res Commun. 2001;286:505-512. [PubMed] [DOI] |
| 8. | Baek JH, Jang JE, Kang CM, Chung HY, Kim ND, Kim KW. Hypoxia-induced VEGF enhances tumor survivability via suppression of serum deprivation-induced apoptosis. Oncogene. 2000;19:4621-4631. [PubMed] [DOI] |
| 9. | Abid MR, Guo S, Minami T, Spokes KC, Ueki K, Skurk C, Walsh K, Aird WC. Vascular endothelial growth factor activates PI3K/Akt/forkhead signaling in endothelial cells. Arterioscler Thromb Vasc Biol. 2004;24:294-300. [PubMed] [DOI] |
| 10. | Bachelder RE, Crago A, Chung J, Wendt MA, Shaw LM, Robinson G, Mercurio AM. Vascular endothelial growth factor is an autocrine survival factor for neuropilin-expressing breast carcinoma cells. Cancer Res. 2001;61:5736-5740. [PubMed] |
| 11. | Huang GW, Yang LY, Lu WQ. Effects of PI3K and p42/p44 MAPK on overexpression of vascular endothelial growth factor in hepatocellular carcinoma. World J Gastroenterol. 2004;10:809-812. [PubMed] |
| 12. | Goh PP, Sze DM, Roufogalis BD. Molecular and cellular regulators of cancer angiogenesis. Curr Cancer Drug Targets. 2007;7:743-758. [PubMed] [DOI] |
| 13. | Hutson TE, Figlin RA. Evolving role of novel targeted agents in renal cell carcinoma. Oncology (Williston Park). 2007;21:1175-1180; discussion 1184, 1187, 1190. [PubMed] |
| 14. | Epstein RJ. VEGF signaling inhibitors: more pro-apoptotic than anti-angiogenic. Cancer Metastasis Rev. 2007;26:443-452. [PubMed] [DOI] |
| 16. | Peterson RM, Yu Q, Stamenkovic I, Toole BP. Perturbation of hyaluronan interactions by soluble CD44 inhibits growth of murine mammary carcinoma cells in ascites. Am J Pathol. 2000;156:2159-2167. [PubMed] |
| 17. | Dämmrich J, Vollmers HP, Heider KH, Müller-Hermelink HK. Importance of different CD44v6 expression in human gastric intestinal and diffuse type cancers for metastatic lymphogenic spreading. J Mol Med. 1995;73:395-401. [PubMed] |
| 18. | Lin HZ, Chen L, Zhou DF, Hao LH, Li XC, Chang H. Study on the early liver metastasis forecast of colorectal neoplasms. Zhonghua Waike Zazhi. 2006;44:1486-1489. [PubMed] |
| 19. | Bendardaf R, Algars A, Elzagheid A, Korkeila E, Ristamäki R, Lamlum H, Collan Y, Syrjänen K, Pyrhönen S. Comparison of CD44 expression in primary tumours and metastases of colorectal cancer. Oncol Rep. 2006;16:741-746. [PubMed] |
| 20. | Hong SC, Song JY, Lee JK, Lee NW, Kim SH, Yeom BW, Lee KW. Significance of CD44v6 expression in gynecologic malignancies. J Obstet Gynaecol Res. 2006;32:379-386. [PubMed] [DOI] |
| 21. | Cho EY, Choi Y, Chae SW, Sohn JH, Ahn GH. Immunohistochemical study of the expression of adhesion molecules in ovarian serous neoplasms. Pathol Int. 2006;56:62-70. [PubMed] [DOI] |
| 23. | Endo K, Terada T. Protein expression of CD44 (standard and variant isoforms) in hepatocellular carcinoma: relationships with tumor grade, clinicopathologic parameters, p53 expression, and patient survival. J Hepatol. 2000;32:78-84. [PubMed] [DOI] |
| 24. | Mathew J, Hines JE, Obafunwa JO, Burr AW, Toole K, Burt AD. CD44 is expressed in hepatocellular carcinomas showing vascular invasion. J Pathol. 1996;179:74-79. [PubMed] [DOI] |
| 27. | 章 建国, 姚 登福, 朱 永昌, 黄 锋, 吴 信华, 施 公胜. CD44 V6和VEGF在肝癌组织中的表达及其预后价值的研究. 胃肠病学和肝病学杂志. 2005;14:556-559. |
| 29. | Vlahos CJ, Matter WF, Hui KY, Brown RF. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). J Biol Chem. 1994;269:5241-5248. [PubMed] |
| 30. | Ward SG, Finan P. Isoform-specific phosphoi-nositide 3-kinase inhibitors as therapeutic agents. Curr Opin Pharmacol. 2003;3:426-434. [PubMed] [DOI] |
| 31. | Mimeault M, Batra SK. Recent advances on multiple tumorigenic cascades involved in prostatic cancer progression and targeting therapies. Carcinogenesis. 2006;27:1-22. [PubMed] [DOI] |
| 32. | Ozaki K. Targeted molecular strategies for cancer therapy based on the blockage of oncogenic pathways in human tumor cells. Yakugaku Zasshi. 2007;127:983-991. [PubMed] [DOI] |