修回日期: 2008-03-13
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 探讨术前化疗对损伤修复机制的影响.
方法: 应用EnVision免疫组化法检测41例正常肝组织、187例(术前未做化疗患者99例和术前行经肝动脉插管化疗患者88例)原发性肝癌患者的肝癌组织和癌旁组织中hOGG1和PARP的表达.
结果: 正常肝组织、术前化疗组与术前未化疗组肝癌组织中, hOGG1蛋白细胞核表达阳性分度依次递增, 而PARP蛋白细胞核表达阳性分度依次递减, 三者之间差异均有显著性差异(均P<0.05). PARP癌旁组织阳性表达强度(P = 0.038)、ALT(P = 0.001)、病理分级(P = 0.040)是肿瘤复发的危险因素, 外周血淋巴细胞数(P = 0.026)、化疗(P = 0.049)是肿瘤复发的保护因素.
结论: 术前化疗可以杀伤对氧化损伤敏感的肝癌细胞.
引文著录: 苏智雄, 彭涛, 叶新平, 肖开银, 尚丽明, 苏铭, 黎乐群. 术前化疗对hOGG1及PARP在原发性肝癌组织中表达的影响. 世界华人消化杂志 2008; 16(13): 1412-1416
Revised: March 13, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To explore the effect of preoperative chemotherapy on repair mechanism.
METHODS: EnVision immunohistochemical method was used to detect the expression of human 8-oxoGuanine DNA glycosylase-1 (hOGG1) and poly ADP-ribose polymerase (PARP) in normal liver tissues (n = 41), hepatocellular carcinoma (HCC) and its surrounding tissues (n = 187; preoperative chemotherapy, n = 88; without preoperative chemotherapy, n = 99).
RESULTS: The expression levels of hOGG1 in nuclei were increased ordinally, while those of PARP were decreased ordinally in HCC tissues without preoperative chemotherapy, HCC tissues received preoperative chemotherapy, and normal liver tissues, and there were marked difference between the three groups (all P < 0.05). COX multivariate analysis of prognosis indicated that the risk factors for HCC recurrence included the positive degree of PARP expression (P = 0.038), alanine aminotransferase (ALT) level (P = 0.001), and histological grades (P = 0.040), while the protective factors included the peripheral blood lymphocyte count (P = 0.026) and chemotherapy (P = 0.049).
CONCLUSION: Preoperative chemotherapy promote the ability of DNA repair in HCC tissues.
- Citation: Su ZX, Peng T, Ye XP, Xiao KY, Shang LM, Su M, Li LQ. Effect of preoperative chemotherapy on the expression of human 8-oxoGuanine DNA glycosylase-1 and poly ADP-ribose polymerase in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1412-1416
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1412.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1412
肝细胞性肝癌(hepatocellular carcinoma, HCC)是我国最常见的恶性肿瘤之一. 研究表明, DNA损伤修复机制与多种肿瘤的发生、发展以及预后有关[1], 而且其中某些重要因子很可能成为未来肿瘤治疗的靶向分子. hOGG1(human 8-oxoGuanine DNA glycosylase-1, hOGG1)基因产物hOGG1蛋白具有DNA糖苷酶和AP裂解酶活性, 可特异切除修复8-oxoG以及自发碱基丢失、或因DNA糖苷化作用产生的阻断DNA复制的脱嘌呤或脱嘧啶(AP)位点[2-4]. DNA损伤后, 聚ADP核糖聚合酶(poly ADP-ribose polymerase, PARP)被DNA缺口激活, 并与之结合, 通过合成并转运长链ADP-核糖多聚体到DNA修复蛋白上, 完成对DNA的修复[5]. 我们通过检测正常肝组织、肝癌组织和癌旁组织中hOGG1、PARP蛋白的表达, 探讨术前化疗对肿瘤损伤修复机制的影响.
2003-10/2006-07在我院接受手术治疗经病理证实的原发性肝癌患者187例, 其中术前未行化疗患者(Ⅰ组)99例, 术前7-14 d行经肝动脉插管化疗患者(Ⅱ组)88例, Ⅰ组: 男86例, 女13例, 年龄23-75岁; Ⅱ组男79例, 女9例, 年龄22-68岁. 两组间性别构成、年龄大小、肿瘤大小、HBsAg状态、AFP大小、血红蛋白、白蛋白、总胆红素、肝硬化程度差异无统计学意义. 兔抗人hOGG1为英国Abcom公司产品, 兔抗人PARP和EnVision免疫组化试剂盒均为迈新生物技术开发有限公司产品.
用药方案: 表阿霉素(ADM)75 mg/m2; 顺铂(PDD)40 mg/m2; 5氟尿嘧啶(5-FU)500 mg/m2. 取手术切除的肝癌和距肿瘤2 cm以上癌旁组织制作石蜡标本, 常规光镜检查获得病理诊断. 另选取HBsAg阴性血管瘤患者正常肝组织及肝移植供肝41例做正常对照. 标本均经40 g/L甲醛固定, 石蜡包埋.
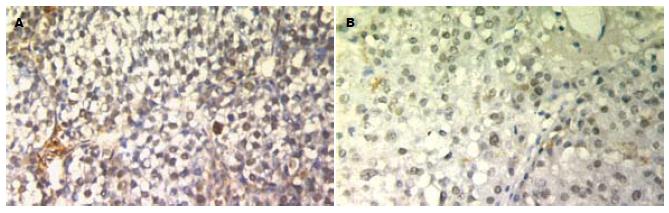
正常肝组织、癌组织、癌旁组织中hOGG1、PARP蛋白的测定用EnVision免疫组化法测定. 具体步骤: 石蜡切片脱蜡, hOGG1蜡块不进行抗原修复, PARP蜡块0.01 mol/L枸橼酸钠高压热修复抗原. 30 mL/L H2O2溶液室温孵育15 min. 滴加一抗、聚合物增强剂及酶标鼠/兔聚合物, 同时设阴性对照, DAB显色, 苏木素复染. 70℃烤片20 min. 中性树胶封片. 必须同时具备肝组织弥漫性纤维化及假小叶形成, 才能作出肝硬化病理诊断[6]. 免疫组化阳性信号为棕黄色细小颗粒状, 定位于细胞核和/或细胞质. 染色结果参照Mark Ke1ley实验室的标准[7]进行肿瘤细胞阳性计分, 首先在高倍镜下计数1000个肿瘤细胞, 避开肿瘤边缘及坏死区域. 根据阳性细胞数目所占百分比得出细胞核或细胞质标记指数(labeling index, LI), 即细胞核或细胞质LI = 阳性瘤细胞数/1000个肿瘤细胞×100%. 分为以下四级计分: Ⅰ: 0分, <10%; Ⅱ: 1分, 11%-25%; Ⅲ: 2分, 26%-50%;Ⅳ: 3分, 51%以上. 染色强度按瘤细胞着色的深浅计分: 0分, 阴性; 1分, 弱阳性; 2分, 中等阳性; 3分, 强阳性. 将2个分值相加即得出该例标本的免疫组化阳性分度: 0-1分为阴性, 记为(-); 2-4分为弱阳性, 记为(+); 5分以上为阳性, 记为(++).
统计学处理 SPSS10.0统计软件包处理, 率的比较用χ2检验; P<0.05为有统计学显著性.
hOGG1细胞核阳性分度在正常对照组、Ⅱ组癌旁组织、Ⅰ组癌旁组织、Ⅱ组癌组织、Ⅰ组癌组织中呈依次递增趋势, PARP细胞核程递减趋势. 正常对照组与Ⅰ组癌组织、Ⅱ组癌组织比较, Ⅰ组癌组织与Ⅱ组癌组织比较均有临床意义的差异(表1, 图1). 2.2 病例随访
| 组织类型 | n | hOGG1细胞核 | PARP细胞核 | ||||
| - | + | ++ | - | + | ++ | ||
| 正常对照组 | 41 | 29(70.7) | 9(22.0) | 3(7.3) | 12(29.3) | 28(68.3) | 1(2.4) |
| Ⅰ组癌组织 | 99 | 22(22.2) | 32(32.3) | 45(45.5) | 70(70.7) | 21(21.2) | 8(8.1) |
| Ⅰ组癌旁组织 | 99 | 54(54.5) | 36(36.4) | 9(9.1) | 41(41.4) | 49(49.5) | 9(9.1) |
| Ⅱ组癌组织 | 88 | 29(33.0) | 31(35.2) | 28(31.8) | 48(54.5) | 32(36.4) | 8(9.1) |
| Ⅱ组癌旁组织 | 88 | 51(58.0) | 27(30.7) | 10(11.3) | 36(40.9) | 46(52.3) | 6(6.8) |
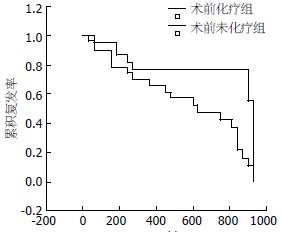
分别在术前化疗组和术前未化疗组中, 取2005-05以前病例进行随访, 其中术前化疗组38例, 术前未化疗组44例, 肿瘤复发时间为手术日期到影像学发现复发日期.
用Life Table法将化疗组与未化疗组复发时间进行比较, 其复发率差异有统计学意义(P = 0.049). 化疗组中位未复发时间是905.6 d, 未化疗组中位未复发时间是614.6 d(图2). 术前化疗组及未化疗组hOGG1蛋白表达阴性(-)和阳性(+)病例, 与hOGG1蛋白表达阳性(++)病例复发时间比较, 其癌组织、癌旁组织复发率差异无统计学意义. 术前化疗组、术前未化疗组PARP蛋白表达阴性(-)病例, 与PARP蛋白表达阳性(+、++)病例复发时间比较, 其癌组织、癌旁组织复发率差异无统计学意义. 按统计软件要求整理数据(表2). Cox回归分析结果, PARP癌旁组织阳性表达强度(P = 0.038)、ALT(P = 0.001)、病理分级(P = 0.040)是肿瘤复发的危险因素, 外周血淋巴细胞数(P = 0.026)和介入治疗(P = 0.049)是肿瘤复发的保护因素(表3).
| 复发因素 | 变量 | 数量化及编码 |
| hOGG1癌组织阳性表达 | X1 | - = 0、+ = 1、++ = 2 |
| hOGG1癌旁组织阳性表达 | X2 | - = 0、+ = 1、++ = 2 |
| PARP癌组织阳性表达 | X3 | - = 0、+ = 1、++ = 2 |
| PARP癌旁组织阳性表达 | X4 | - = 0、+ = 1、++ = 2 |
| 年龄 | X5 | 具体数值 |
| 白细胞 | X6 | 具体数值 |
| 淋巴细胞 | X7 | 具体数值 |
| 总胆红素 | X8 | 具体数值 |
| 白蛋白 | X9 | 具体数值 |
| ALT | X10 | 具体数值 |
| HBsAg | X11 | 阴性 = 0、阳性 = 1 |
| 甲胎蛋白 | X12 | 具体数值 |
| 介入治疗 | X13 | 否 = 0、是 = 1 |
| 肿瘤大小 | X14 | 具体数值 |
| 有否肝硬化 | X15 | 无 = 0、有 = 1 |
| 病理分级 | X16 | Ⅰ = 0、Ⅱ = 1、Ⅲ = 2、Ⅳ = 3 |
| 变量 | 回归系数 | 标准误 | Waldχ2值 | 自由度 | P值 | 相对危险度 |
| X1 | 0.509 | 0.414 | 1.516 | 1 | 0.218 | 1.664 |
| X2 | -0.566 | 0.523 | 1.170 | 1 | 0.279 | 0.568 |
| X3 | -0.483 | 0.628 | 0.592 | 1 | 0.442 | 0.617 |
| X4 | 1.120 | 0.540 | 4.305 | 1 | 0.038 | 3.065 |
| X5 | -0.028 | 0.029 | 0.975 | 1 | 0.323 | 0.972 |
| X6 | -0.040 | 0.218 | 0.033 | 1 | 0.855 | 0.961 |
| X7 | -1.461 | 0.654 | 4.986 | 1 | 0.026 | 0.232 |
| X8 | 0.039 | 0.041 | 0.890 | 1 | 0.346 | 1.040 |
| X9 | 0.045 | 0.072 | 0.402 | 1 | 0.526 | 1.046 |
| X10 | 0.020 | 0.006 | 11.697 | 1 | 0.001 | 1.021 |
| X11 | -0.388 | 0.642 | 0.366 | 1 | 0.545 | 0.678 |
| X12 | 0.000 | 0.000 | 1.763 | 1 | 0.184 | 1.000 |
| X13 | -1.086 | 0.552 | 3.865 | 1 | 0.049 | 0.338 |
| X14 | -0.001 | 0.067 | 0.000 | 1 | 0.987 | 0.999 |
| X15 | -0.246 | 0.612 | 0.162 | 1 | 0.688 | 0.782 |
| X16 | 0.905 | 0.440 | 4.234 | 1 | 0.040 | 2.471 |
各种环境致癌和致突变物质均可引起DNA损伤. 这些物质与超过1/3的肿瘤发生有关[8]. 细胞在生理或病理状态下产生的活性氧也可以造成DNA损伤. DNA损伤得不到及时有效的修复, 细胞将发生基因突变和癌变. 因此, 由各种因素导致的DNA氧化损伤, 可能参与肝癌的发生和发展.
hOGG1基因编码的蛋白产物具有DNA糖苷酶和AP裂解酶活性, 可以特异切除DNA氧化损伤的重要产物8-羟基鸟嘌呤(8-oxoG), 从而避免在DNA复制过程中因错配而导致的G:C→T:A颠换突变[2]. 8-oxoG是氧化自由基攻击DNA形成的主要产物, 是一种重要的致癌性致突变性损伤[9]. Kondo et al研究发现在结肠癌组织中hOGG1蛋白表达明显升高, 并与8-oxoG含量呈明显正相关[10]. 但在人类肺癌和肾癌组织中未发现癌组织和癌旁组织hOGG1蛋白表达的差异[11]. hOGG1可以修复由阿霉素等化疗药物所致的线粒体DNA损伤和防止突变发生[12]. hOGG1蛋白表达增高间接说明细胞氧化损伤加重. 本研究结果显示, hOGG1蛋白表达细胞核阳性分度在正常对照组、化疗组癌组织、未化疗组癌组织中呈依次递增趋势. 未化疗组癌组织hOGG1蛋白表达高于化疗组癌组织. 表明肝癌组织在化疗药物作用下氧化损伤的修复活性降低. 这可能是肝癌组织经化疗药物作用后, hOGG1蛋白表达高的细胞对化疗药物敏感, 首先凋亡, 余下的相对耐药的肝癌细胞hOGG1蛋白表达低有关; 有研究显示TACE诱导肝癌细胞凋亡是其最主要的治疗机制, 这种作用以早期最为明显[13]. 是否hOGG1蛋白表达高的肝癌细胞对化疗药物敏感, 有待进一步研究.
PARP是一类存在于多数真核细胞中的蛋白质翻译后修饰酶. 主要存在于细胞核内, 少量存在于细胞质内. 目前研究发现, PARP家族至少有6个成员, 分别是: PARP-1, PARP-2, PARP-3, PARP-4/VPARP, Tankyrase-1和-2等. PARP具有保持染色体结构完整、参与DNA复制和转录的功能, 在维持基因组稳定和细胞凋亡过程中发挥作用. PARP在DNA损伤断裂时被激活, 作为DNA损伤的分子感受器, 识别、结合到DNA断裂处, 激活、催化受体蛋白的聚ADP核糖基化作用, 参与DNA的修复. PARP与组蛋白H1结合, 影响核小体的正常结构, 使染色体形成开放、松散结构, 有利于DNA修复[14]. PARP抑制或基因缺陷小鼠的研究可以肯定PARP在维持基因组稳定方面起着关键的作用. 研究发现, 化学性PARP抑制剂增加了姐妹染色体交换(sister chromsome exchang, SCE)的几率, 表明在DNA损伤剂的作用下, 增加基因重组的发生率. 把PARP的DNA结合域导入Hela细胞, 结果增加了自发性和损伤诱导的SCE. PARP-/-小鼠在没有DNA损伤、微核和染色体损伤的情况下, 受烷化剂和放射刺激后SCE的几率增加. DNA断裂可以激发基因重组, PARP的作用是结合到受损DNA的断端减少重组发生, 并避免损伤DNA受核酸外切酶的作用产生重组中间物. PARP在DNA损伤时被激活, 识别并结合到DNA断裂部位, 从而保护裸露的DNA末端免遭核酸酶的分解[15]. 本研究结果显示, PARP蛋白表达细胞核阳性分度在正常对照组、化疗组癌组织、未化疗组癌组织中呈依次递减趋势. 未化疗组癌组织PARP蛋白表达低于化疗组癌组织. 表明肝癌组织在化疗药物作用下DNA损伤修复能力上调, 经过术前化疗药物筛选的DNA损伤修复能力加强的癌细胞如果逃避了手术切除可能成为术后复发的来源. 是否化疗药物可减少肝癌细胞抑制PARP活性能力, 从而增加肝癌细胞凋亡, 有待进一步研究.
单因素分析发现介入治疗可以降低肝癌的复发, 但未发现hOGG1、PARP蛋白在癌或癌旁组织表达对复发的影响. 多因素分析显示, PARP癌旁组织阳性表达强度高的患者, 肝癌复发的可能性增加, 提示PARP在癌细胞和癌旁细胞扮演两个不同的角色, PARP在癌细胞可能扮演凋亡角色, PARP在癌旁细胞可能扮演DNA损伤修复角色, 有研究表明PARP在细胞的凋亡以及DNA损伤修复方面起作用[11]. PARP在癌旁细胞修复活性加强是否对肿瘤细胞有保护作用值得进一步研究. PARP也许可以成为提示肝癌患者预后的新指标. 多因素分析还显示淋巴细胞数高的患者, 肝癌复发的可能性降低, 这可以从免疫方面考虑, 这可能是淋巴细胞数高的患者, 免疫功能较强, 从而减少肿瘤复发. 另外ALT高, 说明患者肝细胞损伤重, 可能损伤/修复的病生理过程有促进肝癌复发的作用. 而病理等级越高, 肿瘤分化越差, 肝癌越易于复发.
总之, 术前化疗可以杀伤对氧化损伤敏感的肝癌细胞, 表现为未化疗组癌组织hOGG1蛋白表达高于化疗组癌组织, 未化疗组癌组织PARP蛋白表达低于化疗组癌组织. PARP癌旁组织阳性表达强度高的患者, 肝癌复发的可能性增加, PARP也许可以成为提示肝癌患者预后的新指标.
肝细胞性肝癌是我国最常见的恶性肿瘤之一. 研究表明, DNA损伤修复机制与多种肿瘤的发生、发展以及预后有关, 本研究通过检测正常肝组织、肝癌组织和癌旁组织中hOGG1、PARP蛋白的表达, 探讨术前化疗对肿瘤损伤修复机制的影响, 为临床治疗肝癌提供理论依据.
刘彬彬, 副研究员, 复旦大学附属中山医院、复旦大学肝癌研究所
hOGG1蛋白表达高的肝癌细胞是否就对化疗药物敏感, 有待进一步研究.
本文应用EnVision免疫组化法检测DNA修复酶hOGG1及PARP在原发性肝癌及癌旁组织中的表达, 探讨术前化疗对损伤修复机制的影响, 为术前行肝动脉插管化疗提供理论依据.
hOGG1: 蛋白具有DNA糖苷酶和AP裂解酶活性, 可特异切除修复8-oxoG以及自发碱基丢失、或因DNA糖苷化作用产生的阻断DNA复制的脱嘌呤或脱嘧啶(AP)位点.
本研究数据分析合理, 具有一定的学术价值, 但创新性一般.
编辑: 李军亮 电编:吴鹏朕
| 1. | Loeb KR, Loeb LA. Significance of multiple mutations in cancer. Carcinogenesis. 2000;21:379-385. [PubMed] [DOI] |
| 2. | Floyd RA. The role of 8-hydroxyguanine in carcinogenesis. Carcinogenesis. 1990;11:1447-1450. [PubMed] [DOI] |
| 3. | Kannan S, Pang H, Foster DC, Rao Z, Wu M. Human 8-oxoguanine DNA glycosylase increases resistance to hyperoxic cytotoxicity in lung epithelial cells and involvement with altered MAPK activity. Cell Death Differ. 2006;13:311-323. [PubMed] [DOI] |
| 4. | Banerjee A, Yang W, Karplus M, Verdine GL. Structure of a repair enzyme interrogating undamaged DNA elucidates recognition of damaged DNA. Nature. 2005;434:612-618. [PubMed] [DOI] |
| 5. | Minor T, Olschewski P, Tolba RH, Akbar S, Kocalkova M, Dombrowski F. Liver preservation with HTK: salutary effect of hypothermic aerobiosis by either gaseous oxygen or machine perfusion. Clin Transplant. 2002;16:206-211. [PubMed] [DOI] |
| 7. | Wang D, Luo M, Kelley MR. Human apurinic endonuclease 1 (APE1) expression and prognostic significance in osteosarcoma: enhanced sensitivity of osteosarcoma to DNA damaging agents using silencing RNA APE1 expression inhibition. Mol Cancer Ther. 2004;3:679-686. [PubMed] |
| 8. | Khanna KK, Jackson SP. DNA double-strand breaks: signaling, repair and the cancer connection. Nat Genet. 2001;27:247-254. [PubMed] [DOI] |
| 9. | Marnett LJ. Oxyradicals and DNA damage. Carcinogenesis. 2000;21:361-370. [PubMed] [DOI] |
| 10. | Kondo S, Toyokuni S, Tanaka T, Hiai H, Onodera H, Kasai H, Imamura M. Overexpression of the hOGG1 gene and high 8-hydroxy-2'-deoxyguanosine (8-OHdG) lyase activity in human colorectal carcinoma: regulation mechanism of the 8-OHdG level in DNA. Clin Cancer Res. 2000;6:1394-1400. [PubMed] |
| 11. | Chevillard S, Radicella JP, Levalois C, Lebeau J, Poupon MF, Oudard S, Dutrillaux B, Boiteux S. Mutations in OGG1, a gene involved in the repair of oxidative DNA damage, are found in human lung and kidney tumours. Oncogene. 1998;16:3083-3086. [PubMed] [DOI] |
| 12. | Singh KK, Sigala B, Sikder HA, Schwimmer C. Inactivation of Saccharomyces cerevisiae OGG1 DNA repair gene leads to an increased frequency of mitochondrial mutants. Nucleic Acids Res. 2001;29:1381-1388. [PubMed] [DOI] |
| 14. | Duriez PJ, Shah GM. Cleavage of poly(ADP-ribose) polymerase: a sensitive parameter to study cell death. Biochem Cell Biol. 1997;75:337-349. [PubMed] [DOI] |
| 15. | Gilliams-Francis KL, Quaye AA, Naegele JR. PARP cleavage, DNA fragmentation, and pyknosis during excitotoxin-induced neuronal death. Exp Neurol. 2003;184:359-372. [PubMed] [DOI] |