修回日期: 2008-03-11
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 研究胃癌组织中真核细胞起始因子4E(eukaryotic initiation factor 4E, eIF4E), 血管内皮生长因子(vascular endothelial growth factor, VEGF)和细胞周期素D1(Cyclin D1)蛋白的表达水平及其与临床病理的关系.
方法: 胃癌组织91例和正常胃黏膜组织30例采用免疫组织化学方法检测eIF4E, VEGF和Cyclin D1的表达, 分析其表达差异, 并结合其临床病理资料进行综合分析.
结果: 与正常胃组织相比, eIF4E, VEGF和Cyclin D1蛋白在胃癌组织中均呈高表达(95.6%, 68.1%, 84.6% vs 0.0%, 均P<0.01). eIF4E, VEGF和Cyclin D1的阳性表达率与患者的年龄、性别以及肿瘤分化程度均无明显相关性, 但随着肿瘤浸润深度加深、淋巴转移产生、临床分期提高而升高(P<0.05). eIF4E与VEGF, eIF4E与Cyclin D1的表达呈正相关(r = 0.407, P<0.05; r = 0.780, P<0.01).
结论: eIF4E, VEGF和Cyclin D1的表达与胃癌的侵袭、转移密切相关, eIF4E表达与VEGF以及Cyclin D1显著相关.
引文著录: 方向明, 胡继军. 胃癌组织中eIF4E、VEGF和Cyclin D1的表达及其意义. 世界华人消化杂志 2008; 16(12): 1304-1308
Revised: March 11, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To investigate the expression of eukaryotic initiation factor 4E (eIF4E), vascular endothelial growth factor (VEGF) and Cyclin D1 in gastric cancerous tissues and their correlations with the clinical pathology.
METHODS: Immunohistochemistry was used to detect the expression of eIF4E, VEGF and Cyclin D1 in 91 specimens of gastric cancer and 30 specimens of normal gastric tissues. The corresponding clinical data were analyzed retrospectively.
RESULTS: In comparison with those in normal gastric mucosa, the expression of eIF4E, VEGF and Cyclin D1 were significantly increased (95.6%, 68.1%, 84.6% vs 0.0%, all P < 0.01), which were significantly correlated with the depth of invasion, lymph node metastasis and clinical stages (P < 0.05), but not with the age, sex of patients and tumor differentiation. There was a positive correlation between eIF4E and VEGF expression (r = 0.407, P < 0.05) as well as between eIF4E and Cyclin D1 expression (r = 0.780, P < 0.01).
CONCLUSION: The expression of eIF4E, VEGF and Cyclin D1 are closely correlated with the invasion and metastasis of gastric carcinoma, and moreover, eIF4E expression is positively correlated with VEGF and Cyclin D1 expression.
- Citation: Fang XM, Hu JJ. Expression of eukaryotic initiation factor 4E, vascular endothelial growth factor and Cyclin D1 in gastric carcinoma and their significances. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1304-1308
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1304.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1304
胃癌是危害人类健康的常见恶性肿瘤. 我国属胃癌高发国家, 目前我国胃癌死亡率在所有恶性肿瘤中居第1位[1]. 胃癌的发生发展尽管存在着基因变异的复杂性和多样性, 但现有的研究认为, 任何形式的基因变异均在蛋白质水平上发挥功能[2-3], 因此, 真核细胞(蛋白翻译)起始因子与肿瘤的关系日益受到重视, 其中尤以真核细胞起始因子4E(eukaryotic initiation factor 4E, eIF4E)与肿瘤的关系最为密切[4-8]. 有资料显示, eIF4E能使一些肿瘤恶性相关基因的表达量发生变化, 是肿瘤恶性表型产生的决定子; 通过调节一些特异的恶性相关分子的翻译表达量, 促使细胞跃过正常生长限制而发生癌变[9-10]. 我们对胃癌组织中eIF4E, 血管内皮生长因子(vascular endothelial growth factor, VEGF), 细胞周期素D1(Cyclin D1)的表达进行研究, 并结合临床病理情况进行分析, 以探讨其在胃癌发生发展过程中的意义.
2002-10/2004-10我院经手术切除并经病理学证实的胃癌组织标本91例, 术前均未接受化放疗. 男61例, 女30例, 年龄37-79(平均51.2)岁; 肿瘤高分化31例, 中分化18例, 低分化39例, 未分化3例; 侵犯浆膜者58例, 未侵犯浆膜者33例; 有淋巴结转移53例, 无淋巴结转移38例; TNM分期: Ⅰ期14例, Ⅱ期22例, Ⅲ期45例, Ⅳ期10例. 另选择同期经胃镜及病理组织学检查正常的胃黏膜标本30例作为研究对照. 男20例, 10例, 年龄35-74(平均48.4)岁. 鼠抗人eIF4E mAb, 鼠抗人VEGF mAb, 鼠抗人Cyclin D1 mAb均购自美国Santa Cruz公司. 免疫组化二步法试剂盒购自美国Antibody Diagnostic公司. DAB显色试剂盒购自北京中山生物技术有限公司.
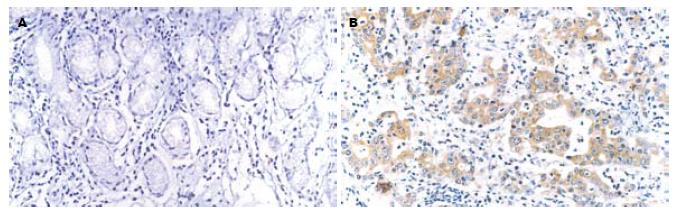
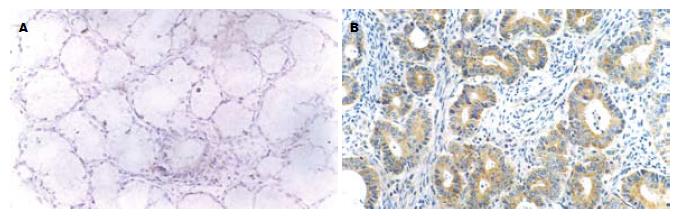
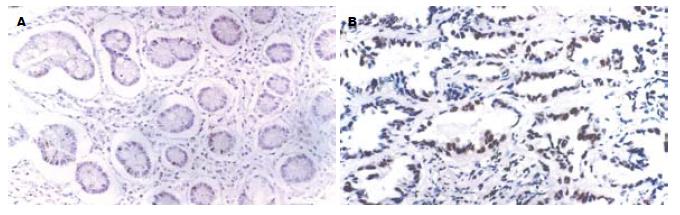
采用免疫组织化学二步法检测上述抗体对应抗原, 所有实验操作均按说明书操作规范进行, 实验中同时采用PBS代替一抗作为阴性对照, 以已知阳性反应的组织切片作为阳性对照. eIF4E阳性细胞为细胞质出现棕黄色颗粒, VEGF阳性细胞亦为细胞质出现棕黄色颗粒, Cyclin D1阳性细胞为细胞核出现棕黄色颗粒. 显微镜下随机选取5个高倍镜视野(>500个细胞), 分别计数阳性细胞数和总细胞数, 以阳性细胞数≥10%为阳性表达[11-12].
统计学处理 采用SPSS13.0统计软件包进行统计学分析. 各指标之间相关因素的差异性比较采用χ2检验, 各指标间的相关性研究采用Spearman相关分析, 检验水准为P<0.05.
胃癌组eIF4E, VEGF, Cyclin D1阳性表达率分别为95.6%(87/91), 68.1%(62/91)和84.6%(77/91), 均明显高于正常胃黏膜组织(均未见eIF4E, VEGF或Cyclin D1阳性表达; χ2 = 102.072, P<0.01; χ2 = 41.921, P<0.01; χ2 = 69.813, P<0.01, 图1-3).
1996年Jones et al[13]使用人小鼠体细胞杂交体分析技术将人eIF4E基因定位于染色体4q21-q25. eIF4E基因编码25 kDa的多肽eIF4E可特异性地与真核细胞mRNA的5'末端帽结构结合, 参与mRNA的翻译, 在帽依赖的翻译起始阶段起限制调控作用[14-15]. eIF4E的作用一般认为是通过增强某些生长因子或重要的细胞生长调节因子的翻译而发挥的[16-17]. 在恶性肿瘤形成过程中, 细胞的增殖需要大量的蛋白合成, eIF4E的表达增高是一个必然的事件[18-19]. eIF4E的过度表达不仅能促进细胞的增殖反应, 而且更能促进细胞的恶性转化[20-22]. Kerekatte et al[23]首先在人乳腺癌中发现eIF4E的过度表达, 且不存在于乳房良性组织. Li et al[24]进一步发现, 在乳腺癌Ⅰ-Ⅲ期患者中, 当肿块标本中eIF4E的含量超过正常对照7倍时, 肿瘤复发率、癌症致死率在统计学上有显著意义. 乳腺癌eIF4E的过度表达与肿瘤的复发、肿瘤的死亡有关, 可作为独立的预后因子. 我们发现, 胃癌中有95.6%的标本有eIF4E的阳性表达, 而正常胃组织中无1例阳性表达, 两者相比差异有显著性(P<0.01), 且eIF4E阳性表达率与肿瘤浸润深度、淋巴结转移以及TNM分期有关(P<0.05). 提示eIF4E基因表达上调与胃癌的形成密切相关, 并随着本病恶化程度的增加而持续增加, 其表达水平对评价胃癌的恶性程度有一定价值.
VEGF是一种非常重要的血管形成因子, 他在肿瘤新生血管形成以及肿瘤的生长、浸润及转移中起重要作用[25-26]. Cyclin D1是一种重要的细胞周期调控蛋白, 当Cyclin D1表达失控时, 则将引起细胞增殖失调, 进而导致肿瘤形成及发展[27-28]. 从本研究结果来看, 胃癌中VEGF, Cyclin D1阳性表达率分别为68.1%和84.6%, 而正常胃组织中均未见阳性表达, 同时随着胃癌浸润深度的增加、有淋巴结转移以及TNM分期愈晚者Cyclin D1表达水平明显升高, 表明Cyclin D1可能参与促进胃黏膜细胞恶性转化, 其过度表达预示肿瘤有较高的侵袭性、容易发生转移和不良预后. 目前认为, 在正常的eIF4E极低水平情况下, 肩负有"看家"功能的大多数拥有短5'非翻译区(UTR)的Strong mRNA, 他们在翻译时与含有长5'-UTR的Weak mRNA竞争中处于优势, 所以细胞功能得以维持; 然而, 在eIF4E过度表达情况下, 这些正常情况下不被翻译的含长5'-UTR mRNA的基因产物上调. 这些基因产物中包括一些原癌基因及一些重要的细胞生长调节因子, 如c-myc, Cyclin D1, VEGF, bFGF等[29-30]. 上述所提到的基因产物对细胞恶性转化和分裂有重要影响. 本研究通过检测eIF4E与VEGF及Cyclin D1在胃癌中表达, 分析他们之间的相关性, 结果表明, eIF4E分别与VEGF及Cyclin D1呈非常显著正相关, 提示胃癌中eIF4E高表达可能导致VEGF以及Cyclin D1表达水平增高. 这不仅有助于深入认识eIF4E致癌的分子机制, 而且有鉴于此, 可通过抑制或降低eIF4E表达水平来降低VEGF和Cyclin D1表达, 从而抑制胃癌细胞增殖, 这将是很好的抗肿瘤策略, 可能具有良好的应用前景.
目前我国胃癌死亡率在所有恶性肿瘤中位居首位. 近年来, 不少学者对胃癌的防治进行了研究, 并取得一些进展, 但由于对其发病机制尚未阐明, 因而胃癌的发病率与死亡率并未得到根本改善. 因此, 深入研究胃癌的发生机制, 尤其是寻找和发现与胃癌发生密切相关的新基因变异, 对提高胃癌的防治水平具有重要意义.
姜春萌, 教授, 大连医科大学附属第二医院消化科.
真核细胞(蛋白翻译)起始因子与肿瘤的关系日益受到重视, 其中尤以真核细胞起始因子4E(eIF4E)与肿瘤的关系最为密切.
有资料显示, eIF4E能使一些肿瘤恶性相关基因的表达量发生变化, 是肿瘤恶性表型产生的决定子, 其通过调节一些特异的恶性相关分子的翻译表达量, 促使细胞跃过正常生长限制而发生癌变.
为通过抑制或降低eIF4E表达水平来降低VEGF和Cyclin D1表达, 从而抑制胃癌细胞增殖提供了一定的依据.
真核细胞起始因子: 指参与真核细胞蛋白质生物合成起始阶段作用的蛋白因子. 目前已发现包括eIF2A、eIF2B、eIF4A、eIF4B和eIF4E在内的多种真核细胞起始因子, 其中以eIF4E与肿瘤的关系最为密切.
本研究具有一定的先进性, 设计规范, 讨论切题, 具有一定的参考价值.
编辑: 潘伯荣 电编:吴鹏朕
| 2. | Rosenwald IB. The role of translation in neoplastic transformation from a pathologist's point of view. Oncogene. 2004;23:3230-3247. [PubMed] |
| 3. | Barnhart BC, Simon MC. Taking aim at translation for tumor therapy. J Clin Invest. 2007;117:2385-2388. [PubMed] |
| 4. | Parker A, Anderson C, Weiss KL, Grimley M, Sorrells D. Eukaryotic initiation factor 4E staining as a clinical marker in pediatric neuroblastoma. J Pediatr Hematol Oncol. 2004;26:484-487. [PubMed] |
| 5. | Matthews-Greer J, Caldito G, de Benedetti A, Herrera GA, Dominguez-Malagon H, Chanona-Vilchis J, Turbat-Herrera EA. eIF4E as a marker for cervical neoplasia. Appl Immunohistochem Mol Morphol. 2005;13:367-370. [PubMed] |
| 6. | Gu X, Jones L, Lowery-Norberg M, Fowler M. Expression of eukaryotic initiation factor 4E in astrocytic tumors. Appl Immunohistochem Mol Morphol. 2005;13:178-183. [PubMed] |
| 7. | Zhou S, Wang GP, Liu C, Zhou M. Eukaryotic initiation factor 4E (eIF4E) and angiogenesis: prognostic markers for breast cancer. BMC Cancer. 2006;6:231. [PubMed] |
| 8. | Salehi Z, Mashayekhi F, Shahosseini F. Significance of eIF4E expression in skin squamous cell carcinoma. Cell Biol Int. 2007;31:1400-1404. [PubMed] |
| 9. | Mamane Y, Petroulakis E, Rong L, Yoshida K, Ler LW, Sonenberg N. eIF4E--from translation to transformation. Oncogene. 2004;23:3172-3179. [PubMed] |
| 10. | Culjkovic B, Topisirovic I, Skrabanek L, Ruiz-Gutierrez M, Borden KL. eIF4E is a central node of an RNA regulon that governs cellular proliferation. J Cell Biol. 2006;175:415-426. [PubMed] |
| 11. | Nathan CO, Sanders K, Abreo FW, Nassar R, Glass J. Correlation of p53 and the proto-oncogene eIF4E in larynx cancers: prognostic implications. Cancer Res. 2000;60:3599-3604. [PubMed] |
| 12. | Lan J, Xiong YY, Lin YX, Wang BC, Gong LL, Xu HS, Guo GS. Helicobacter pylori infection generated gastric cancer through p53-Rb tumor-suppressor system mutation and telomerase reactivation. World J Gastroenterol. 2003;9:54-58. [PubMed] |
| 13. | Jones RM, Branda J, Johnston KA, Polymenis M, Gadd M, Rustgi A, Callanan L, Schmidt EV. An essential E box in the promoter of the gene encoding the mRNA cap-binding protein (eukaryotic initiation factor 4E) is a target for activation by c-myc. Mol Cell Biol. 1996;16:4754-4764. [PubMed] |
| 14. | Richter JD, Sonenberg N. Regulation of cap-dependent translation by eIF4E inhibitory proteins. Nature. 2005;433:477-480. [PubMed] |
| 15. | Culjkovic B, Topisirovic I, Borden KL. Controlling gene expression through RNA regulons: the role of the eukaryotic translation initiation factor eIF4E. Cell Cycle. 2007;6:65-69. [PubMed] |
| 16. | Ruggero D, Montanaro L, Ma L, Xu W, Londei P, Cordon-Cardo C, Pandolfi PP. The translation factor eIF-4E promotes tumor formation and cooperates with c-Myc in lymphomagenesis. Nat Med. 2004;10:484-486. [PubMed] |
| 17. | Wolfort R, de Benedetti A, Nuthalapaty S, Yu H, Chu QD, Li BD. Up-regulation of TLK1B by eIF4E overexpression predicts cancer recurrence in irradiated patients with breast cancer. Surgery. 2006;140:161-169. [PubMed] |
| 18. | McClusky DR, Chu Q, Yu H, Debenedetti A, Johnson LW, Meschonat C, Turnage R, McDonald JC, Abreo F, Li BD. A prospective trial on initiation factor 4E (eIF4E) overexpression and cancer recurrence in node-positive breast cancer. Ann Surg. 2005;242:584-590; discussion 590-592. [PubMed] |
| 19. | Salehi Z, Mashayekhi F. Expression of the eukaryotic translation initiation factor 4E (eIF4E) and 4E-BP1 in esophageal cancer. Clin Biochem. 2006;39:404-409. [PubMed] |
| 20. | Larsson O, Li S, Issaenko OA, Avdulov S, Peterson M, Smith K, Bitterman PB, Polunovsky VA. Eukaryotic translation initiation factor 4E induced progression of primary human mammary epithelial cells along the cancer pathway is associated with targeted translational deregulation of oncogenic drivers and inhibitors. Cancer Res. 2007;67:6814-6824. [PubMed] |
| 21. | Byrnes K, White S, Chu Q, Meschonat C, Yu H, Johnson LW, Debenedetti A, Abreo F, Turnage RH, McDonald JC. High eIF4E, VEGF, and microvessel density in stage I to III breast cancer. Ann Surg. 2006;243:684-690; discussion 691-692. [PubMed] |
| 22. | Defatta RJ, De Benedetti A. Translational upregulation of yes accompanies eIF4E-mediated oncogenic transformation. Int J Oncol. 2003;23:1709-1713. [PubMed] |
| 23. | Kerekatte V, Smiley K, Hu B, Smith A, Gelder F, De Benedetti A. The proto-oncogene/translation factor eIF4E: a survey of its expression in breast carcinomas. Int J Cancer. 1995;64:27-31. [PubMed] |
| 24. | Li BD, Liu L, Dawson M, De Benedetti A. Overexpression of eukaryotic initiation factor 4E (eIF4E) in breast carcinoma. Cancer. 1997;79:2385-2390. [PubMed] |
| 25. | Bando H. Vascular endothelial growth factor and bevacitumab in breast cancer. Breast Cancer. 2007;14:163-173. [PubMed] |
| 26. | Lazăr D, Raica M, Sporea I, Tăban S, Goldiş A, Cornianu M. Cornianu M. Tumor angiogenesis in gastric cancer. Rom J Morphol Embryol. 2006;47:5-13. [PubMed] |
| 27. | Tashiro E, Tsuchiya A, Imoto M. Functions of cyclin D1 as an oncogene and regulation of cyclin D1 expression. Cancer Sci. 2007;98:629-635. [PubMed] |
| 28. | Musgrove EA. Cyclins: roles in mitogenic signaling and oncogenic transformation. Growth Factors. 2006;24:13-19. [PubMed] |
| 29. | Schmidt EV. The role of c-myc in regulation of translation initiation. Oncogene. 2004;23:3217-3121. [PubMed] |
| 30. | Graff JR, Zimmer SG. Translational control and metastatic progression: enhanced activity of the mRNA cap-binding protein eIF-4E selectively enhances translation of metastasis-related mRNAs. Clin Exp Metastasis. 2003;20:265-273. [PubMed] |