修回日期: 2008-02-19
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 观察沙漠干热环境下猪腹部肠管火器伤后肝细胞凋亡和肝脏功能的变化, 并探讨肝细胞凋亡和肝脏损害的关系.
方法: 沙漠干热环境组和常温环境组各健康长白仔猪42头随机等分为对照组和伤后1、2、4、8、12和24 h组, 实验组建立腹部肠管火器伤动物模型后, 采用TUNEL法观察肝细胞凋亡情况, 同时测定各时间点血清ALT水平.
结果: 伤后各组肝细胞凋亡指数明显高于对照组(沙漠干热环境: 21.18%±2.23%, 49.51%±4.18%, 42.61%±3.20%, 76.47%±3.64%, 72.26%±4.98%, 61.41%±3.98% vs 2.98%±0.74%, P<0.05; 常温环境: 60.37%±3.99%, 73.40%±2.93%, 48.97%±1.73%, 32.17%±1.50%, 42.92%±1.98%, 19.04%±0.72% vs 2.65%±0.37%, P<0.05), 并于伤后2 h出现第1个高峰, 沙漠干热环境组和常温环境组分别于伤后8 h和12 h出现第2个高峰; 血清ALT的变化趋势与肝细胞凋亡的趋势一致; 在沙漠干热环境和常温环境下, 肝细胞凋亡指数和ALT均呈正相关(r = 0.91, 0.93; 均P<0.01).
结论: 肝细胞凋亡在肝脏的损害过程中起重要作用, 干预肝细胞凋亡可能是腹部肠管火器伤后减少肝损伤的有效措施.
引文著录: 刘江伟, 张永久, 李泽信, 许永华, 姜文亭, 张东, 雷权. 沙漠干热环境下猪腹部肠管火器伤后肝细胞凋亡和肝功能变化. 世界华人消化杂志 2008; 16(11): 1228-1231
Revised: February 19, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the changes of hepato-cellular apoptosis and hepatic function in pigs with intestinal perforations due to abdominal firearm wound in dry-heat environment of desert, and to explore the correlation between hepatocellular apoptosis and liver injury.
METHODS: A total of 84 Chang-Bai piglets were divided equally into normal temperature environment group and dry-heat desert environment group. Each group was equally divided into 7 subgroups randomly: control group and wounded 1-, 2-, 4-, 8-, 12-, and 24-h groupa. A model of intestinal perforations due to abdominal firearm wound was established in wounded groups. Paraffin-embedded liver sections were assayed for apoptosis using terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate nick-end labeling (TUNEL) assay. Serum samples were analyzed for alanine aminotransferase (ALT) at the same time.
RESULTS: Hepatocellular apoptosis indexes in the wounded groups were significantly elevated as compared with those in the control group (dry-heat of desert: 21.18% ± 2.23%, 49.51% ± 4.18%, 42.61% ± 3.20%, 76.47% ± 3.64%, 72.26% ± 4.98%, 61.41% ± 3.98% vs 2.98% ± 0.74%, P < 0.05; normal temperature: 60.37% ± 3.99%, 73.40% ± 2.93%, 48.97% ± 1.73%, 32.17% ± 1.50%, 42.92% ± 1.98%, 19.04% ± 0.72% vs 2.65% ± 0.37%, P < 0.05). The first apoptosis peak appeared at 2 h in the wounded groups, while the second one appeared at 2 and 12 h in the dry-heat desert environment group and normal temperature group, respectively. The change of ALT level was just as the trend of apoptosis in both groups. Correlation analysis indicated that the apoptosis indexes were positively correlated with the level of ALT both in the dry-heat desert environment group and normal temperature group (r = 0.91, 0.93; both P < 0.01).
CONCLUSION: Pretreatment with anti-apoptosis agent under dry-heat environment of desert may be an effective measure for diminishing liver injury.
- Citation: Liu JW, Zhang YJ, Li ZX, Xu YH, Jiang WT, Zhang D, Lei Q. Changes of hepatocellular apoptosis and hepatic function in pigs with intestinal perforations due to abdominal firearm wound in dry-heat desert environment. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1228-1231
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1228.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1228
腹部火器伤创伤机制的研究较少, 沙漠干热环境下腹部火器伤的研究尚属国际研究领域的空白. 腹部火器伤具有肠穿孔率高、多脏器功能失调综合征(multiorgan dysfunction syndrome, MODS)发生率高的特点, 肠道是机体最大的细菌及毒素储库, 是MODS的始动器官[1]. 炎症过程的失调和细胞凋亡在脓毒症介导的各器官功能损害过程中起重要作用[2]. 本研究在先前建立的沙漠干热环境腹部火器伤动物模型的基础上[3], 动态观察伤后肝细胞凋亡和肝脏功能的变化, 并对其变化规律进行探讨, 为沙漠干热环境腹部火器伤创伤机制的研究奠定基础.
选用中国人民解放军63650部队提供的健康长白仔猪84头, 2-3 mo龄, 体质量27-33 kg, 雌雄不限, 随机分为沙漠干热组和常温组, 每组均为42头, 每组又随机等分为对照组、伤后1、2、4、8、12和24 h组7个亚组. 沙漠干热环境组实验场地位于新疆塔克拉玛干沙漠边缘, 时间在最热的7 mo下旬到8 mo初, 实验从中午12:00开始, 沙漠干热组实验动物在沙漠干热环境下预热3 h后致伤, 平均气温41.2℃±0.9℃, 平均相对湿度22.3%±1.3%, 辐射热强度>4.184 J/(cm2•min); 常温组实验动物在常温环境下致伤, 常温及实验室环境: 平均温度23.7℃±0.4℃, 平均相对湿度55.6%±1.4%. 沙漠干热组和常温组动物在致伤后15 min内转移到实验室进行观察.
1.2.1 腹部火器伤模型: 参照文献[3]的方法建立腹部肠管火器伤模型, 并切取肝组织, 常规甲醛固定, 石蜡包埋肝组织. 沙漠干热组和常温组中的对照组除不致伤外, 其余步骤与实验相同, 并作为0 h组进行各项指标检测.
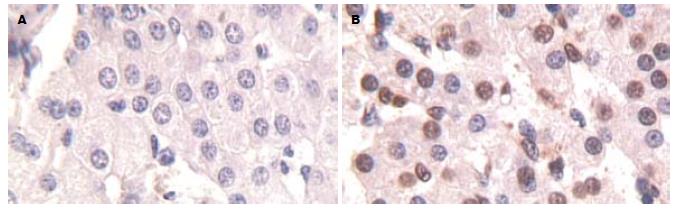
1.2.2 细胞凋亡的原位检测: 将肝组织切片按TUNEL试剂盒(福建迈新公司)提供的方法进行检测, 随机选取5个不重叠的高倍镜视野(×400)BI-2000医学图像分析系统分别拍照. 计算5个高倍视野下的凋亡细胞数, 用5个高倍视野下的凋亡细胞总数除以细胞总数来计算凋亡指数, 凋亡指数以凋亡细胞数/100个细胞表示.
1.2.3 血清肝生化测定: 实验各组分别于伤后1、2、4、8、12和24 h各时间点抽取猪耳缘静脉血, 对照组回实验室后立即抽血, 静置30 min后离心, 东芝全自动生化分析仪(TBA-40FR)测血清中ALT水平.
统计学处理 实验数据以mean±SD表示, 用SPSS11.5行单因素方差分析, LDS-t检验进行两两比较, 两变量相关分析用Pearson直线相关分析.
常温组中伤后1 h组、2 h组、4 h组、12 h组动物全部存活, 伤后8 h组、24 h组各死亡1头; 干热组中2 h组、4 h组、8 h组、24 h组各死亡1头, 12 h组死亡2头.
凋亡细胞以肝细胞为主, 也有少量枯否细胞和血管内皮细胞(图1), 阳性细胞胞核为棕色. 伤后各组肝细胞凋亡指数均较对照组有明显增加(P<0.05), 沙漠环境组除8 h和12 h之间无显著性差异外, 其余各时间点及常温环境各组的细胞凋亡指数均与前一时间点之间有显著差异(P<0.05); 各实验组在相应的时间点, 沙漠环境组的细胞凋亡指数明显高于常温环境组(P<0.05); 沙漠环境组和常温环境组的细胞凋亡指数均在2 h出现第1个峰值, 第2个峰值分别出现在第8 h和12 h, 第2个峰值均>第1个峰值(P<0.05, 表1).
| 分组 | 细胞凋亡指数(%) | ALT(U/L) | ||
| 沙漠干热环境 | 常温环境 | 沙漠干热环境 | 常温环境 | |
| 对照组 | 2.98±0.74 | 2.65±0.37 | 49.62±3.82 | 48.00±0.97 |
| 1 h组 | 21.18±2.23ac | 19.04±0.72 | 71.54±3.32ac | 63.00±1.25 |
| 2 h组 | 49.51±4.18ac | 42.92±1.98 | 110.34±12.38c | 99.20±3.27 |
| 4 h组 | 42.61±3.20ac | 32.17±1.50 | 94.05±6.03ac | 68.75±2.18 |
| 8 h组 | 76.47±3.64ac | 48.97±1.73 | 141.57±3.93ac | 80.96±1.11 |
| 12 h组 | 72.26±4.98a | 73.40±2.93 | 129.32±5.36c | 133.07±5.99 |
| 24 h组 | 61.41±3.98ac | 60.37±3.99 | 104.07±5.33c | 105.56±3.41 |
干热环境实验组和常温环境实验组在伤后各时间点ALT均高于对照组(P<0.05); 各实验组的细胞凋亡指数均与前一时间点之间有显著差异(P<0.05); 沙漠环境组的ALT在1、4、8 h均明显高于常温环境组(P<0.05); 沙漠环境组和常温环境组的ALT均在2 h出现第1个峰值, 第2个峰值分别出现在第8 h和12 h, 第2个峰值均>第1个峰值(P<0.05, 表1).
Pearson直线相关分析表明, 沙漠干热环境和常温环境下, 细胞凋亡率和ALT均呈正相关, 相关系数分别为0.91和0.93(P<0.01).
我们的研究发现, 在常温环境和沙漠干热环境下腹部火器伤肠管穿透后猪肝细胞凋亡率迅速增高, 并于伤后2 h达到第1个高峰值, 沙漠干热环境组的第2个肝细胞凋亡高峰出现在8 h组, 而常温环境组第2个肝细胞凋亡高峰出现在12 h组, ALT是反映肝功能损害的经典指标, 我们研究发现, ALT的变化趋势与肝细胞凋亡趋势一致, 表明腹部肠管火器伤后肝细胞凋亡可能是造成肝功能损害的主要原因. 近年来的研究认为肝细胞凋亡是肝功能衰竭的重要分子生物学机制[4]. 脓毒症的发生与肝细胞凋亡密切相关: Eipel et al[5]研究发现, LPS-相关的细胞凋亡可能起因于黏附在肝脏的血小板和白细胞等, 这些循环细胞可能在维持细胞间的炎症反应过程中起重要作用. 抑制p38 MAPK活性可减少内毒素诱导的白细胞浸润和肝细胞凋亡, 认为干预p38 MAPK通路可能成为脓毒症性肝损害的治疗策略[6]. Ashare et al[7]认为脓毒症的发展过程可伴随肝脏对细菌清除能力的降低, 应用凋亡的终末效应因子caspase的抑制剂可保持肝脏对细菌的清除力. Fas/Fas配体系统是激发凋亡的主要通路之一, 其在器官损害过程中起重要作用, 抑制Fas/Fas配体通路可能成为脓毒症过程中保持器官灌注并避免肝损害的新治疗模式[8].
本研究发现在干热环境下腹部肠管火器伤后肝细胞凋亡和肝功能受损较常温组严重并且在发生时间上提前, 表明沙漠干热环境可促进肝细胞凋亡和肝功能损害. Park et al[9]研究认为严重的热应激可诱导细胞周期停滞和凋亡. 热应激可增加细胞对某些凋亡刺激因子如TNF-α的敏感性, 从而促进细胞凋亡[10]. 除莠霉素A(Herbimycin A)是一种酪氨酸激酶抑制剂, 可诱导热休克蛋白(HSPs), 将Herbimycin A作用于热应激大鼠可明显减少肝细胞凋亡, 并降低caspase-3活性, 可有效提高大鼠对热的耐受性, 因而减少大鼠因热应激带来的器官功能损害[11].
沙漠干热环境和常温环境腹部火器伤后由于枪伤应激、肠屏障受损以及子弹的远达效应导致了肝细胞凋亡和肝脏的急性损伤, 使细胞凋亡率和ALT在2 h时迅速达第1个峰值. 第2个峰值产生的原因可能是在原来急性创伤的基础上由于肠穿孔所致腹腔感染导致了脓毒症, 大量LPS经门静脉入血, 沙漠干热环境组峰值提前, 可能是由于在高热环境的热应激状态下, 细菌繁殖和生长加快, 热应激诱导的细胞凋亡使肝脏对细菌的清除率下降, 更加速了脓毒症的发生和LPS的入血. 然而伤后24 h时, 肝细胞凋亡和ALT有所下降, 可能是由于抗炎症反应或抗细胞凋亡因子被充分激活所致[12], 或可能与肝细胞膜开始修复有关. 由于肝损伤机制的复杂性使ALT在伤后24 h内有波动, 但仍为升高趋势, 与肝脏组织结构损伤的逐渐加重趋势基本一致[13].
尽管沙漠干热环境腹部火器伤肠管穿透后继发性肝损伤的发生机制有待进一步研究, 但本研究提示肝细胞凋亡在肝脏的损害过程中起重要作用, 提示在沙漠干热环境下干预肝细胞凋亡可能是腹部肠管火器伤后减少肝损伤, 进而减少全身炎症反应、防止脓毒症和多器官功能衰竭发生的有效措施.
腹部火器伤具有肠穿孔率高、多脏器功能失调综合征(MODS)发生率高的特点, 肠道是机体最大的细菌及毒素储库, 是MODS的始动器官. 炎症过程的失调和细胞凋亡在脓毒症介导的各器官功能损害过程中起重要作用. 本文在沙漠环境腹部肠管火器伤动物模型的基础上, 重点对伤后肝细胞凋亡和肝功能变化的规律进行探讨.
范学工, 教授, 中南大学湘雅医院感染病科
腹部火器伤创伤机制的研究较少, 沙漠干热环境下腹部火器伤的研究尚属国际研究领域的空白.
本研究为沙漠干热环境腹部火器伤创伤机制的研究奠定基础.
本研究为沙漠干热环境腹部火器伤创伤机制的研究奠定基础.
本文对特殊情况下的肝细胞调亡和肝损伤进行了观察, 有一定的实用意义. 但干热本身对肝组织亦可以有损伤作用, 故应有干热相应时间的无损伤对照组. 鉴于内容较少, 但有其特殊意义, 建议短文发表.
编辑: 程剑侠 电编:郭海丽
| 2. | Gallos G, Ruyle TD, Emala CW, Lee HT. A1 adenosine receptor knockout mice exhibit increased mortality, renal dysfunction, and hepatic injury in murine septic peritonitis. Am J Physiol Renal Physiol. 2005;289:F369-F376. [PubMed] |
| 4. | Togo S, Kubota T, Matsuo K, Shimizu T, Momiyama N, Takeda K, Tanaka K, Endo I, Sekido H, Shimada H. Mechanism of liver failure after hepatectomy. Nippon Geka Gakkai Zasshi. 2004;105:658-663. [PubMed] |
| 5. | Eipel C, Bordel R, Nickels RM, Menger MD, Vollmar B. Impact of leukocytes and platelets in mediating hepatocyte apoptosis in a rat model of systemic endotoxemia. Am J Physiol Gastrointest Liver Physiol. 2004;286:G769-G776. [PubMed] |
| 6. | Klintman D, Li X, Santen S, Schramm R, Jeppsson B, Thorlacius H. p38 mitogen-activated protein kinase-dependent chemokine production, leukocyte recruitment, and hepatocellular apoptosis in endotoxemic liver injury. Ann Surg. 2005;242:830-838, discussion 838-839. [PubMed] |
| 7. | Ashare A, Monick MM, Powers LS, Yarovinsky T, Hunninghake GW. Severe bacteremia results in a loss of hepatic bacterial clearance. Am J Respir Crit Care Med. 2006;173:644-652. [PubMed] |
| 8. | Chung CS, Yang S, Song GY, Lomas J, Wang P, Simms HH, Chaudry IH, Ayala A. Inhibition of Fas signaling prevents hepatic injury and improves organ blood flow during sepsis. Surgery. 2001;130:339-345. [PubMed] |
| 9. | Park HG, Han SI, Oh SY, Kang HS. Cellular responses to mild heat stress. Cell Mol Life Sci. 2005;62:10-23. [PubMed] |
| 10. | Imao M, Nagaki M, Moriwaki H. Dual effects of heat stress on tumor necrosis factor-alpha-induced hepatocyte apoptosis in mice. Lab Invest. 2006;86:959-967. [PubMed] |
| 11. | Sachidhanandam SB, Lu J, Low KS, Moochhala SM. Herbimycin A attenuates apoptosis during heat stress in rats. Eur J Pharmacol. 2003;474:121-128. [PubMed] |
| 12. | Thirunavukkarasu C, Uemura T, Wang LF, Watkins SC, Gandhi CR. Normal rat hepatic stellate cells respond to endotoxin in LBP-independent manner to produce inhibitor(s) of DNA synthesis in hepatocytes. J Cell Physiol. 2005;204:654-665. [PubMed] |