修回日期: 2008-03-09
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 探讨内皮素-1(endothelin-1, ET-1)、一氧化氮(nitric oxide, NO)、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)在大鼠肝肺综合征(hepatopulmonary syndrome, HPS)发病机制中的作用.
方法: 健康Wistar大鼠32只随机平均分为假手术组、CBDL术后3 wk组、4 wk组、5 wk组. 采用胆总管结扎(common bile duct ligation, CBDL)术制备大鼠HPS模型成功后, 行肝功能及肝肺病理检查. 放射免疫分析法检测大鼠血浆和肝组织、肺组织匀浆中ET-1和CGRP的水平, 利用硝酸还原酶法检测大鼠血清和肝、肺组织匀浆中NO的水平.
结果: 在大鼠HPS形成过程中, 肝细胞变性、坏死, 大量纤维组织增生, 形成假小叶. 肺泡毛细血管增生、扩张, 伴肺泡间隔增宽、容量减小. 术后3-5 wk, CBDL组大鼠血浆和肝、肺组织匀浆中ET-1、NO、CGRP水平显著升高, 且与 ALT水平呈正相关(血浆, ET-1: r = 0.9889, P = 0.0111; NO: r = 0.9935, P = 0.0065; CGRP: r = 0.9714, P = 0.0286; 肝组织: r = 0.9969, P = 0.0035; r = 0.9993, P = 0.0070; r = 0.9507, P = 0.0493; 肺组织: r = 0.9939, P = 0.0061; r = 0.9991, P = 0.0009; r = 0.9557, P = 0.0443).
结论: 在大鼠HPS形成过程中, 血浆和肝、肺组织匀浆中ET-1, NO和CGRP水平持续升高, 提示血管活性物质ET-1, NO和CGRP在其发病机制中可能起着一定作用.
引文著录: 颜玉, 鲍秀琦, 王艳, 遇常红, 韩桂华, 姜威. 血管活性物质在大鼠肝肺综合征发病机制中的作用. 世界华人消化杂志 2008; 16(10): 1053-1058
Revised: March 9, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To explore the roles of endothelin-1 (ET-1), nitric oxide (NO) and calcitonin gene-related peptide (CGRP) in the pathogenesis of hepatopulmonary syndrome (HPS) in rats.
METHODS: Thirty-two male Wistar rats were randomly and averagely divided into 4 groups: sham operation group, common bile duct ligation (CBDL) 3-wk group, CBDL 4-wk group and CBDL 5-wk group. HPS model was induced by CBDL. Liver function and pathological changes of liver and lung were observed. The concentrations of ET-1 and CGRP in plasma, liver and lung tissues were detected by radioimmunoassay (RIA) and the NO content in serum, liver and lung tissues was measured with nitrate reductase method.
RESULTS: During the pathogenesis of HPS, liver was damaged with inflammation and fibrous hyperplasia. Fibrosis caused the formation of false lobules. Lung structural alterations such as alveolar capillary dilation and angiogenesis, thickened alveolar septa and decreased alveolar capacity were observed. The levels of ET-1, NO and CGRP in plasma, liver and lung tissues were gradually increased from the 3rd to 5th wk after CBDL, which were positively correlated with alanine aminotransferase level (plasma, ET-1: r = 0.9889, P = 0.0111; NO: r = 0.9935, P = 0065; CGRP: r = 0.9714, P = 0.0286; liver tissue: r = 0.9969, P = 0.0035; r = 0.9993, P = 0.0070; r = 0.9507, P = 0.0493; lung tissue: r = 0.9939, P = 0.0061; r = 0.9991, P = 0.0009; r = 0.9557, P = 0.0443).
CONCLUSION: The levels of ET-1, NO and CGRP in plasma, liver and lung are increased markedly during the process of HPS formation, suggesting that vascular mediators such as ET-1, NO and CGRP may play important roles in the pathogenesis of HPS.
- Citation: Yan Y, Bao XQ, Wang Y, Yu CH, Han GH, Jiang W. Roles of vascular mediators in the pathogenesis of hepatopulmonary syndrome in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1053-1058
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1053.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1053
肝肺综合征(hepatopulmonary syndrome, HPS)是一个临床三联征[1], 即: 慢性肝病、肺血管扩张和低氧血症. 近年来血管活性物质在HPS发病机制中的作用已成为研究的热点[2]. 我们研究HPS大鼠血浆、肝组织、肺组织中血管活性物质内皮素-1(endothelin-1, ET-1)、一氧化氮(nitric oxide, NO)、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)变化与肝功能检测之间的关系, 探讨血管活性物质在HPS发病机制中的作用.
♂Wistar大鼠32只, 体质量200-250 g, 购自佳木斯大学实验动物中心. 所有大鼠在通风、湿度温度适宜的动物室内常规均饲养. ET-1放免试剂盒, CGRP放免试剂盒购自北京福瑞生物工程公司. NO试剂盒, ALT试剂盒, TBIL试剂盒购自南京建成生物工程研究所, XH-6020型γ免疫计数器, 22PC型分光光度仪, DY89-1电动玻璃匀浆机, LXJ-II型自动高速离心机等.
健康Wistar大鼠32只, 随机分为4组, 每组8只, 假手术(sham operation, Sham)组、胆总管结扎术CBDL(common bile duct ligation, CBDL)术后3 wk组(CBDL3 wk)、术后4 wk组(CBDL 4 wk)、术后5 wk组(CBDL 5 wk). 模型的制作参照文献[3-4]并略加改进. 以30 g/L戊巴比妥钠4 mL/kg ip麻醉, Sham组大鼠沿腹白线开腹后, 分离胆总管, 不结扎即关腹; CBDL组用4号丝线分别在近肝门处和近十二指肠端双线结扎胆总管后, 从中段剪断胆总管. 术后3 d按2 MU/kg体质量im青霉素以抗感染. 分别于术后3、4、5 wk各处理一组动物. 血清ALT水平采用赖氏法测定, TBIL水平采用苯甲酸钠-咖啡因比色法测定. 剪取部分新鲜肝组织和肺组织于40 g/L甲醛固定, 1 wk后经过脱水、透明、石蜡包埋、切片、HE染色后光学显微镜观察其病理变化.
1.2.1 血浆及肝肺组织ET-1和CGRP测定: 所有动物于相应时间点以100 mL/L水合氯醛麻醉, 开胸心脏穿刺取静脉血6 mL, 取其中4 mL注入含100 mL/L EDTA-2Na 30 μL和333.4 nkat/L抑肽酶40 μL的试管中, 混匀, 低温离心机4℃, 3000 r/min离心15 min, 分离血浆, 分装2份, 置-70℃低温冰箱保存, 待测ET-1值和CGRP值. 同时制备肝、肺组织匀浆, 取其上清液待测ET-1值和CGRP值. 严格按说明书操作.
1.2.2 血清及肝肺组织NO测定: 取另静脉血2 mL, 不加抗凝剂, 静置10 min, 低温离心机4℃, 3500 r/min离心15 min, 分离上层血清, 置-70℃低温冰箱保存, 待测NO值. NO化学性质活泼, 在体内代谢很快转为NO2-和NO3-, 而NO2-又进一步转化为NO3-, 本法利用硝酸还原酶特异性将NO2-还原为NO3-, 通过显色深浅测定其浓度的高低.
统计学处理 实验数据以mean±SD表示, 采用SPSS10.0统计软件处理, 用q检验法分析, P<0.05为差异有统计学意义.
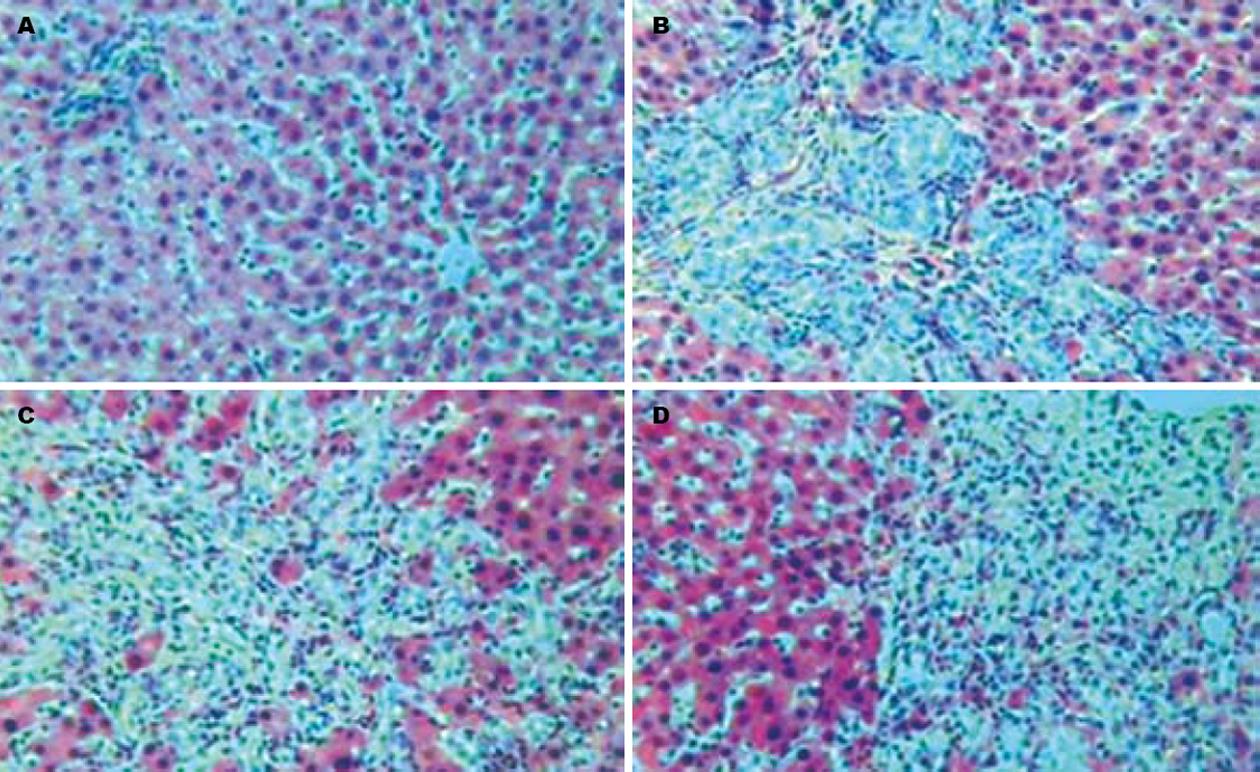
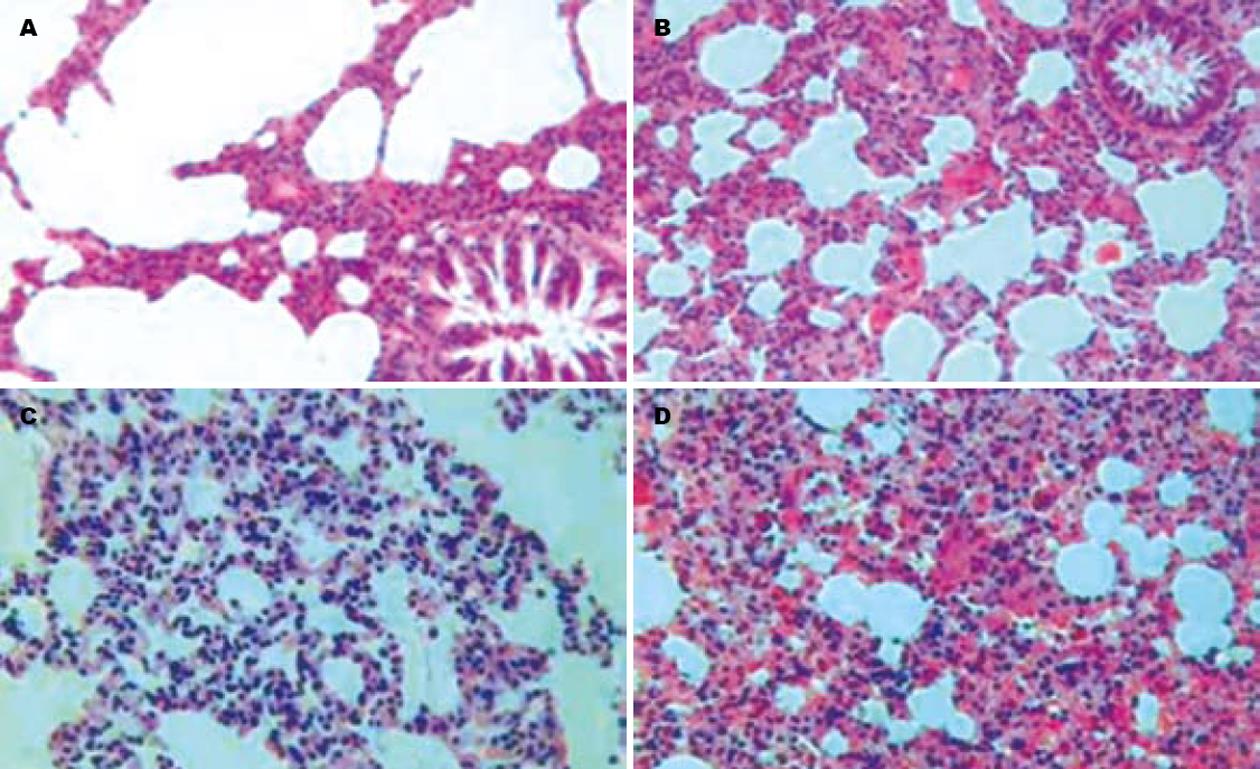
Sham组与术前相比无明显变化, 进食、活动、大小便均正常, 无死亡. CBDL组于术后逐渐出现皮肤黏膜黄染, 精神萎靡, 嗜睡, 反应迟钝, 活动明显减少, 食欲减退, 体质量下降, 尿色加深, 大便呈灰白色. CBDL术后4 wk组及术后5 wk组各死亡1只. 大鼠HPS形成过程中, 肝脏质地逐渐变硬. 光镜下肝细胞变性、坏死、伴炎症细胞浸润及小胆管样上皮细胞增殖改变, 肝小叶结构完全破坏, 大量纤维组织增生, 形成假小叶. 随着时间的推移, 病理学改变更加明显. 而Sham组大鼠肝细胞形态完整, 肝细胞索呈放射状, 肝小叶结构完整, 细胞核正常(图1). 各组大鼠肺大体均无明显变化, 光镜下所有大鼠肺泡细胞无变性坏死, 肺泡壁无塌陷, 肺泡形态正常, 无炎性细胞浸润、间质水肿、纤维组织增生和透明膜形成. 主要改变为肺泡毛细血管增生、扩张, 伴肺泡间隔增宽、容量减小. 随着时间推移, 肺泡毛细血管增生、扩张明显, 肺泡壁增厚更加明显, 肺泡间隔增宽, 肺泡腔容量明显减小(图2). 从术后wk 3起, 由于胆汁淤积, CBDL组大鼠血清TBIL迅速升高, 并引起肝细胞损害, 血清ALT升高(表1).
与Sham组相比, CBDL组大鼠血浆和肝、肺组织中ET-1, NO和CGRP水平改变均有显著性差异(表2-4).
大鼠HPS形成过程中, 血浆和肝、肺组织匀浆中ET-1, NO, CGRP水平逐渐升高, CBDL组大鼠术后3-5 wk肝功能损害逐渐加重(表5-6). 血浆和肝、肺组织匀浆中ET-1, NO, CGRP水平均与ALT水平成正相关. 血浆和肝、肺组织匀浆中NO水平均与TBIL水平成正相关; 肝、肺组织匀浆中ET-1, CGRP水平与TBIL水平亦成正相关, 而血浆中ET-1, CGRP水平与TBIL水平无直线相关性. CBDL 4、5 wk组共有7只动物出现腹水. 提示ET-1, NO, CGRP可能与肝功能受损状态及腹水形成有关.
HPS是指肝功能不全引起肺血管扩张, 肺气体交换障碍导致的低氧血征及其一系列的病理生理变化和临床表现[5,6]. 临床多表现为慢性肝病、肺内血管扩张(intrapulmonary vasodilatation, IPVD)和低氧血症, IPVD是低氧血症的病理生理基础[7]. 有学者推测, 各种慢性肝脏疾病时由于门、体分流或肝细胞功能受损, 某些血管活性物质在肝脏灭活减少或产生增多, 通过血循环到达肺, 肺内扩血管物质与缩血管物质之间作用失衡, 可能是HPS的发病机制之一[8-11].
ET-1是一种具有很强缩血管作用的多肽[12-13], 在肝脏合成, ET-1受体在肝内广泛分布[14]. 他的受体(ETR)有两种亚型, 即ETRA和ETRB. ET-1与ETRA和ETRB结合均可导致血管收缩, 但ET-1还可通过与ETRB结合, 释放由内皮细胞衍生的扩血管物质NO而引起血管扩张[15]. ET-1能够诱导激活的HSC产生收缩反应, 使得肝血窦直径缩小, 导致肝脏发生缺血缺氧性损害[16-17], 同时增加肝内血流阻力, 造成门脉高压[18]. NO是通过升高环磷酸鸟苷水平来介导肺血管扩张的[19]. NO是由NOS以L-精氨酸为底物催化而成, NOS共有两种亚型: 诱导型(iNOS)和内皮型(eNOS), 其中iNOS在细胞因子或内毒素的刺激下呈诱导性表达. 慢性肝病时, 大量内毒素及细胞因子可激活iNOS, 导致局部或全身的NO水平升高[20-21]. Luo et al实验都发现, 经胆总管结扎造成的肝硬化大鼠模型血浆ET-1水平和肺组织NO同步增高, 而且有肺内血管扩张的证据[22-23]. CGRP是一种强烈的舒血管活性肽, 对外周血管有强烈的扩张作用[24]. 在肝硬化中, CGRP的升高可能造成循环高动力状况[25-26], 使内脏血流量增多, 门静脉压力上升. Møller et al发现肝硬化者CGRP升高可以引起外周血管扩张和血容量异常分布, 导致水钠潴留[27-28].
本结果表明, 大鼠胆总管结扎术后, ALT, TBIL值随胆总管结扎时间延长而逐渐增高. 大鼠HPS形成过程中随着肝细胞受损逐渐加重, 血浆和肝、肺组织匀浆中ET-1, NO, CGRP水平逐渐升高. 分析结果显示, HPS大鼠血浆和肝、肺组织匀浆中ET-1, NO, CGRP水平与ALT, TBIL值呈显著正相关, 提示这3种血管活性物质升高可能与肝功能减退、肝脏灭活减少、继发性高浓度内毒素血症等有关. 我们发现, HPS大鼠肺组织匀浆中ET-1含量异常增多, 推测两种不同亚型的ET-1受体在HPS大鼠肺血管组织中的这种变化可能与HPS大鼠有关, ET-1在大鼠肺血管的总体反应可能由于ETRB表达的增高而表现为扩张. 因此, 肺组织中升高的ET-1可能更多地通过与肺血管尤其是小血管内皮细胞表达增强的ETRB结合从而扩张肺血管. 我们采用硝酸还原酶法测定血浆和肝、肺组织匀浆中NO2-/NO3-浓度间接反映NO产生的水平. HPS大鼠肺组织匀浆中NO含量异常增多, 推测与NOS亚型表达变化有关. 多数研究表明, 肝硬化门脉高压时内脏血管eNOS表达增强[29-30], HPS时肺血管NOS亚型表达的变化与肝硬化内脏血管NOS亚型表达的变化是一致的, 这体现了HPS是肝硬化门脉高压全身血管病变中的肺部表现. 本研究中大鼠血浆CGRP与ET-1水平之间呈现明显正相关, 故从CGRP和ET-1相互的拮抗效应, 我们推测, CGRP升高亦可能系机体对ET-1、NO及其他致病因子致肝功能异常的一种保护/拮抗反应. 在HPS形成过程中, 这三种血管活性物质体液因素间的平衡紊乱可能具有重要的发病学意义.
总之, 在正常生理情况下, ET-1, NO与CGRP保持相对的平衡, 而大鼠血浆和肝组织、肺组织匀浆中ET-1, NO, CGRP水平反映了HPS的严重程度, 三者间平衡紊乱可能在肝脏HPS的病理生理过程中具有重要意义.
随着肝移植治疗肝肺综合征(HPS)的成功, 人们对HPS的发病机制进行了大量的研究. 本研究通过HPS大鼠血浆、肝组织、肺组织中血管活性物质内皮素-1(ET-1)、一氧化氮(NO)、降钙素基因相关肽(CGRP)检测, 探讨了血管活性物质在HPS发病机制中的作用.
黄晓东, 副主任医师, 武汉市中心医院消化内科
血管活性物质在HPS发病机制中的作用成为此领域研究的热点.
有学者推测, 各种慢性肝脏疾病时由于门、体分流或肝细胞功能受损, 某些血管活性物质在肝脏灭活减少或产生增多, 通过血循环到达肺, 肺内扩血管物质与缩血管物质之间作用失衡, 可能是HPS的发病机制之一.
本研究结果表明血管活性物质ET-1、NO、CGRP可能在HPS发病机制中起作用.
肝肺综合征: 是一个临床三联征, 即严重肝病、肺血管扩张和低氧血症. 此病的主要特征是发病率高, 动脉血氧分压降低, 低氧血症呈慢性发展, 治疗困难, 远期预后不良.
本文实验设计合理可靠, 结论明确, 实验证据充足, 探讨条理分明, 有较系统的理论分析和有价值的科学结论, 文章的科学性和可读性均能较好的反映我国肝病学临床研究的先进水平.
编辑: 潘伯荣 电编:何基才
| 1. | Scott VL, Dodson SF, Kang Y. The hepatopulmonary syndrome. Surg Clin North Am. 1999;79:23-41, vii. [PubMed] [DOI] |
| 5. | Krowka MJ. Caveats concerning hepatopulmonary syndrome. J Hepatol. 2001;34:756-758. [PubMed] [DOI] |
| 7. | Hervé P, Lebrec D, Brenot F, Simonneau G, Humbert M, Sitbon O, Duroux P. Pulmonary vascular disorders in portal hypertension. Eur Respir J. 1998;11:1153-1166. [PubMed] [DOI] |
| 9. | Wang YW, Lin HC. Recent advances in hepatopulmonary syndrome. J Chin Med Assoc. 2005;68:500-505. [PubMed] [DOI] |
| 10. | Halank M, Miehlke S, Kolditz M, Hoeffken G. Portopulmonary hypertension. Z Gastroenterol. 2005;43:677-685. [PubMed] [DOI] |
| 11. | Milani A, Basso M, Fiorini A, Pardeo M, Romano C. Hepato-pulmonary syndrome and porto-pulmonary hypertension. Nosologic features and etiopathogenic considerations. Recenti Prog Med. 2001;92:158-163. [PubMed] |
| 12. | Yanagisawa M, Kurihara H, Kimura S, Goto K, Masaki T. A novel peptide vasoconstrictor, endothelin, is produced by vascular endothelium and modulates smooth muscle Ca2+ channels. J Hypertens Suppl. 1988;6:S188-S191. [PubMed] [DOI] |
| 13. | Simonson MS, Dunn MJ. Endothelins: a family of regulatory peptides. State-of-the-art lecture. Hypertension. 1991;17:856-863. [PubMed] [DOI] |
| 14. | Møller S, Henriksen JH. Endothelins in chronic liver disease. Scand J Clin Lab Invest. 1996;56:481-490. [PubMed] [DOI] |
| 15. | Chan CC, Wang SS, Lee FY, Chang FY, Lin HC, Chu CJ, Chen CT, Huang HC, Lee SD. Endothelin-1 induces vasoconstriction on portal-systemic collaterals of portal hypertensive rats. Hepatology. 2001;33:816-820. [PubMed] [DOI] |
| 16. | Pinzani M, Milani S, De Franco R, Grappone C, Caligiuri A, Gentilini A, Tosti-Guerra C, Maggi M, Failli P, Ruocco C. Endothelin 1 is overexpressed in human cirrhotic liver and exerts multiple effects on activated hepatic stellate cells. Gastroenterology. 1996;110:534-548. [PubMed] [DOI] |
| 17. | Goto M, Takei Y, Kawano S, Nagano K, Tsuji S, Masuda E, Nishimura Y, Okumura S, Kashiwagi T, Fusamoto H. Endothelin-1 is involved in the pathogenesis of ischemia/reperfusion liver injury by hepatic microcirculatory disturbances. Hepatology. 1994;19:675-681. [PubMed] [DOI] |
| 18. | Rockey DC, Weisiger RA. Endothelin induced contractility of stellate cells from normal and cirrhotic rat liver: implications for regulation of portal pressure and resistance. Hepatology. 1996;24:233-240. [PubMed] [DOI] |
| 19. | Rolla G. Hepatopulmonary syndrome: role of nitric oxide and clinical aspects. Dig Liver Dis. 2004;36:303-308. [PubMed] [DOI] |
| 20. | Rolla G, Brussino L, Colagrande P, Scappaticci E, Morello M, Bergerone S, Ottobrelli A, Cerutti E, Polizzi S, Bucca C. Exhaled nitric oxide and impaired oxygenation in cirrhotic patients before and after liver transplantation. Ann Intern Med. 1998;129:375-378. [PubMed] [DOI] |
| 21. | Zhang HY, Han DW, Wang XG, Zhao YC, Zhou X, Zhao HZ. Experimental study on the role of endotoxin in the development of hepatopulmonary syndrome. World J Gastroenterol. 2005;11:567-572. [PubMed] [DOI] |
| 22. | Luo B, Abrams GA, Fallon MB. Endothelin-1 in the rat bile duct ligation model of hepatopulmonary syndrome: correlation with pulmonary dysfunction. J Hepatol. 1998;29:571-578. [PubMed] [DOI] |
| 23. | Fallon MB, Abrams GA, Luo B, Hou Z, Dai J, Ku DD. The role of endothelial nitric oxide synthase in the pathogenesis of a rat model of hepatopulmonary syndrome. Gastroenterology. 1997;113:606-614. [PubMed] [DOI] |
| 24. | Strauss GI, Edvinsson L, Larsen FS, Møller K, Knudsen GM. Circulating levels of neuropeptides (CGRP, VIP, NPY) in patients with fulminant hepatic failure. Neuropeptides. 2001;35:174-180. [PubMed] [DOI] |
| 25. | Bendtsen F, Schifter S, Henriksen JH. Increased circulating calcitonin gene-related peptide (CGRP) in cirrhosis. J Hepatol. 1991;12:118-123. [PubMed] [DOI] |
| 26. | Henriksen JH, Schifter S, Møller S, Bendtsen F. Increased circulating calcitonin in cirrhosis. Relation to severity of disease and calcitonin gene-related peptide. Metabolism. 2000;49:47-52. [PubMed] [DOI] |
| 27. | Møller S, Bendtsen F, Schifter S, Henriksen JH. Relation of calcitonin gene-related peptide to systemic vasodilatation and central hypovolaemia in cirrhosis. Scand J Gastroenterol. 1996;31:928-933. [PubMed] [DOI] |
| 28. | Henriksen JH, Møller S. Hypertension and liver disease. Curr Hypertens Rep. 2004;6:453-461. [PubMed] [DOI] |
| 29. | Robert V, Chabot F, Vial B, Guiot P, Poussel JF, Polu JM. Hepatopulmonary syndrome: physiopathology of impaired gas exchange. Rev Mal Respir. 1999;16:769-779. [PubMed] |
| 30. | Schroeder RA, Ewing CA, Sitzmann JV, Kuo PC. Pulmonary expression of iNOS and HO-1 protein is upregulated in a rat model of prehepatic portal hypertension. Dig Dis Sci. 2000;45:2405-2410. [PubMed] [DOI] |