修回日期: 2008-03-06
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 研究扶正化瘀方对肝硬化门静脉高压的影响.
方法: 以5 g/L的二甲基亚硝胺(DMN)ip 4 wk建立大鼠肝硬化的动物模型, 中药治疗3 wk后, 肠系膜上静脉插管测定门静脉压力, 测定肝组织中羟脯氨酸(Hyp)和内皮素(ET-1)的含量, 测定血清丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)活性和白蛋白(ALB)和总胆红素(TBIL)含量, 观察肝组织病理形态的变化.
结果: 模型组大鼠门静脉压力显著升高, 升高幅度为正常组的2.4倍; 肝组织ET-1含量较正常大鼠增加明显(344.48±71.42 pg/mg vs 247.00±49.51 pg/mg, P<0.01); 肝硬化大鼠此2项指标呈显著正相关(r = 0.675, P<0.01). 而经扶正化瘀方治疗的大鼠, 门静脉压力较模型组下降约67%(P<0.01), ET-1含量为292.13±52.07 pg/mg(P<0.05). 治疗组大鼠血清ALT、AST、TBIL水平及肝组织Hyp和ET-1含量与模型组比较也都有显著下降, 病理观察显示治疗组大鼠肝脏结构基本恢复正常.
结论: 肝硬化时大鼠门静脉压力升高与肝组织ET-1含量的增高呈正相关, 扶正化瘀方通过抗肝纤维化显著降低肝硬化模型大鼠升高的肝组织ET-1含量和门静脉压力.
引文著录: 顾杰, 周扬, 洪嘉禾, 徐列明. 扶正化瘀方对DMN肝硬化模型大鼠门静脉压力的影响. 世界华人消化杂志 2008; 16(10): 1042-1046
Revised: March 6, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To investigate the effect of Fuzheng Huayu Decoction (FHD) on portal hypertension due to liver cirrhosis induced by dimethylnitrosamine (DMN).
METHODS: After the rat model of hepatic cirrhosis was successfully established via intraperitoneal injection of 5 g/L DMN, traditional Chinese medicine formula FHD was administrated intragastrically. Three weeks later, serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), albumin (ALB) and total bilirubin (TBIL), as well as hepatic levels of hydroxyproline (Hyp) and endothelin-1 (ET-1) were measured. For portal pressure measurement, a catheter was inserted into the superior mesenteric vein and gently advanced up to the portal vein. The pathological alterations of liver tissues were observed and compared between control group and treatment group.
RESULTS: Portal pressure of the model group was 2.4 times higher than those in normal group; the ET-1 contents in liver tissue significantly increased in comparison with that of normal group (344.48 ± 71.42 pg/mg vs 247.00 ± 49.51 pg/mg, P < 0.01). The above two markers in model group were positively correlated (r = 0.675, P < 0.01). Portal pressure of the treatment group remarkably declined by 67% (P < 0.01) and ET-1 contents remarkably dropped to 292.13 ± 52.07 pg/mg (P < 0.05). There were significant differences between the treatment group and model group in the serum levels of ALT, AST, and TBIL and tissue contents of Hyp and ET-1. Pathological findings showed restoration of normal liver structure in the treatment group.
CONCLUSION: The elevation of portal pressure is positively correlated with the increase of ET-1 content during the process of liver cirrhosis; FHD can significantly decrease the cirrhosis-induced elevation of portal pressure and ET-1 content in liver tissues through its anti-hepatic fibrosis effect in rats.
- Citation: Gu J, Zhou Y, Hong JH, Xu LM. Effects of Fuzheng Huayu Decoction on elevated portal pressure in rat model of dimethylnitrosamine-induced liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1042-1046
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1042.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1042
肝硬化门静脉高压是临床上常见的综合病征, 过高的门静脉压力常常会导致腹水、脾肿大、侧支循环的开放等并发症的发生. 因此, 防治肝硬化门静脉高压的研究具有重要的现实意义. 我们前期的研究显示, 扶正化瘀方具有较好的抗肝纤维化作用[1-3]. 本研究拟在二甲基亚硝胺(dimethylnitrosamine, DMN)诱导大鼠肝硬化模型的基础上探讨扶正化瘀方对门静脉高压的作用.
♂SD大鼠, 体质量150±10 g, 44只, SPF级, 上海中医药大学实验动物中心提供. DMN, 东京化成工业株式会社产品. 扶正化瘀方浸膏(由丹参、桃仁、蝙蝠蛾青霉菌、绞股蓝、松花粉、五味子等组成)每100 mL约含生药36.9 g, 由上海黄海制药厂制备. 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT), 天门冬氨酸氨基转移酶(aspartate aminotransferase, AST), 总胆红素(total bilirubin, TBIL), 白蛋白(albumin, ALB)试剂盒购自南京建成生物公司; Power Lab生理数据处理和分析系统(澳大利亚ADI公司产品); 膜状内翳剪(苏州医疗器械总厂).
1.2.1 大鼠DMN肝纤维化模型的建立及给药方法: 大鼠随机分为造模组(30只)和正常组(14只), 造模组按2 mL/kg的剂量ip 5 g/L DMN, 首次注射剂量为全剂量的2/3, 连续注射3 d后停药4 d, 共4 wk, 第4周最后两次分别按全量的2/3, 1/2注射; 正常组ip等量的生理盐水. 造模结束后, 随机抽取2只大鼠处死, 观察肝脏的病变情况. 经病理学检查证实肝硬化后, 造模组随机分为治疗组和模型组. 治疗组每天按12.5 mg/kg的剂量给予扶正化瘀方ig, 共3 wk; 正常组和模型组每天给予等量的饮用水ig.
1.2.2 大鼠门静脉压力的测定: 以20 g/L戊巴比妥钠按2 mL/kg剂量麻醉大鼠. 将麻醉好的大鼠置于保温玻璃板上, 温度维持在37℃左右, 固定好四肢, 沿大鼠腹壁正中线剪开长约2 cm的"一"字形小口, 打开腹腔, 暴露门静脉主干, 分离出肠系膜上静脉, 结扎远离门静脉的一端, 然后用膜状内翳剪于静脉血管上剪开一"V"形小缺口, 插入PE-10管至门静脉正中, 固定后接通压力换能器测定门静脉压力并记录之. 门静脉压力测定完之后, 下腔静脉取血, 3000 r/min, 15 min离心取血清作生化测定, 留取肝组织做病理检测、肝组织内皮素-1(endothelin-1, ET-1)和肝组织羟脯氨酸(hydroxyproline, Hyp)的测定.
1.2.3 肝功能肝组织Hyp, ET-1的检测: 取适量血清按试剂盒说明书提供的步骤分别测定ALT、AST、TBIL、ALB. 肝组织Hyp测定采用Jamall氏法测定. 肝组织ET-1测定采用放免法测定. 取肝组织, 吸去血液, 称质量400 mg, 放入生理盐水1 mL研磨制成匀浆, 4℃, 3000 r/min离心15 min. 取上清液按照试剂盒说明书严格操作.
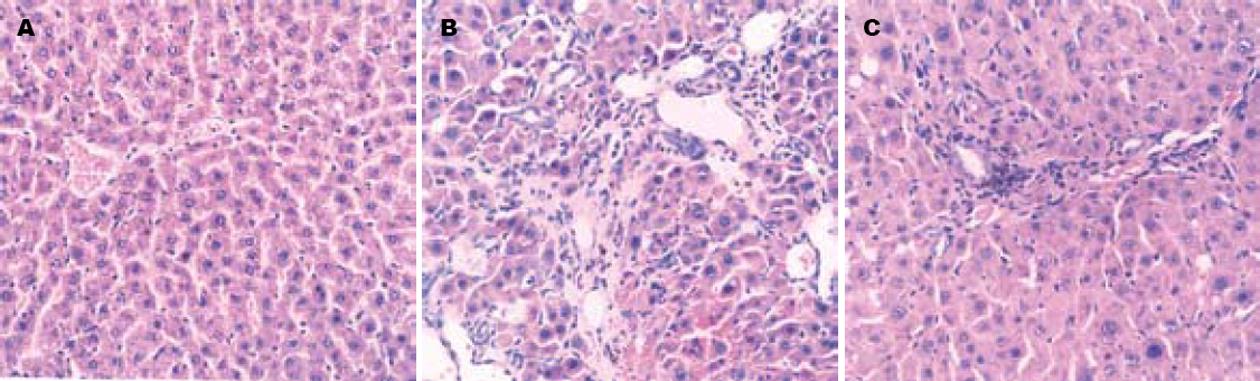
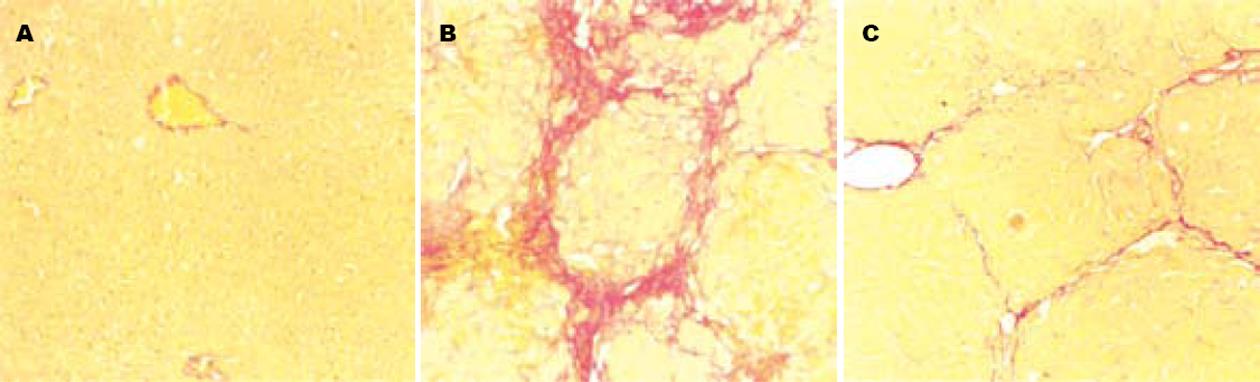
1.2.4 病理学观察: 肝组织经40 g/L甲醛液固定之后, 石蜡包埋, 切片厚5 μm, 作HE染色和天狼猩红染色, 观察肝组织炎症和纤维化程度.
统计学处理 计量资料以mean±SD表达, 三组计量资料的组间比较采用单因素方差分析和q检验; 两组计数资料的组间比较采用卡方检验; 相关分析采用Correlate中的Bivariate过程. 采用SPSS11.5统计软件进行统计分析处理.
造模4 wk时, 各组均无大鼠死亡, wk 5开始造模大鼠出现死亡, 至wk 7末, 正常组大鼠无死亡, 模型组死亡4只, 扶正化瘀方组死亡2只, 死亡原因为肝功能衰竭; 腹水发生数则以模型组最多, 扶正化瘀方和模型组相比有显著差异(表1).
与正常组比较, 模型组大鼠血清ALT, AST, TBIL水平显著升高, ALB含量下降; 治疗组与模型组比较, 血清ALT, AST, TBIL水平明显降低, ALB含量也趋于升高, 各组间差异明显(表2).
与正常组比较, 模型组肝组织中Hyp含量显著升高, 治疗组与模型组比较, Hyp含量明显降低(表3).
| 分组 | Hyp | 门静脉压 | ET-1 | |||
| n | 湿肝质量(μg/g) | n | 压力(mmHg) | n | ET-1(pg/mg) | |
| 正常组 | 12 | 302.31±45.65 | 12 | 5.9±1.0 | 14 | 247.00±49.51 |
| 模型组 | 9 | 700.70±158.53b | 9 | 13.9±2.3b | 9 | 344.48±71.42b |
| 扶正化瘀方组 | 12 | 544.08±154.37a | 13 | 9.3±1.4b | 13 | 292.13±52.07a |
光镜下HE染色显示正常大鼠肝小叶结构清晰, 肝细胞索由中央静脉向四周呈放射状排列, 可见少许窦旁细胞, 汇管区可见极少量纤维结缔组织. 造模4 wk结束时模型组大鼠肝脏可见大面积出血坏死, 并见大量肿胀坏死的肝细胞, 同时有大量淋巴细胞、单核细胞等炎性细胞浸润, 肝窦扭曲变形; 汇管区明显增宽, 广泛增生的纤维组织形成间隔, 将肝小叶分割包绕成大小不等的假小叶; 扶正化瘀方组大鼠肝脏的肝细胞变性、坏死, 肝内出血、纤维增生都有不同程度的改善(图1).
天狼猩红染色显示正常组大鼠肝脏内仅在汇管区和中央静脉壁见到少量胶原纤维. 模型组大鼠肝脏纤维组织弥漫性增生严重, 大多数形成较厚的完全间隔, 向肝小叶组织内伸展, 分割包绕肝组织, 形成假小叶; 扶正化瘀方组大鼠肝脏弥漫性纤维组织增生程度减轻, 纤维间隔菲薄(图2).
经DMN造模以后, 模型组大鼠门静脉压力显著升高, 与正常组比较, 升高幅度达到了8 mmHg, 为正常组的2.4倍. 而在给予扶正化瘀方治疗3 wk之后, 大鼠门静脉压力显著下降, 与模型组比较下降了约67%, 两组间的差异有统计学意义, 参见表3.
造模后wk 3时, 模型组肝组织中ET-1含量明显高于正常组, 给予扶正化瘀方治疗之后, 肝组织中ET-1含量显著下降, 与同期模型组比较有统计学意义(表3).
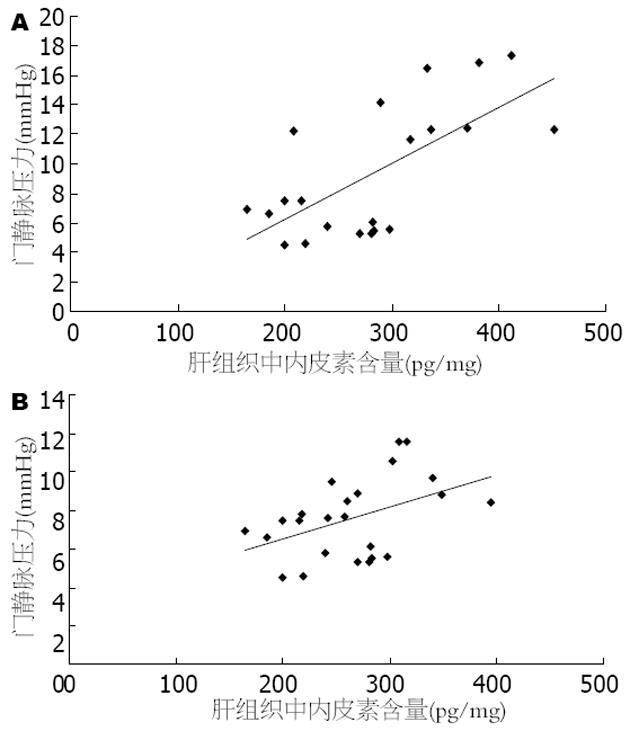
肝硬化大鼠肝组织中ET-1含量和门静脉压力之间呈显著正相关, (r = 0.675, P<0.01). 用扶正化瘀方治疗3 wk后, 肝组织ET-1含量和门静脉压力均下降, 两者仍然呈显著正相关(r = 0.447, P<0.05, 图3).
血瘀是肝硬化的基本病理因素[4], 正所谓: "凝血蕴里而不散, 津液涩渗, 著而不去" (灵枢·百病始生). 正气亏虚是肝硬化形成的内在因素. 《景岳全书·胁肋》云: "凡人元气血犹源泉也, 盛则流畅, 少则壅滞, 故气血不虚不滞, 虚则无有不滞者. "
扶正化瘀方由丹参、桃仁、蝙蝠蛾青霉菌、绞股蓝、松花粉、五味子等6味药组成. 丹参伍用桃仁, 活血祛瘀兼以养血而治标实. 蝙蝠蛾青霉菌是天然冬虫夏草在制药业和食品工业上的替代品. 《药性考》认为冬虫夏草有"秘精益气"的功效, 现代药理证明, 他其能够提高机体的免疫功能. 经多年的临床及科研证明, 扶正化瘀方能显著改善肝纤维化患者的临床症状, 减轻肝脏炎症, 降低血清ALT活性及总胆红素含量, 提高血清白蛋白含量及白/球蛋白比值, 降低血清单胺氧化酶(MAO)活性、TIMP1、P-Ⅲ-P、Ⅳ型胶原、透明质酸(HA)及层黏蛋白(LM)含量等纤维化血清学指标, 并减少肝窦周围以及汇管区和纤维间隔Ⅰ、Ⅲ、Ⅳ型胶原的沉积, 临床病理证实肝纤维化逆转率达52%-58%[5-7].
ET系统是门脉高压维持和加重的重要因素之一. 研究发现[8-9], 在肝硬化患者和门脉高压的动物模型中, 肝组织和外周血中ET-1水平均明显升高, 而且ET-1浓度的增加与门脉压力的升高显著相关, 提示ET-1是参与调节门脉压力的重要的血管活性因子之一. 在肝硬化早期, 肝内阻力增高是引起门脉高压的始动因素, 而肝星状细胞(hepatic stellate cell, HSC)的收缩加强是肝内阻力增高最重要的原因[10]. HSC在肝纤维化门静脉高压形成中主要起了关键的作用, 一是合成分泌细胞外基质, 生成纤维组织[11]; 二是通过伪足的收缩调控肝窦的直径[12]; 三是合成ET-1. 活化的HSC既是肝硬化肝脏ET-1合成的主要来源, 也是ET-1作用的主要靶细胞[13]. ET就是通过促进 HSC的收缩而在门脉高压形成的始动因素中起着重要作用.
本文研究中, 模型组大鼠肝组织中ET-1的含量较正常组明显升高, 约达40%, 同时模型组大鼠的门静脉压力也显著上升了2.4倍, 而给予扶正化瘀方治疗之后, 大鼠门静脉压力降低, 肝组织中ET-1的含量也相应地下降. 相关性分析显示, 肝硬化大鼠肝组织中ET-1含量和门静脉压力之间呈显著正相关.
本文用扶正化瘀方治疗DMN肝硬化模型大鼠3 wk之后, 门静脉压力显著下降. 探讨其作用机制, 可能有以下几方面: (1)降低肝脏ET-1的含量: ET-1是形成门静脉高压的重要血管活性物质, 本文研究结果显示, 扶正化瘀方组大鼠的肝组织ET-1含量相比模型组显著下降, 同时门静脉压力也显著下降. 鉴于已证实肝脏ET-1的含量与门静脉压力呈正相关, 因此扶正化瘀方降低肝组织ET-1的含量, 无疑能减少这种细胞因子对HSC的刺激, 显然是扶正化瘀方降低门静脉压力的作用机制之一. (2)抑制肝星状细胞: 我们前期研究证实, 扶正化瘀方有明确的抑制HSC活化的作用. 该方的君药丹参的抗肝纤维化有效成分SA-B抑制HSC活化的作用明显, 其不但明显抑制HSC合成分泌细胞外基质的功能, 还明显抑制细胞的收缩. 虽然在我们的实验水平无法直接观察到扶正化瘀方是否有抑制ET-1在HSC内信号传导从而抑制该细胞收缩的作用, 但是根据以前相关研究的成果, 可以推测扶正化瘀方降低门静脉压力的作用机制与其抑制HSC有关. HSC位于窦周间隙, 包绕肝窦并穿过肝细胞直达毗邻的肝窦. HSC活化、增殖以后合成大量的细胞外基质沉积于门静脉周围、肝小叶和狄氏间隙内, 形成"肝窦毛细血管化"[14], 是造成门静脉高压的重要因素. (3)减轻肝纤维化程度:本文肝硬化大鼠经扶正化瘀方治疗3 wk后, 肝组织Hyp含量下降, 肝脏纤维化的病理改变减轻. 肝纤维化程度的减轻、假小叶的减少, 一方面可减轻肝脏结构破坏和血管改建的病理变化, 另一方面也可减轻肝窦毛细血管化程度, 共同的结果是肝脏血管阻力下降, 肝脏微循环改善, 门静脉内淤滞的血液通过肝脏流出增加, 从而降低了门静脉压力.
总之, 肝硬化时大鼠门静脉压力升高与肝组织ET-1含量的增高呈正相关; 扶正化瘀方通过抗肝纤维化, 显著降低肝硬化模型大鼠升高的肝组织ET-1含量和门静脉压力.
感谢上海中医药大学中药研究所吴大正教授对本研究大鼠门静脉压测定工作的帮助和指导.
肝纤维化是肝硬化的基本病理改变, 门静脉高压症是肝硬化的主要并发症. 研究显示, 扶正化瘀方具有良好的抗肝纤维化作用, 临床治疗慢性乙型肝炎肝纤维化疗效显著, 也用于治疗肝硬化.
许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科
近年来发现活化肝星状细胞造成肝窦毛细血管化以及在内皮素作用下的细胞收缩是肝硬化门静脉高压的重要病理生理机制. 通过抗肝纤维化和抑制活化肝星状细胞的收缩功能治疗肝硬化门静脉高压的研究将成为新的研究领域.
扶正化瘀方通过抗肝纤维化、降低肝组织内皮素的含量和抑制肝星状细胞活化治疗肝硬化门静脉高压, 取"釜底抽薪""疏通"之法, 取得疗效.
本文研究提示扶正化瘀方(扶正化瘀胶囊)可以治疗肝硬化门静脉高压.
本研究设计合理, 结论可信, 结果有参考价值, 具有一定的可读性.
编辑: 黄晓东 电编:吴鹏朕
| 6. | 刘 平, 刘 成, 陈 高潮, 胡 义阳, 徐 列明, 吕 萍, 杨 金龙, 严 润民, 季 青, 储 峰. 扶正化瘀319方治疗慢性乙型肝炎及其对纤维化血清学指标的影响. 中国中西医结合杂志. 1996;16:588-592. |
| 8. | Rothermund L, Cho JJ, Leggewie S, Schwarz A, Bauer C, Paul M, Neumayer HH, Schuppan D, Hocher B. Activation of the hepatic endothelin-system in rats with biliary liver fibrosis. J Cardiovasc Pharmacol. 2000;36:S270-S273. [PubMed] [DOI] |
| 9. | Ikura Y, Ohsawa M, Naruko T, Muraguchi T, Hirayama M, Suekane T, Fukushima H, Sugama Y, Shirai N, Kayo S. Expression of the hepatic endothelin system in human cirrhotic livers. J Pathol. 2004;204:304-310. [PubMed] [DOI] |
| 10. | McCuskey RS. Morphological mechanisms for regulating blood flow through hepatic sinusoids. Liver. 2000;20:3-7. [PubMed] [DOI] |
| 11. | Friedman SL. Hepatic Fibrosis in Schiff's Disease of the liver. 8th ed. Schiff E.E, Maddrey W, Sorrell M, editors. Philadelphia: Raven Press 1998; 371-385. |
| 12. | Zhang JX, Pegoli W Jr, Clemens MG. Endothelin-1 induces direct constriction of hepatic sinusoids. Am J Physiol. 1994;266:G624-G632. [PubMed] |
| 13. | Housset C, Rockey DC, Bissell DM. Endothelin receptors in rat liver: lipocytes as a contractile target for endothelin 1. Proc Natl Acad Sci USA. 1993;90:9266-9270. [PubMed] |
| 14. | Friedman SL. Cellular sources of collagen and regulation of collagen production in liver. Semin Liver Dis. 1990;10:20-29. [PubMed] [DOI] |