修回日期: 2007-11-24
接受日期: 2007-12-25
在线出版日期: 2008-01-08
目的: 探讨细胞凋亡相关蛋白Bad、Bax和Bid表达在小鼠非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)中的作用.
方法: 采用胆碱-蛋氨酸缺乏、高脂(high fat, methionine and choline deficient, MCD)饮食建立小鼠NASH模型(实验组), 以胆碱-蛋氨酸充足饮食设立对照组. HE染色观察肝脏脂肪变、炎症活动和纤维化程度; 采用Western blot检测Bad、Bax和Bid蛋白表达.
结果: MCD饮食喂养小鼠10 d可见轻度肝脂肪变, 3 wk形成中、重度肝脂肪变及明显的炎性细胞浸润, 8 wk肝脂肪变、肝细胞坏死、炎性细胞浸润加重, 或伴有轻度肝纤维化. 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)水平随肝损伤加重而进行性升高. 10 d、3 wk和8 wk实验组小鼠肝组织Bad和Bax蛋白表达显著高于对照组(P<0.05、P<0.01和P<0.05); 造模10 d实验组小鼠Bid蛋白活化, 10 d、3 wk和8 wk表达均显著高于对照组(P<0.01).
结论: MCD饮食可导致小鼠NASH, 诱发细胞凋亡调节蛋白Bad、Bax和Bid表达上调.
引文著录: 南月敏, 胡云龙, 付娜, 吴文娟. Bad、Bax和Bid蛋白表达在非酒精性脂肪性肝炎中的作用. 世界华人消化杂志 2008; 16(1): 81-85
Revised: November 24, 2007
Accepted: December 25, 2007
Published online: January 8, 2008
AIM: To explore the effects of expression of apoptosis-related proteins Bad, Bax and Bid on the progress of non-alcoholic steatohepatitis (NASH) in mice.
METHODS: Experimental NASH models were established by feeding mice with a high fat, methionine and choline deficient (MCD) diet (MCD group). Control animals were fed with a choline-methionine supplemented diet (control group). Hepatic steatosis, inflammation and fibrosis were graded by routine H&E staining of liver sections. The levels of proapoptotic-related proteins, such as Bad, Bax and Bid, were determined by Western blot.
RESULTS: Mice fed with the MCD diet exhibited mild steatosis on day 10, moderate steatohepatitis in week 3 and severe steatohepatitis in week 8, as detected by H&E staining, in parallel with a rise in the levels of transaminases. Hepatic expression of Bad and Bax proteins was more pronounced from day 10, and continued to rise until week 3 and 8 in the MCD group compared with the control group (P < 0.05, P < 0.01 and P < 0.05, respectively). Moreover, Bid was activated through hydrolyzation and up-regulated by day 10, week 3 and 8 (P < 0.01).
CONCLUSION: Combined expression of the proapoptotic proteins Bad, Bax and Bid may be involved in the progression of MCD-induced steatohepatitis.
- Citation: Nan YM, Hu YL, Fu N, Wu WJ. Novel effect of the expression of proapoptotic proteins Bad, Bax and Bid in non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 81-85
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/81.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.81
细胞凋亡为急、慢性肝病的主要特征之一, 近年研究发现, 肝细胞凋亡是单纯性脂肪肝向脂肪性肝炎进展"二次打击"机制中的重要肝损伤表现[1-3], 与炎症程度和纤维化进展相关. 细胞凋亡途径包括内源性和外源性两条途径, 均存在于非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)发生和发展过程中[4-5]. 细胞凋亡受多种凋亡基因调节, 如B细胞淋巴瘤/白血病-2基因(B-cell lymphoma/leukemia-2 gene, Bcl-2)家族中Bcl-2、Bcl-xL蛋白具有抗凋亡作用, 而Bad、Bax和Bid等具有促凋亡作用[6]. 目前, 关于Bad、Bax和Bid在NASH发病机制中的作用研究尚少. 我们采用高脂、胆碱-蛋氨酸缺乏(high fat, methionine and choline deficient, MCD)饮食建立小鼠NASH模型, 以探讨上述促细胞凋亡基因表达与NASH进展的关系.
健康♂C57BL6/J小鼠40只, 周龄7-8 wk, 体质量20-25 g, 购于中国医学科学院实验动物研究所. 胆碱-蛋氨酸缺乏的高脂饲料和胆碱-蛋氨酸充足的饲料为ICN生物医学化学药品公司产品. 兔抗鼠Bad、Bax和Bid mAb、鼠抗鼠β-actin mAb以及辣根过氧化物酶标记的抗兔、抗鼠多克隆抗体购于Santa Cruz公司.
1.2.1 造模和采集标本: 按文献报道[2]建立实验模型, 将实验所用40只小鼠随机分为4个实验组和4个对照组, 每组5只. 分别采用MCD饲料和胆碱-蛋氨酸充足的饲料喂养2 d、10 d、3 wk和8 wk, 处死小鼠, 留取血清和肝组织标本. 部分肝组织经40 g/L甲醛固定, 备做病理切片. 其余肝组织采用液氮快速冷冻、-80℃保存, 以备蛋白提取.
1.2.2 测定ALT: 采用处死实验小鼠的当日血清, 以Olympus AU2700全自动生化分析仪速率法检测, 试剂为日本第一化学药品株式会社产品.
1.2.3 观察肝组织病理学: 石蜡包埋, 常规组织切片(5 μm), HE染色, 光镜下观察肝组织学变化, 参照《非酒精性脂肪性肝病诊疗指南》[7]及2001年《病毒性肝炎防治方案》[8], 肝脂肪变分为4度(F0-4), 炎症活动度分为3级(G0-3), 肝纤维化分为4期(S0-4).
1.2.4 检测Bad、Bax和Bid蛋白表达和激活水平: 采用Western blot实验, 提取肝组织蛋白匀浆, 以紫外分光光度计(750 nm)测定蛋白浓度. 取含60 μg蛋白肝组织匀浆, 变性处理后经120 g/L SDS-PAGE电泳分离, 4℃条件下经2-3 h将蛋白电转移至硝酸纤维素膜, 置膜于含50 g/L脱脂牛奶中(TBST缓冲液稀释)封闭1 h. 分别加入特异性兔抗鼠Bad、Bax和Bid mAb(1∶500稀释)、鼠抗鼠β-actin mAb及辣根过氧化物酶标记的抗兔、抗鼠多克隆抗体(1∶5000稀释)进行免疫反应, 以增强化学发光显色系统显色, 超敏胶片曝光, 以β-actin为内参照.
统计学处理 实验数据以mean±SD表示, 采用SPSS10.0统计软件进行检验, 数据比较采用t检验, P<0.05为差异具有统计学意义.
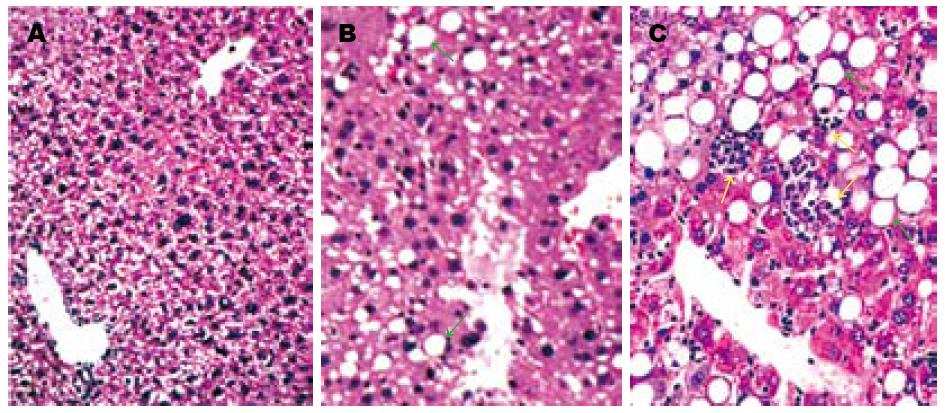
对照组小鼠ALT正常, 肝组织学无异常变化(图1A). 实验组小鼠2 d ALT轻度增高, 肝组织学无明显异常; 造模10 d ALT明显增高, 形成大泡性轻度肝细胞脂肪变(F1, G0-1, S0)(图1B); 随造模时间延长, 至3 wk和8 wk肝脏功能严重受损, ALT显著异常, 肝组织学呈现中、重度肝细胞脂肪变, 分别伴有点状或灶状肝细胞坏死、炎性细胞浸润和不同程度肝纤维化(分别为F2-3, G1-2, S0-1和F3-4, G2-3, S1-2)(表1, 图1C).
| 分组 | ALT(U/L) | |||
| 2 d | 10 d | 3 wk | 8 wk | |
| 对照组 | 29.8±29.6 | 18.4±6.0 | 34.8±24.0 | 65.8±50.0 |
| 实验组 | 136.8±108.2 | 328.0±71.3 | 296.8±171.3 | 470.6±147.7 |
| P value | 0.0600 | <0.0001 | 0.0023 | 0.0013 |
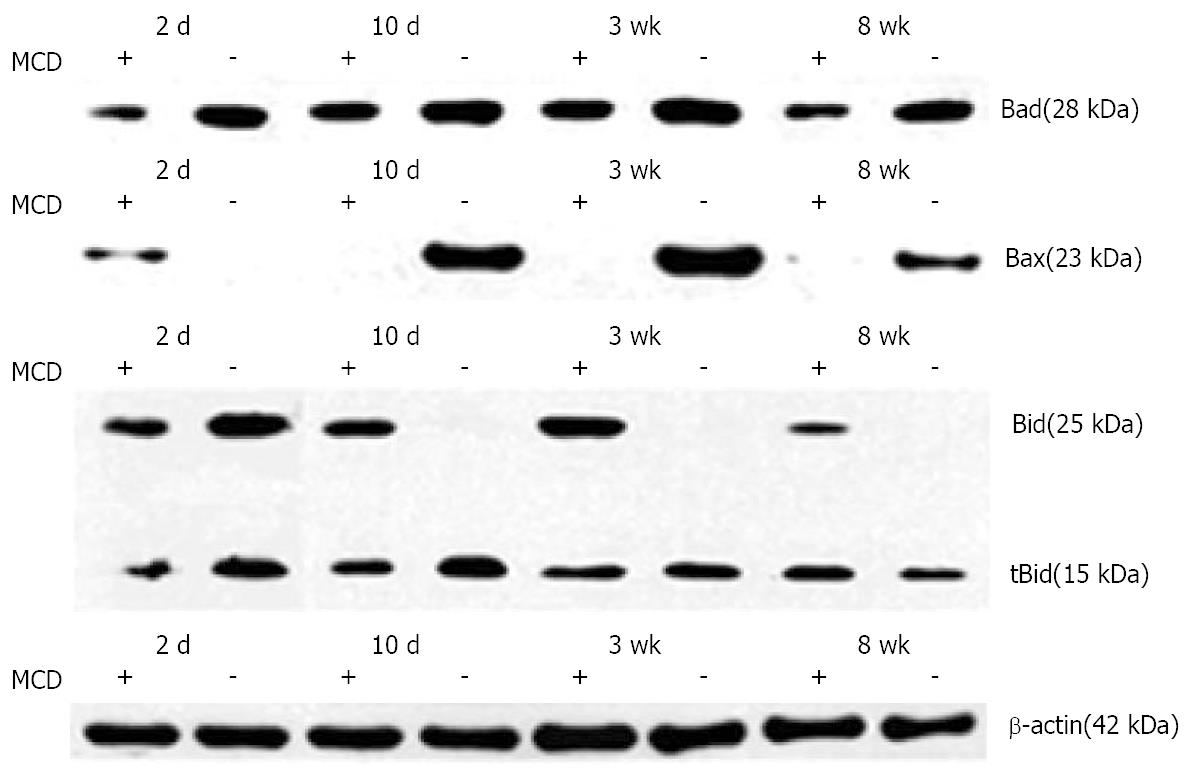
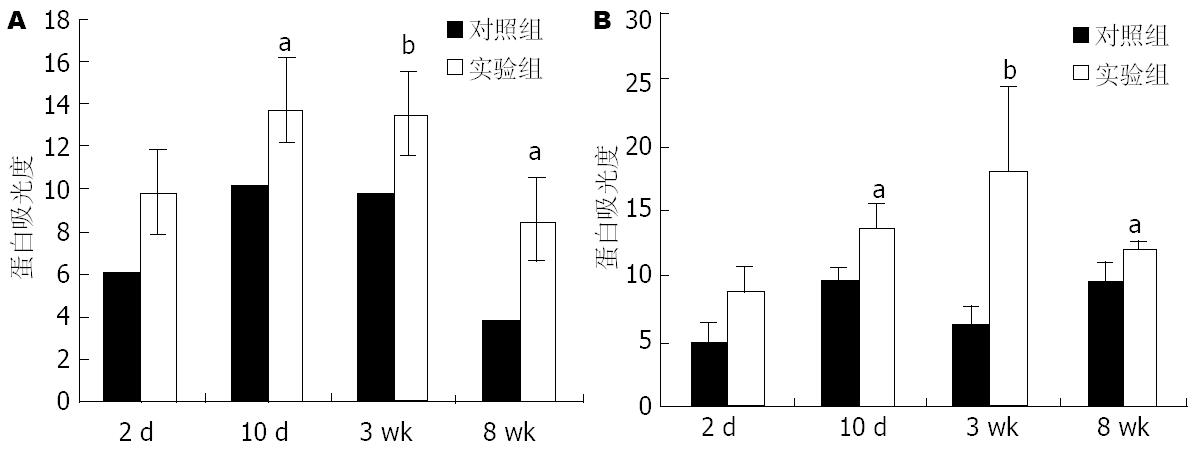
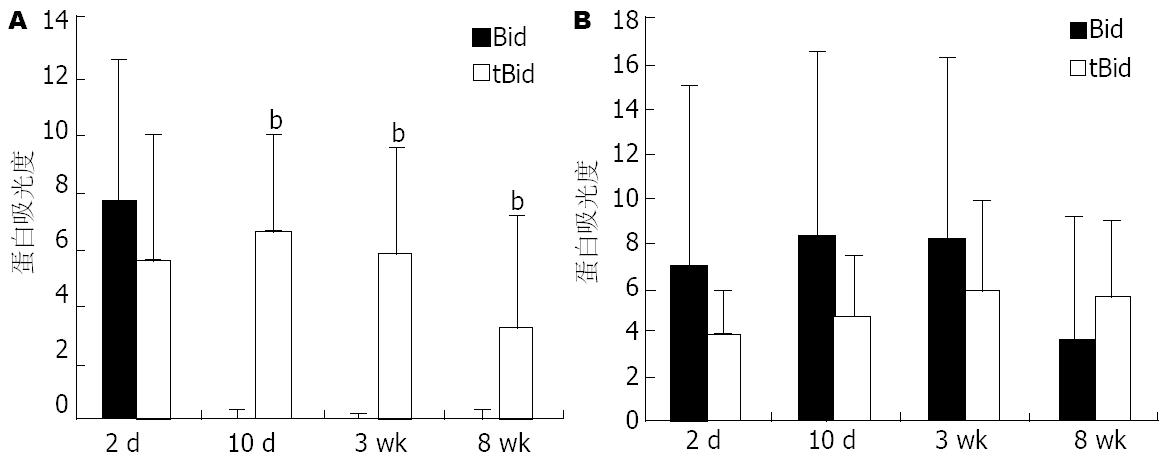
实验组小鼠肝组织Bax和Bad蛋白表达水平于造模10 d、3 wk和8 wk均高于对照组, 差异具有统计学意义(P<0.05、P<0.01和P<0.05). 实验组小鼠Bid蛋白10 d、3 wk和8 wk明显活化, tBid蛋白表达明显增高(P<0.01), 对照组小鼠Bid蛋白活化不明显(P>0.05)(图2-4).
NASH为单纯性脂肪肝向肝硬化发展的重要阶段[9], 建立快速、复制率高的NASH模型, 探讨其发病的分子生物学机制, 对阻止单纯性脂肪肝发生脂肪性肝炎以及向肝硬化的进展具有重要意义. 本实验采用MCD饮食成功诱导NASH小鼠模型, 表现为血清ALT升高、肝组织学上有肝细胞脂肪变、坏死、炎症细胞浸润或伴有肝纤维化, 且随造模时间的延长肝损伤呈进行性加重.
细胞凋亡是细胞基因调控、维持内环境稳定的一种自主性细胞死亡, 是维持人体正常生理功能的必需过程, 其中存在由Bcl-2家族调节的线粒体凋亡途径[1]和Fas-L/Fas介导的外在细胞凋亡途径[3]. Bcl-2家族成员通过形成不同形式同源或异源二聚体对细胞凋亡产生抑制或促进作用. 其中Bax-Bax同源二聚体诱导细胞凋亡, Bcl-2通过与Bax形成Bcl-2-Bax异源二聚体抑制细胞凋亡. 因此, Bcl-2与Bax的比例决定细胞凋亡是否发生. Bad蛋白与Bcl-xL结合作用强于与Bcl-2结合, 其功能为通过与Bcl-xL-Bax二聚体中Bcl-xL结合, 置换出游离Bax, 进一步形成Bax-Bax同源二聚体而启动细胞凋亡[10]. 同时, Bid蛋白经caspase-8水解形成活性分子tBid, tBid向线粒体转位, 一方面通过激活促凋亡蛋白Bak发生寡聚化, 另一方面与Bax相互作用使其构象改变而插入线粒体膜, 通过在线粒体外膜形成跨膜通道, 或开启线粒体通透性转换孔(permeability transition pore, PTP)引起线粒体跨膜电位下降和细胞色素C释放, 进一步激活下游caspase级联反应导致细胞凋亡[11-12].
本实验结果显示, MCD饮食喂养小鼠10 d-8 wk, 肝组织Bad和Bax蛋白表达持续增强, Bid蛋白裂解活化, 并随之出现中、重度肝脂肪变, 点、灶状肝细胞坏死和炎症细胞浸润或伴有肝纤维化, 表明Bad、Bax和Bid蛋白的表达上调或活化与肝组织损伤及其进展有关. 上述改变的可能机制为MCD饮食导致肝细胞脂肪变, 沉积的脂质产生过氧化物诱发氧化应激, 产生大量活性氧(reactive oxygen specimens, ROS), ROS的产生可激活Fas-L/Fas系统, 进一步导致Fas致死区结构蛋白募集下游的caspase家族成员, 引起caspase-8活化[3,13-14]; 氧化应激和活性氧的产生亦可增加TNF-α的释放, TNF-α与其受体TNF-R1相互作用亦引起caspase-8活化, 后者水解胞质中的Bid形成活性分子tBid, tBid进入线粒体, 激活Bak及Bax蛋白引起线粒体跨膜电位下降及细胞色素C释放, 进一步激活下游caspase级联反应, 使凋亡信号扩大. 此外, TNF-α的释放可阻止Bad蛋白的磷酸化, 促进其与Bcl-2、Bcl-xL蛋白结合而减弱二者与Bax结合的抗凋亡作用, 增强Bax对线粒体的损伤, 加速细胞凋亡[13,15]. 凋亡的肝细胞可导致炎症细胞的聚集、枯否细胞吞噬凋亡小体而活化, 释放大量细胞因子, 进一步可激活肝星状细胞导致纤维组织增生.
研究结果表明, MCD饮食可导致肝细胞脂肪变和氧化应激, 诱发细胞凋亡调节蛋白Bad、Bax和Bid表达上调, 引起线粒体损伤和细胞色素C释放而激活下游caspase级联信号转导通路, 促进肝细胞凋亡, 并导致肝脏炎症和纤维化. 因此, 进一步探讨有效的抗氧化剂和基因调节治疗可能有助于阻止NASH发生及进展.
随着生活水平的提高, 非酒精性脂肪性肝炎的发病率逐年上升. 有关NASH的发病机制的研究成为热点. 细胞凋亡在各种肝病的发生中起重要作用, 亦可能为NASH发生及进展的关键因素.
本文建立小鼠NASH模型, 着重研究细胞凋亡相关蛋白Bad、Bax和Bid的表达在非酒精性脂肪性肝炎中的作用机制, 明确细胞凋亡为NASH发病的重要环节.
本文所采用的NASH动物模型具有复制率高、模型建立迅速、具备人类NASH病理特征, 是目前国际公认的最理想的NASH动物模型, 可于较短时间内形成以大泡性为主的脂肪肝模型, 并随造模时间延长可进展为脂肪性肝炎、肝纤维化和肝硬化等系列病变.
本文通过研究细胞凋亡相关蛋白Bad、Bax和Bid表达与NASH进展的关系, 明确细胞凋亡在NASH发病中的作用, 为进一步探讨抗凋亡治疗延缓NASH发生及进展的作用奠定基础.
本文研究内容新颖, 课题设计简单明了, 结论可靠, 有一定的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Baskin-Bey ES, Gores GJ. Death by association: BH3 domain-only proteins and liver injury. Am J Physiol Gastrointest Liver Physiol. 2005;289:G987-G990. [PubMed] |
| 4. | Feldstein AE, Gores GJ. Apoptosis in alcoholic and nonalcoholic steatohepatitis. Front Biosci. 2005;10:3093-3099. [PubMed] |
| 5. | Feldstein AE, Canbay A, Angulo P, Taniai M, Burgart LJ, Lindor KD, Gores GJ. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 2003;125:437-443. [PubMed] |
| 6. | Uren RT, Dewson G, Chen L, Coyne SC, Huang DC, Adams JM, Kluck RM. Mitochondrial permeabilization relies on BH3 ligands engaging multiple prosurvival Bcl-2 relatives, not Bak. J Cell Biol. 2007;177:277-287. [PubMed] |
| 9. | Zou Y, Li J, Lu C, Wang J, Ge J, Huang Y, Zhang L, Wang Y. High-fat emulsion-induced rat model of nonalcoholic steatohepatitis. Life Sci. 2006;79:1100-1107. [PubMed] |
| 10. | Pastorino JG, Shulga N, Hoek JB. TNF-alpha-induced cell death in ethanol-exposed cells depends on p38 MAPK signaling but is independent of Bid and caspase-8. Am J Physiol Gastrointest Liver Physiol. 2003;285:G503-G516. [PubMed] |
| 11. | Zhao Y, Li S, Childs EE, Kuharsky DK, Yin XM. Activation of pro-death Bcl-2 family proteins and mitochondria apoptosis pathway in tumor necrosis factor-alpha-induced liver injury. J Biol Chem. 2001;276:27432-27440. [PubMed] |
| 12. | Molpeceres V, Mauriz JL, García-Mediavilla MV, González P, Barrio JP, González-Gallego J. Melatonin is able to reduce the apoptotic liver changes induced by aging via inhibition of the intrinsic pathway of apoptosis. J Gerontol A Biol Sci Med Sci. 2007;62:687-695. [PubMed] |
| 13. | Gross A, McDonnell JM, Korsmeyer SJ. BCL-2 family members and the mitochondria in apoptosis. Genes Dev. 1999;13:1899-1911. [PubMed] |
| 14. | Begriche K, Igoudjil A, Pessayre D, Fromenty B. Mitochondrial dysfunction in NASH: causes, consequences and possible means to prevent it. Mitochondrion. 2006;6:1-28. [PubMed] |
| 15. | Tsuruta F, Masuyama N, Gotoh Y. The pho-sphatidylinositol 3-kinase (PI3K)-Akt pathway suppresses Bax translocation to mitochondria. J Biol Chem. 2002;277:14040-14047. [PubMed] |