修回日期: 2007-01-04
接受日期: 2007-01-31
在线出版日期: 2007-03-28
目的: 应用无血清培养液(SFM)培养Lovo细胞系, 克隆分离具有干细胞样特性SP细胞.
方法: 应用SFM培养Lovo细胞, 分离成球样生长的细胞群作为SP细胞, 并通过有限稀释, 分化, 自我更新, 含血清培养基(SSM)和SFM交替培养及Musashi-1化学染色方法来鉴定SP细胞.
结果: Lovo细胞中约含有0.54%-0.62%的SP能够在无血清培养基中能够存活、增殖, 形成悬浮的肿瘤细胞球; 在SFM中加入血清可促使SP细胞分化; SP细胞可以连续传代, 并可交替培养于SSM和SFM中, 细胞形态无明显变化; SP细胞Musashi-1染色阳性.
结论: 应用SFM可从Lovo细胞中分离出极少量的具有干细胞特性的SP细胞.
引文著录: 王锡山, 刘彦龙, 杨艳梅. 大肠癌细胞系Lovo中亚群(SP)细胞的分离培养和鉴定. 世界华人消化杂志 2007; 15(9): 953-959
Revised: January 4, 2007
Accepted: January 31, 2007
Published online: March 28, 2007
AIM: To investigate whether colon cancer cell line Lovo contains side population (SP) with cancer stem cell-like properties.
METHODS: Lovo cell line was cultivated in serum-free medium and SP cells reforming into floating spheres were isolated. The isolated SP cells were identified by limiting-dilution assay, differentiation assay, self-renewal assay, alternative cultivation assay and immunocytochemical staining with anti-Mus-1 assay.
RESULTS: In the absence of serum, a minority (0.54%-0.62%) of SP cells in Lovo cells survived, proliferated and assembled into the suspended tumor cell spheres. Lovo SP cells possessed proliferative, self-renewal and differentiation potential, which were responsible for the floating tumor clone. Serum addition into SFM resulted in the proliferation of SP cells; after several generations and alternated cultivation in SSM and SFM, SP cells maintained their characters. The stem cell surface marker Mus-1 was observed in Lovo SP cells after Musashi-1 staining.
CONCLUSION: Lovo cell line contains a tiny minority of SP cells with stem cell properties that can be maintained in SFM using a floating-culture method for a long time.
- Citation: Wang XS, Liu YL, Yang YM. Isolation and identification of side population in Lovo colon cancer cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(9): 953-959
- URL: https://www.wjgnet.com/1009-3079/full/v15/i9/953.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i9.953
癌症细胞和干细胞一样具有无限增殖的能力. 近年来, 在白血病[1-2]和一些实体肿瘤中, 包括乳腺癌[3]、胰腺癌[4]、头颈鳞状细胞癌[5]、肝癌[6]和脑肿瘤[7-10]中已发现了具有干细胞特征的细胞, 我们称之为癌症干细胞(CSCs). 虽然这种细胞的数量极少, 但能够瘤性克隆生长, 从而产生不同表型的癌细胞亚群[11-12]. 当前认为在经过放化疗后, CSCs是导致肿瘤复发的原因[1,3]. 因此, 研究CSCs有利于更好的理解肿瘤复发、转移和耐药性产生的机制, 从而制定更为合理的治疗方案. 大肠癌是一种常见肿瘤, 其生物学行为较其他消化道肿瘤的恶性度低, 术后5年生存率较高, 但是仍有40%-50%的患者因为复发而需放化疗. 研究CSCs可以提高治疗的针对性和有效性, 具有更为实际的意义. 我们通过无血清培养基培养Lovo细胞系, 克隆分离癌细胞亚群(side-population, SP), 并从形态学、分化、自我更新、交替培养以及细胞化学免疫等方面进行鉴定.
细胞株为大肠癌细胞系Lovo(黑龙江省肿瘤研究所提供). 传统含血清培养基(serum-supplemented medium, SSM)为含100 mL/L胎牛血清的DMEM/F12(1:1, invitrogen-gibco)培养基, 并添加L-谷氨酰胺(Sigma) 2 mL/L, 胰岛素(Sigma) 4 U/L, 青霉素G 105 U/L和链霉素100 mg/L. 无血清培养基(serum-free medium, SFM)为不含牛血清的DMEM/F12(1:1)培养基, 并添加重组表皮生长因子EGF(20 μg/L, PeproTech)、碱性成纤维生长因子bFGF(20 μg/L, PeproTech)和白血病抑制因子LIF(20 μg/L, PeproTech), 以及1 mg/L胰岛素, 1×10-7 mol/L地塞米松(Sigma), 10 mmol/L尼克酰胺(Sigma), 2 mmol/L L-谷氨酰胺(Sigma), 50 μmol/L 2-巯基乙醇(Sigma), 5 mmol/L HEPES, 105 U/L青霉素G和100 mg/L链霉素.
1.2.1 SP的培养分离和传代: 先将Lovo细胞系接种于传统SSM中, 在培养瓶中传代. 选择对数生长期的细胞, 用D-Hanks液清洗, 胰酶(2.5 g/L)消化, 重悬于SFM, 台盼兰染色并计数, 以1×105/孔接种于6孔板中, 继续在37 ℃, 50 mL/L CO2培养箱中培养. 待增殖形成细胞球3-4 d后, 将其收集并机械吹打成单细胞悬液, 重悬于SFM, 按1:4的比例传代于6孔中.
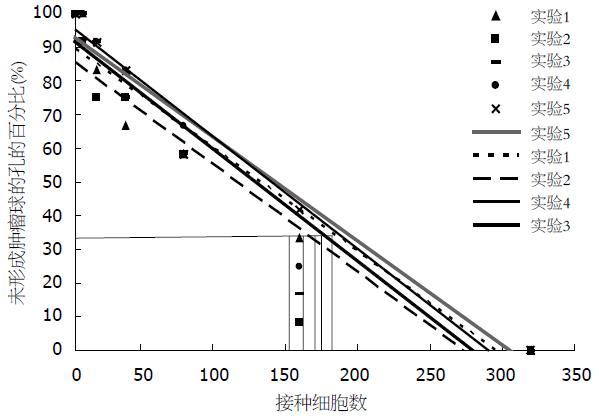
1.2.2 有限稀释法: 有限稀释采用Bellows et al[13], Tropepe et al[14]的方法, 将贴壁生长于SSM中的细胞经胰酶消化, 吹打成单细胞悬液, 计数后重悬于SFM, 按每孔200 μL分别接种320, 160, 80, 40, 20, 10和5个细胞稀释, 接种于96孔板. 以每个浓度未形成肿瘤球的孔的百分比为应变量, 以每孔中接种的细胞数为自变量, 作直线回归分析并用方差分析作拟和优度检测. 回归方程中与以应变量37%相对应的自变量值就是要形成一个肿瘤球所需的接种细胞量, 因为每个肿瘤细胞球均有一个肿瘤干细胞形成, 所以根据这一细胞量求出肿瘤干细胞在细胞系中的比例. 此试验重复5次.
1.2.3 SP细胞的自我更新与诱导分化: 在Lovo细胞培养于SFM的第7天, 分别分离细胞球和单细胞, 并将细胞球机械吹打成单细胞悬液, 分别重悬于SFM液中, 培养于37 ℃, 50 mL/L CO2培养箱中. 在原发肿瘤干细胞球形成的第2天, 吸出肿瘤球, 分别平铺于放有涂有多聚赖氨酸的盖玻片24孔板中, 换成添加100 mL/L FBS的SFM培养液, 7 d后进行免疫荧光化学染色.
1.2.4 SP交替在SSM和SFM培养基中培养: 按照1.2.1的方法, 待Lovo细胞系在SFM中细胞球2 d后, 收集并重悬于SSM液中, 待其呈单层细胞生长后, 再收集并重悬于SFM液中, 呈细胞球样悬浮生长, 如此反复3次.
1.2.5 Musashi-1细胞化学染色: 把SP形成的的肿瘤球吸出, 平铺于放有涂有多聚赖氨酸的24孔板中, 培养于添加100 mL/L FBS的SFM中4 h, 在室温下用40 g/L多聚甲醛-PBS固定20 min. 用冷2 g/L TritonX-100/PBS在4 ℃下透膜10 min, 然后在4 ℃下与Musashi-1 mAb过夜(1:200; Chemicon). 用冷2 g/L TritonX-100/PBS 4 ℃下冲洗5 min, 冲洗3次, 再用含有30 g/L牛血清白蛋白的冷2 g/L TritonX-100/PBS 4 ℃下冲洗5 min. 用FITC抗兔IgG1检测一抗. 然后用含有PI的封固剂复染鉴定细胞核, 在荧光倒置显微镜(Nikon)下观察. 同理在分化的第7天和贴壁培养的第2天进行免疫化学染色.
Lovo在SFM中培养24-48 h后可产生少量体积较小的悬浮肿瘤球(图1A), 72 h后肿瘤球体积增大, 随着时间的延长, 在1 wk左右所形成的肿瘤球一部分肿瘤球较松散, 此为黏附细胞团, 一部分肿瘤球形态较一致且比较致密(图1B), 3 wk左右均形成致密的形态一致的肿瘤球(图1C), 而且经过传代后肿瘤球的总数量大量扩增. 这部分肿瘤球细胞我们称之为SP细胞. 剩余的大多数肿瘤细胞即N-SP(non-side population)呈现黏附, 不具有增殖和分化的能力. 而用SSM培养的Lovo时, 接种后数小时内开始贴壁, 48 h后形成单层贴壁细胞层, 没有悬浮细胞团产生(图1D).
采用Bellows et al[13], Tropepe et al[14]的方法, 经有限稀释、单克隆形成试验和直线回归分析, 在用SFM培养Lovo时, 要形成一个肿瘤细胞球所需的细胞数为173.68±11.02(SD), 这证明了Lovo中有0.58%±0.04%(SD)的能够形成肿瘤细胞球的SP细胞, 而其他大多数细胞不具备这种能力(图2, 表1).
| 试验次数 | R2 | 形成一个肿瘤球时每孔所需的细胞数 | 肿瘤球的比例(%) |
| 实验1 | 0.926 | 175.70 | 0.57 |
| 实验2 | 0.860 | 157.73 | 0.63 |
| 实验3 | 0.897 | 168.73 | 0.59 |
| 实验4 | 0.944 | 179.63 | 0.56 |
| 实验5 | 0.971 | 186.61 | 0.54 |
| mean±SD | 173.68±11.02 | 0.58±0.04 |
我们观察到Lovo细胞在SFM培养形成肿瘤球后, 经机械吹打后培养于SFM中, 1-2 wk后仍可形成肿瘤细胞球和一些单细胞, 其形态与原代相同(图3A), 而单细胞则不具有这种功能, 只能形成单细胞(图3B).
当SP细胞形成肿瘤球后, 在SFM中滴加FBS, 并隔日补充, 24-48 h内肿瘤球无明显变化, 单细胞黏附生长明显(图4A), 72 h肿瘤球开始变小, 单细胞增多, 第5天时肿瘤球开始裂解成多个小细胞团(图4B), 7 d左右时肿瘤球消失, 均为单细胞, 且多为黏附生长(图4C).
将上述方法获得的肿瘤球重铺于SSM中, 12 h内细胞贴壁, 细胞平贴培养板底(图5A), 24 h左右细胞数量增多并形成小片状细胞岛(图5B), 48 h后细胞岛扩大, 并开始与邻近的细胞岛融合, 并逐渐形成单层的Lovo细胞层, 显微镜下与传统培养形成的单细胞层无明显差异(图5C). 消化单层Lovo细胞, 重新培养于SFM中, 仍可形成肿瘤细胞球, 其形态与原代相同(图5D).
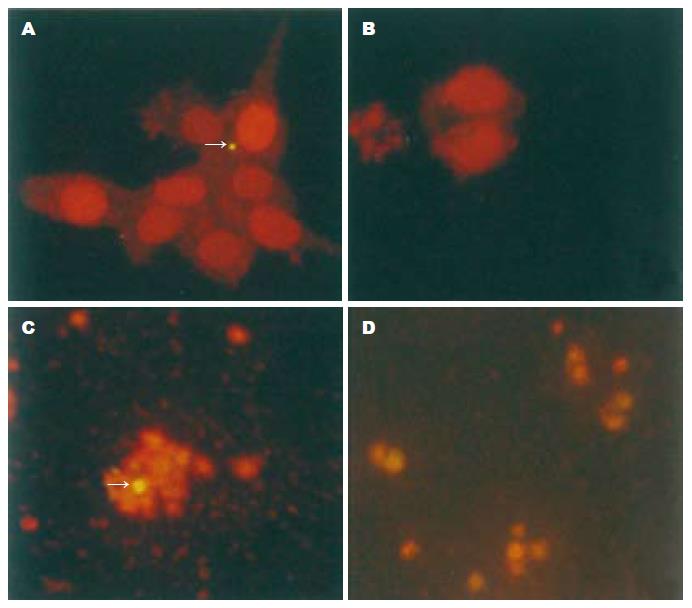
我们首先对SSM培养下的Lovo细胞进行染色, 我们发现在Lovo中只有极少量的细胞表达Musashi-1, 细胞核较圆, 并且比较小(图6A), 而Musashi-1阴性的肿瘤细胞核呈长椭圆形, 核较大(图6B). SP细胞形成的肿瘤细胞球表达Musashi-1(图6C), 而SP细胞经分化7 d后则不表达(图6D).
SP细胞的分离最初主要应用于鉴定造血干细胞, 并且通常认为在不同的组织和器官中均富含有干细胞[15-16]. 目前认为在癌细胞中也存在着干细胞样肿瘤细胞, 富含于SP细胞中[17-18]. Haraguchi et al[19]指出, 在不同的胃肠道癌症细胞系中鉴定出含有0.3%-2.2%的SP细胞, 在干细胞培养基中一般呈悬浮的肿瘤球样生长. 在国内, 我们首次把Lovo细胞系培养于干细胞培养基中, 分离呈悬浮肿瘤球生长的SP细胞, 利用有限稀释试验计算出SP细胞大约占0.54%-0.62%, 并进一步通过自我更新、分化能力、交替生长和Musashi-1免疫化学染色试验来鉴定其是否具有干细胞特性.
为了有效的分离SP细胞, 我们首先优化配制肿瘤干细胞培养基. 无血清培养基能够使胚胎干细胞处于未分化状态, 有助于培养人类胚胎干细胞[20]. 在SFM中额外加入bFGF和EGF能够诱导神经干细胞的多能增殖、自我更新和扩张[21-22]. Kondo et al[7]指出了胶质瘤C6 SP细胞生长在加有bFGF和PDGF的无血清培养液中, 10 d以后呈现悬浮和神经样细胞集落生长现象; 并进一步说明了bFGF能够维持C6 SP细胞的生长和扩增, 但是PDGF刺激这些细胞进行增殖. Haraguchi et al[19]指出在加有bFGF和EGF的无血清培养基中额外加入LIF能够有效的扩增HuH7 SP细胞. 通过论证, 我们在无血清培养基中加入EGF, bFGF和LIF, 可以有效的从Lovo中培养分离呈悬浮细胞球样生长的SP细胞.
Singh et al[23]通过原代培养分离出的SP细胞具有快速增殖和自我更新的能力, 并论证了SP细胞在无血清培养基中呈悬浮球样生长, 并且随着时间的延长, SP所占的比例增加. 本实验Lovo中的SP细胞具有以下特征: 在SFM中呈悬浮样生长, 并能形成克隆性的细胞球-肿瘤干细胞球, 并能连续传代; 随着时间的延长, 其肿瘤细胞球的数量增加, 体积增大, 体现出SP细胞的快速增殖性; SP形成的肿瘤细胞球制备成单细胞后仍可以形成肿瘤细胞球, 但是N-SP不具有这样的能力. Lovo细胞能够在传统的含血清培养基中长期培养, 也能在无血清培养基中长期增殖、传代, 使细胞系得以长期维持; 并且观察到随着培养基和培养方式的更换, 能在悬浮的肿瘤细胞球和贴壁的单细胞层之间转换. 这样, 我们可以根据需要进行培养.
Musashi-1是种RNA连接蛋白, 可以标记增殖神经祖细胞包括中枢神经系统的干细胞[24]. Musashi-1通过抑制特异的mRNAs转录来维持干细胞状态、分化和肿瘤发生, 在哺乳动物中, Musashi-1则主要是通过抑制m-Numb激活Notch信号[25]. 目前, 越来越多的证据显示Musashi-1可以作为肠道干细胞的标记[26-29]. 朱永良et al[30]从人胚肠中分离正常大肠干细胞, 用RT-PCR检测示该细胞株表达Musashi-1 mRNA, 存在非对称性有丝分裂. 在本实验里, 我们发现, 在SFM培养的细胞中, 并非所有的细胞球均染色阳性, 这种细胞球可能为细胞黏附团, 也可能是肿瘤细胞球并非均含有肿瘤干细胞; 部分悬浮的单个细胞染色也可阳性, 这可能是因为肿瘤干细胞正处于不同的生长周期, 也可能说明了SP细胞中富含有干细胞, 但并不是唯一所在[31]. 但是, 在SFM中额外加入FBS后, 可以促使单细胞黏附, 肿瘤细胞球逐渐分裂、变小, 直至最后变为没有增殖、分化以及自我更新能力的N-SP细胞, 其Musashi-1染色阴性. 这与Tomita et al[32]观察结果相似.
总之, 我们通过形态、分化、自我更新、交替培养和细胞化学染色试验说明了Lovo细胞系中含有少量的能够在无血清培养基中存活、增殖, 自我更新并呈悬浮肿瘤细胞球生长以及Musashi-1阳性的SP细胞. 我们应该进一步纯化SP细胞, 以便更好的研究癌症干细胞的特性.
肿瘤细胞与干细胞具有许多相似的特殊特性. 他们均为不死细胞, 并具有良好的分化能力. 而且, 器官形成和癌发生具有相似的过程. 最近, 越来越多的证据显示肿瘤是一种干细胞疾病, 是由具有成瘤能力的肿瘤细胞增殖发育而成的异常组织. 目前在白血病、乳腺瘤、脑肿瘤和胰腺癌中已经论证了肿瘤干细胞的存在.
目前尚不能从形态学来鉴定肿瘤干细胞, 而是用功能学方法, 即对其自我更新能力和分化潜力两个主要特征进行评价. 当今研究主要集中在耐药性、基因表达差异以及表型鉴定等方面.
本文优化配制了胃肠道肿瘤干细胞培养基, 成功分离培养出悬浮样生长的肿瘤干细胞球, 并首次鉴定出这种细胞球表达Musashi-1, 这被认为是胃肠道肿瘤干细胞的标记物.
本试验优化配置了干细胞培养基, 并鉴定出肿瘤干细胞球表达Musashi-1, 为胃肠道肿瘤中是否存在干细胞提供了证据, 可以为癌症的诊断和治疗提供更为有效的方法.
肿瘤干细胞: 肿瘤细胞中仅有极少数的细胞具有成瘤潜能, 他们数量虽少, 但具有干细胞特征, 可无限增殖, 并可以不对称分裂. 他们在肿瘤的形成和生长过程中起到了决定性作用.
本文进行了大肠癌细胞系Lovo中亚群(SP)细胞的分离培养和鉴定, 内容新颖, 结果可信, 有较高的科学价值.
编辑: 王晓瑜 电编:张敏
| 1. | Wulf GG, Wang RY, Kuehnle I, Weidner D, Marini F, Brenner MK, Andreeff M, Goodell MA. A leukemic stem cell with intrinsic drug efflux capacity in acute myeloid leukemia. Blood. 2001;98:1166-1173. [PubMed] [DOI] |
| 2. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 3. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 4. | Yasuda A, Sawai H, Takahashi H, Ochi N, Matsuo Y, Funahashi H, Sato M, Okada Y, Takeyama H, Manabe T. The stem cell factor/c-kit receptor pathway enhances proliferation and invasion of pancreatic cancer cells. Mol Cancer. 2006;5:46. [PubMed] [DOI] |
| 5. | Prince ME, Sivanandan R, Kaczorowski A, Wolf GT, Kaplan MJ, Dalerba P, Weissman IL, Clarke MF, Ailles LE. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc Natl Acad Sci USA. 2007;104:973-978. [PubMed] [DOI] |
| 7. | Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc Natl Acad Sci USA. 2004;101:781-786. [PubMed] [DOI] |
| 8. | Hirschmann-Jax C, Foster AE, Wulf GG, Nuchtern JG, Jax TW, Gobel U, Goodell MA, Brenner MK. A distinct "side population" of cells with high drug efflux capacity in human tumor cells. Proc Natl Acad Sci USA. 2004;101:14228-14233. [PubMed] [DOI] |
| 9. | Hemmati HD, Nakano I, Lazareff JA, Masterman-Smith M, Geschwind DH, Bronner-Fraser M, Kornblum HI. Cancerous stem cells can arise from pediatric brain tumors. Proc Natl Acad Sci U S A. 2003;100:15178-15183. [PubMed] [DOI] |
| 10. | Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, Henkelman RM, Cusimano MD, Dirks PB. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401. [PubMed] [DOI] |
| 11. | Pardal R, Clarke MF, Morrison SJ. Applying the principles of stem-cell biology to cancer. Nat Rev Cancer. 2003;3:895-902. [PubMed] [DOI] |
| 12. | Beachy PA, Karhadkar SS, Berman DM. Tissue repair and stem cell renewal in carcinogenesis. Nature. 2004;432:324-331. [PubMed] [DOI] |
| 13. | Bellows CG, Aubin JE. Determination of numbers of osteoprogenitors present in isolated fetal rat calvaria cells in vitro. Dev Biol. 1989;133:8-13. [PubMed] [DOI] |
| 14. | Tropepe V, Sibilia M, Ciruna BG, Rossant J, Wagner EF, van der Kooy D. Distinct neural stem cells proliferate in response to EGF and FGF in the developing mouse telencephalon. Dev Biol. 1999;208:166-188. [PubMed] [DOI] |
| 15. | Goodell MA, Brose K, Paradis G, Conner AS, Mulligan RC. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 1996;183:1797-1806. [PubMed] [DOI] |
| 16. | Shimano K, Satake M, Okaya A, Kitanaka J, Kitanaka N, Takemura M, Sakagami M, Terada N, Tsujimura T. Hepatic oval cells have the side population phenotype defined by expression of ATP-binding cassette transporter ABCG2/BCRP1. Am J Pathol. 2003;163:3-9. [PubMed] [DOI] |
| 17. | Falciatori I, Borsellino G, Haliassos N, Boitani C, Corallini S, Battistini L, Bernardi G, Stefanini M, Vicini E. Identification and enrichment of spermatogonial stem cells displaying side-population phenotype in immature mouse testis. FASEB J. 2004;18:376-378. [PubMed] |
| 18. | Hadnagy A, Gaboury L, Beaulieu R, Balicki D. SP analysis may be used to identify cancer stem cell populations. Exp Cell Res. 2006;312:3701-3710. [PubMed] [DOI] |
| 19. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 20. | Hong-mei P, Gui-an C. Serum-free medium cultivation to improve efficacy in establishment of human embryonic stem cell lines. Hum Reprod. 2006;21:217-222. [PubMed] [DOI] |
| 21. | Reynolds BA, Weiss S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev Biol. 1996;175:1-13. [PubMed] [DOI] |
| 22. | Reynolds BA, Tetzlaff W, Weiss S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J Neurosci. 1992;12:4565-4574. [PubMed] |
| 23. | Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB. Identification of a cancer stem cell in human brain tumors. Cancer Res. 2003;63:5821-5828. [PubMed] |
| 24. | Sakakibara S, Okano H. Expression of neural RNA-binding proteins in the postnatal CNS: implications of their roles in neuronal and glial cell development. J Neurosci. 1997;17:8300-8312. [PubMed] |
| 25. | Okano H, Imai T, Okabe M. Musashi: a translational regulator of cell fate. J Cell Sci. 2002;115:1355-1359. [PubMed] |
| 26. | Dekaney CM, Rodriguez JM, Graul MC, Henning SJ. Isolation and characterization of a putative intestinal stem cell fraction from mouse jejunum. Gastroenterology. 2005;129:1567-1580. [PubMed] [DOI] |
| 27. | Nishimura S, Wakabayashi N, Toyoda K, Kashima K, Mitsufuji S. Expression of Musashi-1 in human normal colon crypt cells: a possible stem cell marker of human colon epithelium. Dig Dis Sci. 2003;48:1523-1529. [PubMed] [DOI] |
| 28. | Booth C, Potten CS. Gut instincts: thoughts on intestinal epithelial stem cells. J Clin Invest. 2000;105:1493-1499. [PubMed] [DOI] |
| 29. | Potten CS, Booth C, Tudor GL, Booth D, Brady G, Hurley P, Ashton G, Clarke R, Sakakibara S, Okano H. Identification of a putative intestinal stem cell and early lineage marker; musashi-1. Differentiation. 2003;71:28-41. [PubMed] [DOI] |
| 30. | 朱 永良, 钟 献, 郑 树. 正常大肠干细胞的条件永生化. 浙江大学学报(医学版). 2004;33:379-384. |
| 31. | Mitsutake N, Iwao A, Nagai K, Namba H, Ohtsuru A, Saenko V, Yamashita S. Characterization of side population in thyroid cancer cell lines: cancer stem-like cells are enriched partly but not exclusively. Endocrinology. 2007;148:1797-1803. [PubMed] [DOI] |
| 32. | Tomita Y, Matsumura K, Wakamatsu Y, Matsuzaki Y, Shibuya I, Kawaguchi H, Ieda M, Kanakubo S, Shimazaki T, Ogawa S. Cardiac neural crest cells contribute to the dormant multipotent stem cell in the mammalian heart. J Cell Biol. 2005;170:1135-1146. [PubMed] [DOI] |