修回日期: 2006-12-10
接受日期: 2006-12-18
在线出版日期: 2007-03-28
目的: 探讨环氧合酶-2(cyclooxygenase, COX-2)和基质金属蛋白酶-2(matrix metalloproteinase, MMP-2)在非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的发生、发展过程的作用.
方法: 取30只Wistar大鼠随机分成2组: 模型组24只饲以高脂饲料(100 g/L猪油、20 g/L胆固醇、5 g/L胆酸钠、875 g/L基础饲料)和正常对照组6只以基础饲料饲养. 分别于实验第12, 16, 24周随机处死模型组大鼠8只和正常对照组2只, 取肝组织用于HE染色和RNA提取, 应用逆转录聚合酶链反应(RT-PCR)检测肝组织COX-2 mRNA和MMP-2 mRNA的相对含量.
结果: 正常对照组肝组织COX-2 mRNA无表达; 模型组均表达, 并且随着造模时间延长COX-2 mRNA表达增强, 造模第24周肝组织COX-2 mRNA表达明显高于第12, 16周(1.035±0.040 vs 0.699±0.062, 0.533±0.059, P<0.05); MMP-2 mRNA相对表达量在造模第12周与正常组相比无明显升高, 而造模第16, 24周, 显著高于第12周(0.952±0.124, 0.726±0.064 vs 0.454±0.061, P<0.05), 造模第24周和第16周之间亦有差别(P<0.05); NASH大鼠肝组织COX-2 mRNA和MMP-2 mRNA表达有相关性(r = 0.794, P<0.05).
结论: NASH大鼠肝组织中高表达COX-2 mRNA和MMP-2 mRNA, 他们可能共同参与了NASH的形成、发展过程.
引文著录: 刘晓珺, 沈滨, 杜雅菊. 环氧合酶-2和基质金属蛋白酶-2在大鼠非酒精性脂肪肝炎中的作用. 世界华人消化杂志 2007; 15(9): 947-952
Revised: December 10, 2006
Accepted: December 18, 2006
Published online: March 28, 2007
AIM: To observe the roles of cyclooxygenase-2 (COX-2) and matrix metalloproteinase-2 (MMP-2) in the pathogenesis and development of rats with nonalcoholic steatohepatitis (NASH).
METHODS: Thirty Wistar rats were randomly divided into model group (n = 24) and control group (n = 6), treated with high-fat diet (100 g/L lard, 20 g/L cholesterol, 5 g/L sodium cholate and 875 g/L basal forage) and basal forage, respectively. Eight rats in the model group and 2 rats in the control group were killed randomly in the 12th, 16th and 24th week, respectively, and two pieces of liver tissues were obtained. One was fixed in 40 g/L formaldehyde solution and stained for the sake of histopathological observation and the other was stored in -80 ℃ refrigerator after being quickly frozen by liquid nitrogen in order to extract RNA and detect the relative amount of COX-2 mRNA and MMP-2 mRNA in liver tissues by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: COX-2 mRNA was expressed in the model group in a time-dependent manner, but it was not detected in liver tissues of the control group. The relative amount of COX-2 mRNA expression in the 24th week was significantly higher than that in the 12th and 16th week (1.035 ± 0.040 vs 0.533 ± 0.059, 0.699 ± 0.062, P < 0.05). There was no obvious difference in the relative amount of MMP-2 mRNA expression between the model group and the control group in the 12th week. However, the relative amount of MMP-2 mRNA expression in the 16th and 24th week in the model group was markedly higher than that in the 12th week (0.952 ± 0.124, 0.726 ± 0.064 vs 0.454 ± 0.061, P < 0.05), and the difference was also observed between the 16th and 24th week (P < 0.05). Correlation was detected between the expression of COX-2 mRNA and MMP-2 mRNA in liver tissues of NASH rats (r = 0.794, P < 0.05).
CONCLUSION: COX-2 and MMP-2 mRNA are highly expressed in liver tissues of NASH rats, which may take part in the pathogenesis and development of NASH.
- Citation: Liu XJ, Shen B, Du YJ. Role of cyclooxygenase-2 and matrix metalloproteinase-2 in nonalcoholic steatohepatitis of rats. Shijie Huaren Xiaohua Zazhi 2007; 15(9): 947-952
- URL: https://www.wjgnet.com/1009-3079/full/v15/i9/947.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i9.947
近年来大量研究表明, 非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)的发生、发展伴随着物质代谢紊乱及肝细胞坏死、炎变和纤维化的形成. 而非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)是发展为肝纤维化的前提条件[1], 如不能及时阻止炎症、坏死进展, 将最终导致肝纤维化和肝硬化. 环氧合酶-2(cyclooxygenase, COX-2)和基质金属蛋白酶-2(matrix metalloproteinase, MMP-2)在多种组织炎症损伤、纤维化形成的病理过程中起作用. 我们通过建立大鼠NASH模型, 应用RT-PCR方法检测肝组织COX-2, MMP-2 mRNA的表达, 探讨COX-2和MMP-2在NASH的发生、发展过程的作用.
♂Wistar大鼠30只, 体质量150±10 g, 由哈尔滨医科大学附属第二医院动物中心提供. 冰冻高速离心机, PTC-100热循环仪, GE-100电泳仪, 全自动凝胶成像系统, 紫外分光光度计. 胆固醇、胆酸钠购自北京奥博星生物技术有限公司; 猪油自备; TRLzol试剂购于Gibco BRL公司; 三氯甲烷, 异丙醇分别由北京化工厂和天津市凯通化学试剂公司提供; dNTP, DNA Marker购自宝生物工程有限公司; M-MLV Reverse Transcriptase, Taq DNA聚合酶为Pramega产品; COX-2和MMP-2引物由上海生工合成, 甘油三酯测定试剂盒、胆固醇测定试剂盒、ALT检测试剂盒、AST检测试剂盒由北京中生生化试剂有限公司提供.
1.2.1 实验动物及分组: 30只Wistar大鼠正常喂养1 wk后, 随机分成2组: 模型组24只, 饲以高脂饲料(100 g/L猪油、20 g/L胆固醇、5 g/L胆酸钠、875 g/L基础饲料)和正常对照组6只, 以基础饲料饲养, 2组大鼠均自由饮水, 分别于实验第12, 16, 24周随机处死模型组大鼠8只和正常对照组2只. 动物处死前隔夜禁食水, 以100 g/L水合氯醛腹腔麻醉, 取肝右叶中部2小块肝组织, 一块用40 g/L甲醛溶液固定, 石蜡包埋, 切片, HE染色; 另一块液氮速冻后存于-80 ℃冰箱, 用于RNA提取.
1.2.2 肝脏病理学观察: 肝脏石蜡切片HE染色观察肝细胞脂肪变性、炎症及坏死情况.
1.2.3 总RNA提取: 从液氮中取100 mg肝组织在冰上碾磨成细粉末, 加入1 mL TRIzol试剂, 按说明书提取总RNA. 10 g/L琼脂糖凝胶电泳显示28S和18S亚基; 紫外分光光度计测定总RNA含量及纯度, A260/A280比值为1.8-2.0, 说明提取RNA质量较好.
1.2.4 cDNA合成: 反应体系: 5×Buffer 5 μL, dNTP (2.5 mmol/L) 5 μL, 下游引物(10 pmol/L) 1 μL, M-MLV(反转录酶) 1 μL, 总RNA 2 μg, 焦碳酸二乙酯(diethypyrocarbonate, DEPC)水补足总体系25 μL; 反应参数: 42 ℃ 30 min.
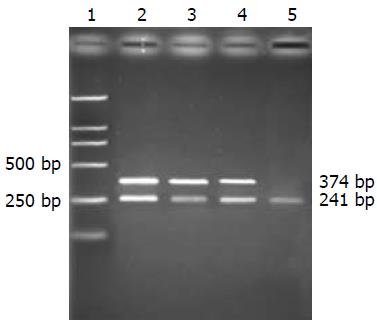
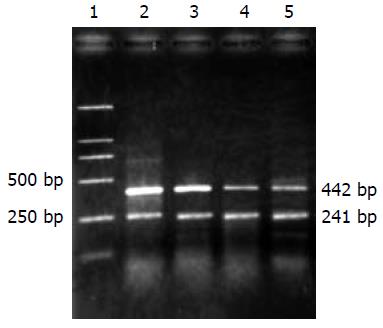
1.2.5 PCR扩增: 根据GenBank引物设计为: COX-2上游: 5'-CCATGTCAAAACCGTGGTGAATG-3'(197-219), 下游: 5'-ATGGGAGTTGGGCAGTCATCAG-3'(549-570), 扩增片段长度为374 bp; MMP-2上游: 5'-CCATGTGTCTTCCCCTTCAC-3'(1515-1534), 下游: 5'-CGATGCCATCAAAGACAATG-3'(1895-1915), 扩增片段长度为442 bp; 设置β-actin为阳性参照, 引物序列: 上游: 5'-AACCCTAAGGCCAACCGTGAAAAG-3', 下游: 5'-TCATGAGGTAGTCTGTCAGGT-3', 扩增片段长度是241 bp; 同时设水为阴性对照. COX-2及β-actin PCR反应体系: 10×Buffer 2.5 mL, dNTP (2.5 mmol/L) 2 mL, MgCl2 (25 mmol/L) 1.5 mL, 上、下游引物(10 pmol/L)各0.75 mL, Taq DNA聚合酶0.5 mL, cDNA 2 mL, 水补足体系至25 mL; 反应参数: 95 ℃预变性5 min; 94 ℃ 45 s, 61 ℃ 45 s, 72 ℃ 60 s, 32个循环; 72 ℃ 7 min. MMP-2 PCR反应体系: 10×Buffer 2.5 mL, dNTP (2.5 mmol/L) 2 mL, MgCl2 (25 mmol/L) 1.8 mL, 上、下游引物(10 pmol/L)各1 mL, Taq DNA聚合酶0.5 mL, cDNA 2 mL, 水补足体系至25 mL; 反应参数: 95 ℃预变性5 min; 94 ℃ 45 s, 58 ℃ 60 s, 72 ℃ 60 s, 32个循环; 72 ℃ 7 min. 产物于20 g/L琼脂糖凝胶电泳, 溴化乙锭染色(10 mg/L)后, 通过凝胶成像系统对目的电泳条带进行光密度扫描, 与β-actin形成条带进行比较, 表示COX-2, MMP-2 mRNA的相对表达水平.
统计学处理 所有数据以均数±标准差表示, 并进行方差分析及q检验.
实验动物无1例死亡, 正常组大鼠, 毛有光泽、体质量逐渐增长、反应灵敏、活跃. 高脂组大鼠体质量增加明显, 但16 wk后出现体毛无光泽、发黄, 精神萎靡, 懒动, 进食量减少, 体质量增长缓慢.
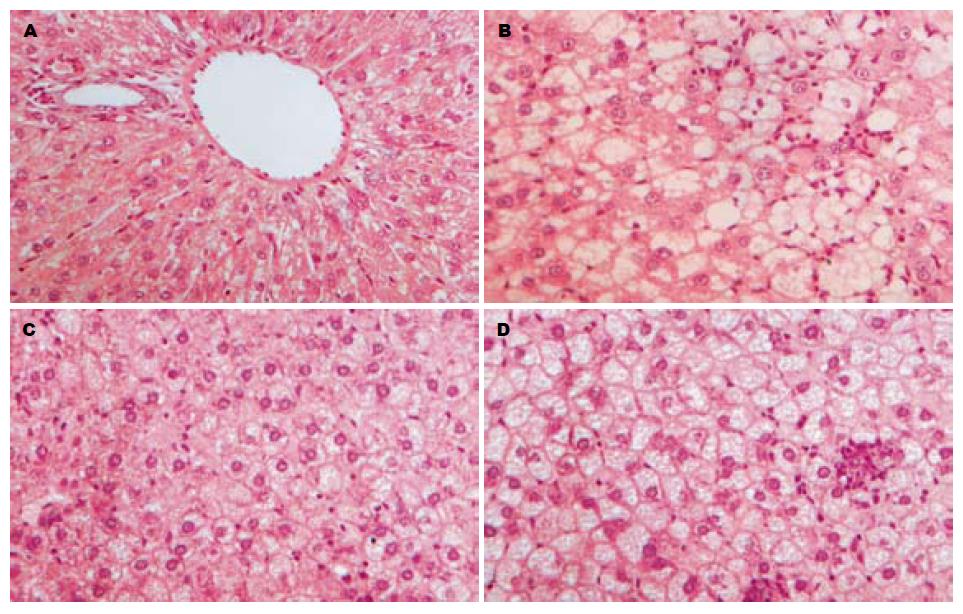
肉眼观, 正常组大鼠肝脏外观呈红褐色, 形状规则, 表面光滑; 模型组大鼠肝脏体积增大, 外形饱满, 呈土黄色, 表面有弥漫性细颗粒样隆起, 切面油腻, 质地较脆. 镜下所见, 正常组大鼠肝组织结构完整、清晰, 肝小叶结构正常, 肝细胞排列成肝索, 在中央静脉周围呈放射状分布, 细胞呈多边形; 造模12 wk出现单纯性脂肪肝, 肝细胞体积增大, 脂肪变以大泡性为主, 细胞核被挤向一边, 弥漫累及整个肝小叶; 16 wk及24 wk肝细胞脂肪变基础上出现气球样变、胞质疏松化, 小叶内炎症细胞浸润, 部分可见散在点状坏死(图1).
大鼠血清甘油三酯(TG)在造模12 wk就出现增长, 第16周和第24周显著高于第12周(P<0.05); 血清胆固醇(TC)、ALT及AST在造模第12周较正常对照组没有明显变化, 而造模第16周和第24周则明显升高(P<0.05)(表1).
正常对照组肝组织COX-2 mRNA无表达; 模型组均表达, 造模第12周大鼠肝脏组织COX-2 mRNA表达的相对量是0.533, 造模第16周和第24周肝组织COX-2 mRNA的相对表达量显著高于第12周(P<0.05, 表2, 图2).
正常对照组MMP-2 mRNA表达相对量为0.41, 造模第12周大鼠肝脏组织MMP-2 mRNA相对表达量无明显升高; 造模16 wk和24 wk大鼠肝脏组织MMP-2 mRNA表达的相对量显著高于第12周(P<0.05); 造模第24周和第16周之间亦有差别(P<0.05)(表2, 图3).
随着造模时间延长, NASH的形成, 大鼠肝组织COX-2 mRNA表达增强, MMP-2 mRNA表达亦增多, 具有相关性(r = 0.794, P<0.05).
COX是合成前列腺素(prostaglandins, PGs)的关键酶, COX有3种同工酶. COX-2是经刺激迅速产生的诱导酶, 正常情况下, COX-2在多数组织不表达或低表达, 而在炎症、肿瘤等病理状态下起重要作用, 其表达上调出现于许多疾病过程中[2-3]. 近年的研究表明, COX-2与急慢性肝损伤的发病密切相关[4-6]. 大量实验证明COX-2在酒精性肝病(alcoholic liver disease, ALD)时阳性表达[7-10]. 还有研究显示, COX-2在慢性乙型肝炎中随着肝脏炎症活动程度的加重而表达相应增加[11-12]. 本实验中正常对照组大鼠肝组织结构正常, RT-PCR检测未见COX-2 mRNA表达, 与Okamoto et al[13]结论一致; 观察发现, 在造模第12周, 单纯性脂肪肝形成阶段已有COX-2 mRNA表达, 并且随着造模时间延长, NASH形成和发展, 肝脏组织COX-2 mRNA表达亦增强.
在NASH患者中, 内毒素或内源性酒精可使库普弗细胞被激活[14]. 诸多研究显示库普弗细胞在许多不同类型的肝损害的发病过程中起作用[15-16]. 库普弗细胞是COX-2 mRNA的主要来源, Mohammed et al[17]通过免疫组化的方法发现, 在有炎性细胞浸润的肝组织中, 除了有COX-1表达外, COX-2表达明显升高, 而正常对照组库普弗细胞只表达COX-1. Enomoto et al[18]证明, 在ALD中, 库普弗细胞被激活, 表达COX-2增高, 其产物PGE2水平升高; 灭活库普弗细胞后, PGE2水平下降, 可以减轻乙醇诱导的肝脂肪变性. 在NASH患者中, 内毒素刺激多种细胞合成花生四烯酸(AA), 成为诱导COX-2的主要因素之一. 脂质过氧化物可以诱导COX-2基因表达, 反应性氧中间介质可参与炎性因子刺激引起的COX-2表达的诱导. Yu et al[19]在PPAR-α(-/-)的脂肪肝鼠模型中发现COX-2表达增加, 同时有NF-κB的激活和TNF-α, 白介素-6(IL-6), 细胞间黏附分子-1(ICAM-1)等细胞因子的表达增加, 得出结论, PPAR-α禁止炎症反应, 改善NASH炎症程度是通过抑制COX-2活性而实现的. 研究显示, 高表达的COX-2使炎症介质PGE2和TXB2等生成增加, 促进炎症细胞浸润; 同时还可通过调节NF-κB释放多种炎症介质, 如TNF-α、白介素-8 (IL-8)、ICAM-1、E选择素(E-selectin)等[20-21]. 这些炎症介质又可进一步激活COX-2的表达, 形成一种正反馈环路, 扩大炎症反应, 延长炎症过程, 最终造成更严重的肝损害.
MMPs是细胞外基质大分子降解的主要酶类, 在损伤组织的修复和重建过程中起着重要作用[22]. MMP-2是MMPs家族中的主要成员之一, 又称明胶酶A. MMP-2主要降解基底膜成份, 启动和加重肝纤维化, 并在肝纤维化过程中持续升高[23]. 大量的动物实验和临床研究已经验证在急慢性肝损伤的肝组织修复、肝纤维化形成过程中有MMP-2的高表达[24-26]. 我们在造模第12周, 病理显示为单纯性脂肪肝, 肝组织MMP-2 mRNA相对含量增高, 但与正常对照组没有明显差别; 于造模第16, 24周, 肝组织MMP-2 mRNA相对含量显著高于正常对照组, 并且第24周与第16周之间亦有差别. MMP-2的表达增加可能与炎症坏死的肝细胞, 尤其是库普弗细胞释放的多种细胞因子调节有关[27], 如胰岛素样生长因子、血小板衍生生长因子等可以激活肝星型细胞, 上调MMP-2酶原的表达; TNF-α可以激活转录因子NF-κB, 后者跨膜激活p53, 间接诱导MMP-2的转录.
Callejas et al[28]报道, 用致炎细胞因子(proinflammatory cytokines)、内毒素和肝细胞生长因子(hepatocyte growth factor, HGF)处理原代培养的胎肝细胞, 促进COX-2的表达和大量PGs的合成的同时, MMP-2, 9的活性形式可以释放到细胞外介质, 而使用COX-2抑制剂可以抑制这一过程, 这说明COX-2及其PGs产物可以促进生长因子、炎性介质刺激的胎肝细胞释放MMPs. Nunez et al[29]观察了32例抗-HCV(+)和10例抗-HCV(-)患者肝活检组织, 证实在抗-HCV(+)患者肝组织中COX-2, MMP-2和MMP-9的表达是显著增高的, 并且促进了肝纤维化的发生、发展. 在我们的实验中, 高脂饮食第16, 24周的大鼠形成NASH, 大鼠肝组织COX-2 mRNA表达增强, MMP-2 mRNA表达亦增多, 二者有明显的相关性(P<0.05). COX-2及其产物PGE2、PGI2相互作用, 可以刺激肝星状细胞(hepatic stellate cell, HSC)增生, 应用选择性COX-2抑制剂SC-236, 可以增加HSC凋亡, 诱导PPAR-γ的表达和激活, 使肝纤维化得到改善[30]. 大多数学者通过HSC分离培养的研究表明, HSC特别是激活的HSC是肝内MMP-2的主要来源. 而激活的MMP-2又能够降解HSC周围的基底膜的正常基质成分如Ⅳ型胶原、层黏连蛋白等, 改变细胞的微环境, 进一步刺激HSC活化, 增殖、转化成肌成纤维细胞样细胞, 促进包括Ⅰ, Ⅲ型胶原纤维在内的ECM形成, 而Ⅰ型胶原沉积在过度状态或已转化的HSC周围, 使模型基质金属蛋白酶Ⅰ表达增加, 后者刺激MMP-2酶原的激活和上调MMP-2的表达, 继续降解窦周基质, 促进未转化的HSC活化, 各种细胞因子释放, 促进ECM分泌增多, 造成恶性循环, 最终导致纤维化的形成与发展.
我们通过实验证实, 在NASH大鼠肝组织中有COX-2 mRNA和MMP-2 mRNA的高表达, 并且二者的表达呈现明显的相关性, 推测他们共同参与了NASH的形成、发展过程, 这为NASH的防治提供了新的靶点.
非酒精性脂肪性肝炎(NASH)是发展为肝纤维化的前提条件, 如不能及时阻止炎症、坏死进展, 将最终导致肝纤维化和肝硬化. 环氧合酶-2(COX-2)和基质金属蛋白酶-2(MMP-2)在多种组织炎症损伤、纤维化形成的病理过程中起作用. 因此检测肝组织COX-2, MMP-2mRNA的表达, 探讨COX-2和MMP-2在NASH的发生、发展过程的作用具有一定的理论价值.
本文研究了COX-2和MMP-2在大鼠非酒精性脂肪肝中作用, 文章写作规范, 设计较为合理, 有一定的理论价值.
编辑: 王晓瑜 电编:张敏
| 1. | Brunt EM. Nonalcoholic steatohepatitis. Semin Liver Dis. 2004;24:3-20. [PubMed] [DOI] |
| 2. | Eschwège P, de Ledinghen V, Camilli T, Kulkarni S, Dalbagni G, Droupy S, Jardin A, Benoît G, Weksler BB. [Arachidonic acid and prostaglandins, inflammation and oncology]. Presse Med. 2001;30:508-510. [PubMed] |
| 3. | Gilroy DW, Colville-Nash PR. New insights into the role of COX 2 in inflammation. J Mol Med (Berl). 2000;78:121-129. [PubMed] [DOI] |
| 5. | Tsukada K, Hasegawa T, Tsutsumi S, Kuwano H. Roles of cyclooxygenase-2 in tissue injury during hemorrhagic shock. Shock. 2000;13:392-396. [PubMed] [DOI] |
| 7. | Mathurin P, Deng QG, Keshavarzian A, Choudhary S, Holmes EW, Tsukamoto H. Exacerbation of alcoholic liver injury by enteral endotoxin in rats. Hepatology. 2000;32:1008-1017. [PubMed] [DOI] |
| 9. | 易 辉, 王 新, 苗 继延, 杜 静平, 潘 阳林, 刘 娜, 张 宇梅, 樊 代明. 选择性环氧合酶-2抑制剂对大鼠酒精性肝损伤的保护作用. 中华肝脏病杂志. 2003;11:663-666. |
| 10. | Nanji AA, Jokelainen K, Tipoe GL, Rahemtulla A, Dannenberg AJ. Dietary saturated fatty acids reverse inflammatory and fibrotic changes in rat liver despite continued ethanol administration. J Pharmacol Exp Ther. 2001;299:638-644. [PubMed] |
| 12. | Cheng J, Imanishi H, Iijima H, Shimomura S, Yamamoto T, Amuro Y, Kubota A, Hada T. Expression of cyclooxygenase 2 and cytosolic phospholipase A(2) in the liver tissue of patients with chronic hepatitis and liver cirrhosis. Hepatol Res. 2002;23:185-195. [PubMed] [DOI] |
| 13. | Okamoto T, Hino O. Expression of cyclooxygenase-1 and -2 mRNA in rat tissues: tissue-specific difference in the expression of the basal level of mRNA. Int J Mol Med. 2000;6:455-457. [PubMed] |
| 15. | Watanabe N, Miura S, Zeki S, Ishii H. Hepatocellular oxidative DNA injury induced by macrophage-derived nitric oxide. Free Radic Biol Med. 2001;30:1019-1028. [PubMed] [DOI] |
| 16. | Enomoto N, Ikejima K, Yamashina S, Hirose M, Shimizu H, Kitamura T, Takei Y, Sato And N, Thurman RG. Kupffer cell sensitization by alcohol involves increased permeability to gut-derived endotoxin. Alcohol Clin Exp Res. 2001;25:51S-54S. [PubMed] [DOI] |
| 17. | Mohammed NA, Abd El-Aleem SA, El-Hafiz HA, McMahon RF. Distribution of constitutive (COX-1) and inducible (COX-2) cyclooxygenase in postviral human liver cirrhosis: a possible role for COX-2 in the pathogenesis of liver cirrhosis. J Clin Pathol. 2004;57:350-354. [PubMed] [DOI] |
| 18. | Enomoto N, Ikejima K, Yamashina S, Enomoto A, Nishiura T, Nishimura T, Brenner DA, Schemmer P, Bradford BU, Rivera CA. Kupffer cell-derived prostaglandin E(2) is involved in alcohol-induced fat accumulation in rat liver. Am J Physiol Gastrointest Liver Physiol. 2000;279:G100-G106. [PubMed] |
| 19. | Yu J, Ip E, Dela Peña A, Hou JY, Sesha J, Pera N, Hall P, Kirsch R, Leclercq I, Farrell GC. COX-2 induction in mice with experimental nutritional steatohepatitis: Role as pro-inflammatory mediator. Hepatology. 2006;43:826-836. [PubMed] [DOI] |
| 20. | Leclercq IA, Farrell GC, Sempoux C, dela Peña A, Horsmans Y. Curcumin inhibits NF-kappaB activation and reduces the severity of experimental steatohepatitis in mice. J Hepatol. 2004;41:926-934. [PubMed] [DOI] |
| 21. | Spitzer JA, Zheng M, Kolls JK, Vande Stouwe C, Spitzer JJ. Ethanol and LPS modulate NF-kappaB activation, inducible NO synthase and COX-2 gene expression in rat liver cells in vivo. Front Biosci. 2002;7:a99-108. [PubMed] [DOI] |
| 22. | 李 保森, 游 绍莉, 赵 志海, 辛 绍杰, 赵 景民, 王 松山. 实验性肝纤维化形成过程中几种基质金属蛋白酶表达的研究. 世界华人消化杂志. 2003;11:483-485. [DOI] |
| 23. | 孟 二红, 赵 景民, 王 松山, 刘 旺霞, 刘 平, 周 光德, 张 泰和. 基质金属蛋白酶在非酒精性脂肪性肝炎患者肝组织中的表达. 世界华人消化杂志. 2002;10:1257-1260. [DOI] |
| 24. | Knittel T, Mehde M, Grundmann A, Saile B, Scharf JG, Ramadori G. Expression of matrix metalloproteinases and their inhibitors during hepatic tissue repair in the rat. Histochem Cell Biol. 2000;113:443-453. [PubMed] |
| 25. | Galli A, Svegliati-Baroni G, Ceni E, Milani S, Ridolfi F, Salzano R, Tarocchi M, Grappone C, Pellegrini G, Benedetti A. Oxidative stress stimulates proliferation and invasiveness of hepatic stellate cells via a MMP2-mediated mechanism. Hepatology. 2005;41:1074-1084. [PubMed] [DOI] |
| 27. | Knittel T, Mehde M, Kobold D, Saile B, Dinter C, Ramadori G. Expression patterns of matrix metalloproteinases and their inhibitors in parenchymal and non-parenchymal cells of rat liver: regulation by TNF-alpha and TGF-beta1. J Hepatol. 1999;30:48-60. [PubMed] [DOI] |
| 28. | Callejas NA, Casado M, Díaz-Guerra MJ, Boscá L, Martín-Sanz P. Expression of cyclooxygenase-2 promotes the release of matrix metalloproteinase-2 and -9 in fetal rat hepatocytes. Hepatology. 2001;33:860-867. [PubMed] [DOI] |
| 29. | Núñez O, Fernández-Martínez A, Majano PL, Apolinario A, Gómez-Gonzalo M, Benedicto I, López-Cabrera M, Boscá L, Clemente G, García-Monzón C. Increased intrahepatic cyclooxygenase 2, matrix metalloproteinase 2, and matrix metalloproteinase 9 expression is associated with progressive liver disease in chronic hepatitis C virus infection: role of viral core and NS5A proteins. Gut. 2004;53:1665-1672. [PubMed] [DOI] |